Nd-Er/ZnO-TiO2光催化剂制备及对酸性品红的光催化降解效应
陈昕海 ,陈 星 ,王小丽 ,李廷真 *
(1.重庆三峡学院 环境与化学工程学院,重庆 404100;2.“三峡库区水环境演变与污染防治”重庆高校市级重点实验室,重庆 404100)
工业化给人类社会带来了极大的便利,但环境污染也很大程度上随着工业化的不断推进而日趋严重[1]。同时,人类活动的加剧以及非人类活动因素等都造成不同程度的环境污染。在众多环境污染中,人类赖以生存的水资源污染尤其严重。如何解决日益加重的水污染问题,实现人类社会可持续发展已成为当今社会面临的巨大挑战。
上世纪70年代初以TiO2为代表的光催化氧化技术为解决水污染打开了一扇新的窗口。半导体纳米材料TiO2以其优越的光催化活性、成本低廉等优点在环保领域应用广泛[2-5]。然而太阳能利用率低及光生空穴与电子复合率高也限制了其大规模使用[6]。为改善其光催化活性,人们对TiO2进行了离子掺杂、贵金属沉积、复合半导体[7]等改性探索。其中,对TiO2进行半导体复合与稀土掺杂研究已成为改善TiO2光催化活性的有效途径[8]。稀土元素因丰富的能级、特殊4f轨道电子跃迁等特点成为TiO2改性的重点研究对象[9]。此外,ZnO与TiO2具有相近禁带宽度[10]和交错能带位置,ZnO的复合可抑制TiO2晶型转变过程和粒子生长,使得ZnOTiO2复合半导体吸收紫外线的能力较TiO2有一定提高[11]。酸性品红是一种有机偶氮染料,是染料废水中的重要物质。H2O2是一种环境友好型电子供体,可在催化体系中充当助催剂,在催化降解酸性品红的研究[12]中已经应用,使整体光催化效果更佳。
本文在前人研究基础上采用稀土共掺杂及复合半导体两种方法对纳米TiO2进行改性,以酸性品红为目标污染物进行光催化实验,加入适量H2O2,用300w长弧氙灯照射,探究H2O2与光催化剂对酸性品红降解的协同作用。
1 实验
1.1 试剂与仪器
钛酸丁酯[Ti(OC4H9)4](天津市科密欧化学试剂有限公司),六水合硝酸锌[Zn(NO3)2·6H2O](阿拉丁试剂上海晶纯生化科技股份有限公司),六水合硝酸钕[Nd(NO3)3·6H2O](阿拉丁试剂上海晶纯生化科技股份有限公司),五水合硝酸铒[Er(NO3)3·5H2O](阿拉丁试剂上海晶纯生化科技股份有限公司),冰醋酸(重庆北碚化学试剂厂),30%过氧化氢(重庆川东化工集团有限公司),无水乙醇(重庆川东化工集团有限公司),酸性品红(上海试剂总厂第三分厂),试剂均为分析纯。
所使用的表征仪器如下:X射线衍射仪(德国布鲁克公司,D8advance);比表分析仪(美国康塔仪器公司,Autosorb-IQ2-MP-XR-VP);红外光谱仪(安捷伦科技有限公司,cary 660);光化学反应仪(上海比郎仪器有限公司);紫外可见光分光光度计。
1.2 光催化剂的制备
将30 mL Ti(OC4H9)4加入35 mL无水乙醇中,均匀搅拌得溶液A,将适量的Zn(NO3)2·6H2O与5 mL去离子水、10 mL冰醋酸、35 mL无水乙醇混合搅拌,得溶液B;边搅拌边将溶液A经滴液漏斗缓慢滴入溶液B中,在室温下继续搅拌2 h形成均匀透明溶胶。室温下陈化24 h,真空干燥箱100℃烘干并碾成粉末,并在550℃下煅烧2 h,得到ZnO含量分别为0,5%,10%,15%,20%的ZnO-TiO2复合半导体体系。
以5%的ZnO-TiO2复合半导体为基准采用上述同样的制备方法并加入适量 Nd(NO3)3·6H2O/Er(NO3)3·5H2O制备出不同含量的稀土单掺杂与共掺杂光催化剂(包括Nd掺杂比例分别为0.5%,1%,1.5%,2%,2.5%,3%的Nd/5%ZnO-TiO2的光催化剂;Er掺杂比例分别为0.5%,1%,1.5%,2%,2.5%,3%的Er/5%ZnO-TiO2的光催化剂;Nd-Er掺杂比例分别为0.5%+0.5%,1%+1%,1.5%+1.5%,2%+2%的Nd-Er/5%ZnO-TiO2的光催化剂),选取1%Nd-1%Er/5%ZnO-TiO2样品在550℃分别煅烧4 h,6 h,8 h及在450℃,500℃,600℃,650℃煅烧2 h,得到不同掺杂浓度、不同煅烧时间、不同煅烧温度的光催化剂。
1.3 光催化活性评价
将100 mg光催化剂及2 mL 30%H2O2分散到100 mL浓度为50 mg/L酸性品红溶液中,用磁力搅拌器避光搅拌后置于光化学反应仪进行测试,选用300 W长弧氙灯照射。每隔10 min取样离心分离,用紫外分光光度计在波长545 nm处测定酸性品红溶液吸光度。
2 结果与讨论
2.1 X射线衍射分析
图1为不同样品的X射线衍射(XRD)图,与标准JCPDS卡片对比,纯TiO2与5%ZnO-TiO2分别在27.5°、27.4°[13]附近出现金红石相衍射峰,明显看到纯TiO2金红石相衍射峰的峰强度比5%ZnOTiO2强,掺杂稀土Nd、Er后的样品在25.3°(101),37.9°(004),48.0°(200),55.2°(211),62.7°(204),68.9°(220),70.3°(215),75.1°(224)附近表现出锐钛矿特征衍射峰,没有发现金红石相衍射峰,说明稀土Nd、Er掺杂可抑制TiO2金红石相出现。与纯TiO2相比,掺杂稀土后的TiO2峰强度降低,衍射峰峰宽变宽。
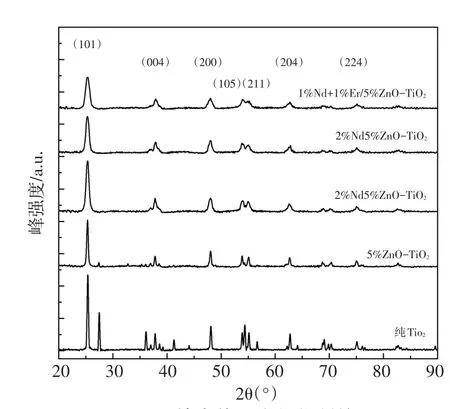
图1 不同掺杂体系光催化剂的XRDFig.1 XRD patterns of the different samples
图2为样品1%Nd-1%Er/5%ZnO-TiO2在不同煅烧温度下的XRD图,当温度由450℃逐渐升到550℃,峰强逐渐降低,峰宽变宽;当温度由550℃逐渐升到650℃时,峰强逐渐增强,峰宽变窄。图2并未出现稀土峰,由于Nd3+的离子半径(0.099 nm)与Er3+的离子半径(0.088 nm)均远大于Ti4+的半径(0.068 nm),故稀土Nd与Er不能进入TiO2晶格,经高温煅烧可能以氧化物形式分散在TiO2表面。
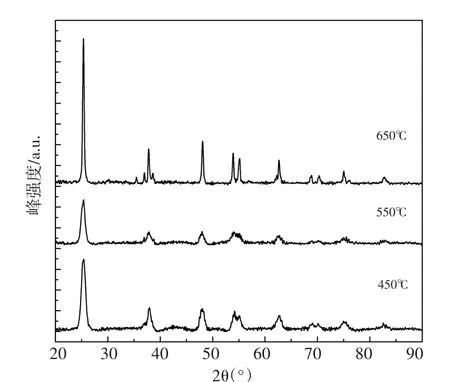
图2 1%Nd-1%Er/5%ZnO-TiO2光催化剂在不同煅烧温度下的XRDFig.2 XRD patterns of the 1%Nd-1%Er/5%ZnO-TiO2 photocatalyst calcined at different temperature
不同样品的比表面积及平均粒径如表1所示。根据Scherrer[14]公式D=0.89kλ/(b×cosθ),计算出各样品的平均晶体粒径(D)。从表征结果看,稀土Nd、Er掺杂后,TiO2比表面积有较大幅度提升,增大了与酸性品红的接触面积,TiO2平均粒径也大幅度减小,使光生空穴与电子能更快抵达TiO2表面与酸性品红发生氧化还原反应。样品1%Nd-1%Er/5%ZnO-TiO2具有最大比表面积和最小平均粒径。
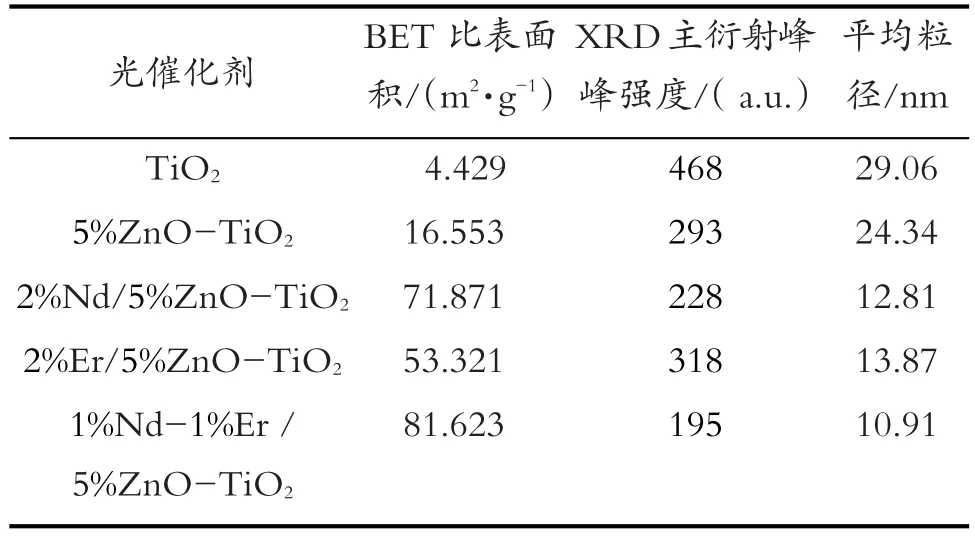
表1 光催化剂表征性质Table 1 Characterization of photocatalyst
2.2 样品红外光谱分析
图3为不同样品的红外图谱。由图结合文献可知1 653.42 cm-1附近为TiO2表面结合水O-H弯曲振动峰,稀土掺杂后,其峰有较明显变宽并红移且TiO2可吸附更多O-H,稀土Nd与Er以氧化物形式分散到TiO2表面,使粉体表面·OH增多[15],提高光催化活性;3 443.27 cm-1附近的宽吸收峰为TiO2表面游离水O-H伸缩振动峰[16],稀土掺杂后,其峰有较明显红移,形成更多羟基。400~700 cm-1附近为Ti-O特征振动吸收谱带[17]。相较于纯TiO2,含有ZnO以及稀土掺杂的三条曲线其Ti-O特征振动峰变宽,说明催化剂晶体粒径变小[17],且在这一波长范围内,未出现新峰。
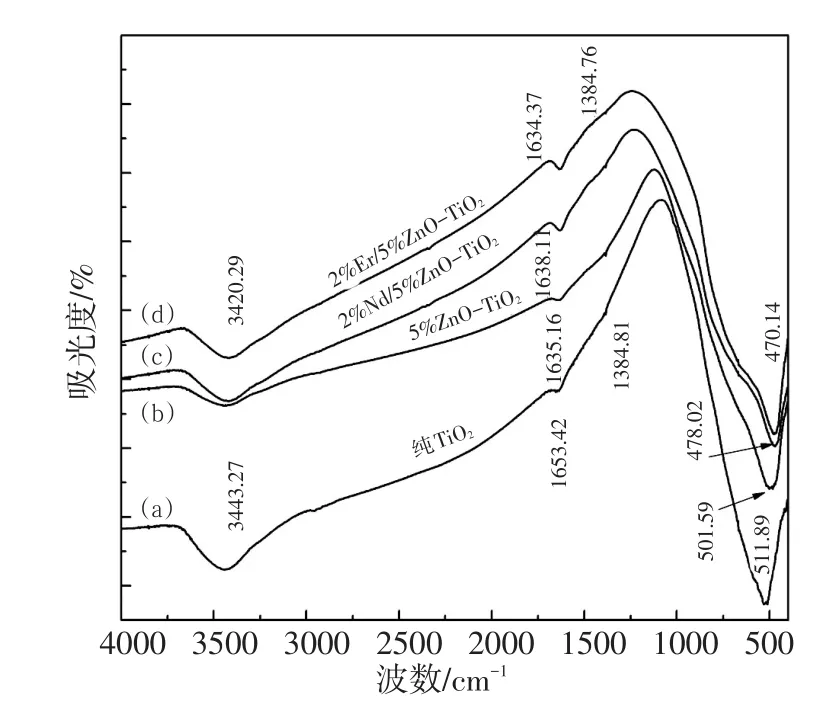
图3 不同掺杂体系光催化剂的红外图谱Fig.3 ATI-IR spectra of photocatalyst with different doping system
2.3 光催化活性研究
脱色率用公式:η=[(A0-At)/A0]×100%计算,A0为酸性品红溶液初始的吸光度,At为反应时间t后酸性品红溶液的吸光度。以蒸馏水作参比液。
2.3.1 不同掺杂体系对光催化性能的影响
不同样品在可见光下光催化降解酸性品红曲线如图4所示,图4(a)未加H2O2,图4(b)加有30%H2O2。由图4(a)可知在300 W长弧氙灯照射1 h后,纯TiO2,5%ZnO-TiO2,2%Er/5%ZnO-TiO2,2%Nd/5%ZnO-TiO2,1%Nd-1%Er/5%ZnO-TiO2对酸性品红光催化降解率分别为4.21%,36.93%,46.15%,48.67%,52.37%。稀土掺杂与ZnO复合对纯TiO2的光催化效能均有明显提高,稀土共掺杂比单掺杂光催化效能要好一些。在图4(b)中,纯TiO2,5%ZnO-TiO2,2%Er/5%ZnO-TiO2,2%Nd/5%ZnO-TiO2,1%Nd-1%Er/5%ZnO-TiO2对酸性品红光催化降解率分别为15.77%,50.38%,60.12%,64.11%,67.04%。
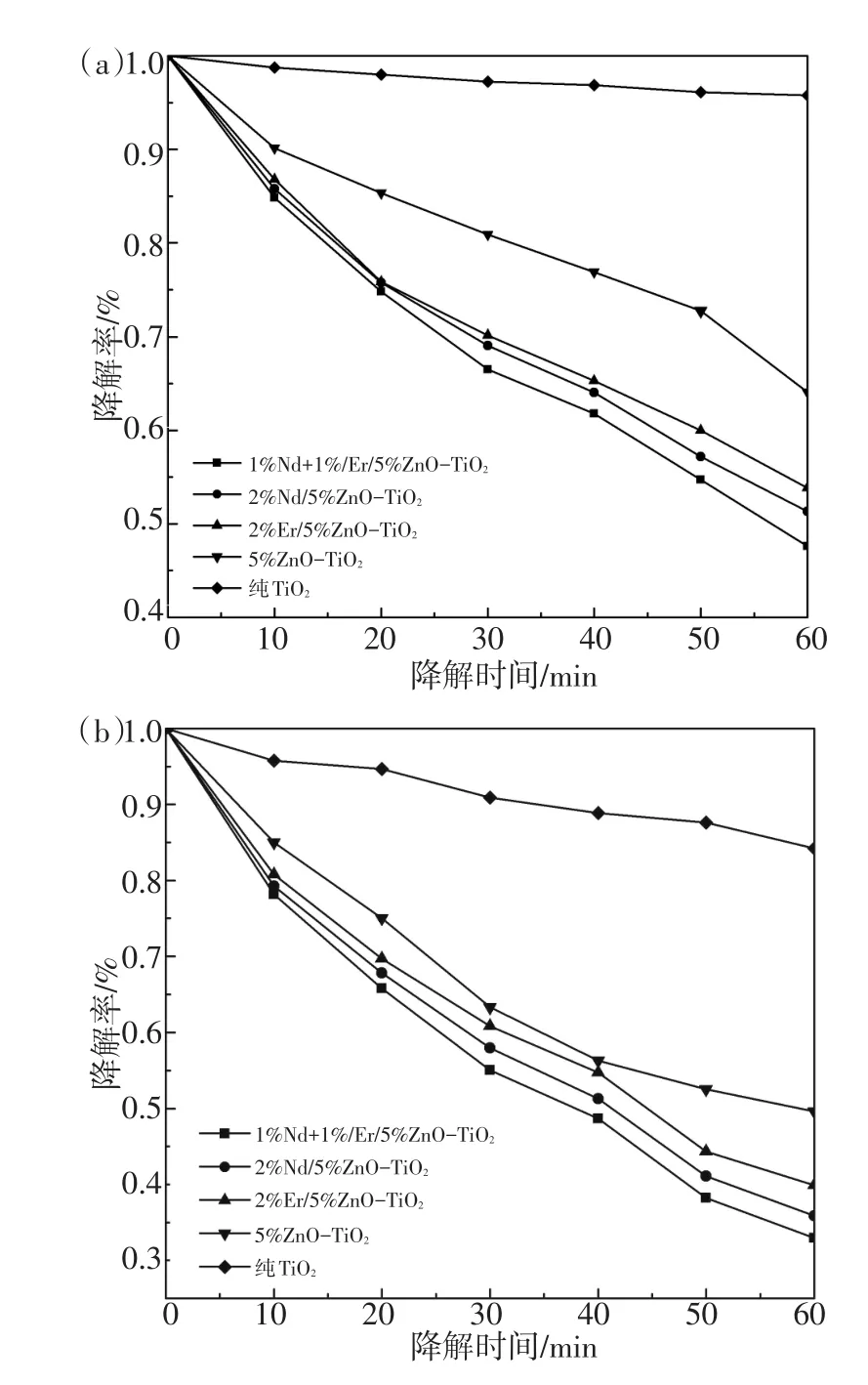
图4 550℃,不同光催化剂在可见光下光催化降解酸性品红曲线Fig.4 Degradation of acid magenta by different photocatalysts under visible light at 550℃
2.3.2 不同煅烧时间和煅烧温度对光催化性能的影响
图5为样品1%Nd-1%Er/5%ZnO-TiO2在不同煅烧时间下对酸性品红的光催化降解率。在300 W氙灯光照1 h的降解率:52.37%(2 h)> 50.11%(4 h)>44.87%(6h)>38.82%(8h)。而样品1%Nd-1%Er/5%ZnO-TiO2光催化剂在不同煅烧温度下在300 W氙灯光照1 h的降解率曲线图由图6所示:降解率分别为 33.84%(450℃),38.65%(500℃),52.37%(550℃),44.92%(600℃),35.31%(650℃)。煅烧温度对催化剂活性有较显著的影响。在450℃~650℃范围内,1%Nd-1%Er/5%ZnO-TiO2粉体的光催化活性呈先增加后降低的趋势。结合图2的XRD知450℃~550℃阶段,随着煅烧温度升高,光催化剂峰强度降低,峰宽逐步变宽;在550℃~650℃阶段,当煅烧温度继续升高,光催化剂晶化程度增强、峰强增大,峰宽变窄,光催化活性降低。
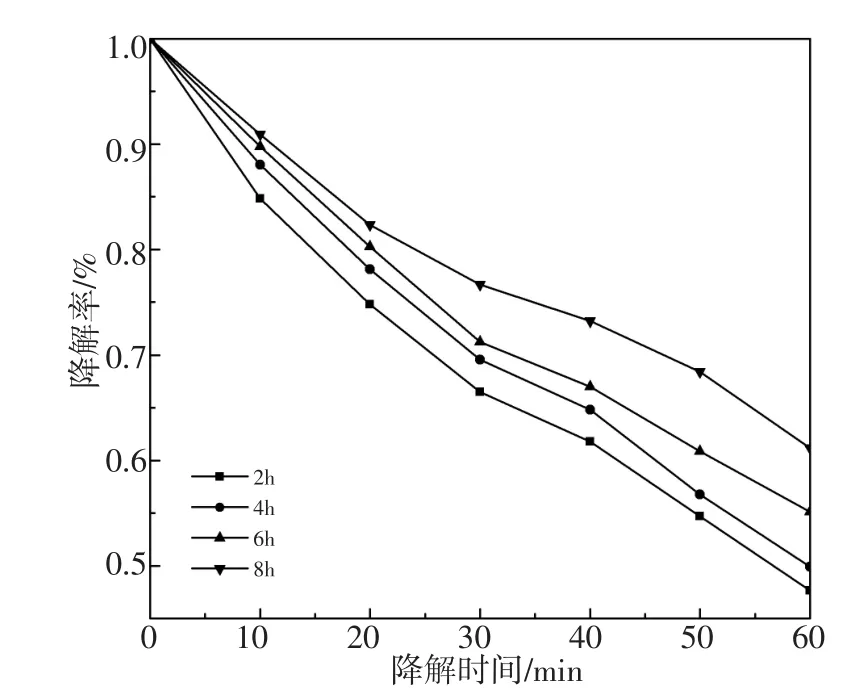
图5 1%Nd-1%Er/5%ZnO-TiO2光催化剂在不同煅烧时间下可见光光催化降解酸性品红曲线Fig.5 Degradation of acid magenta profiles by the 1%Nd-1%Er/5%ZnO-TiO2photocatalyst calcined at different time under visible light
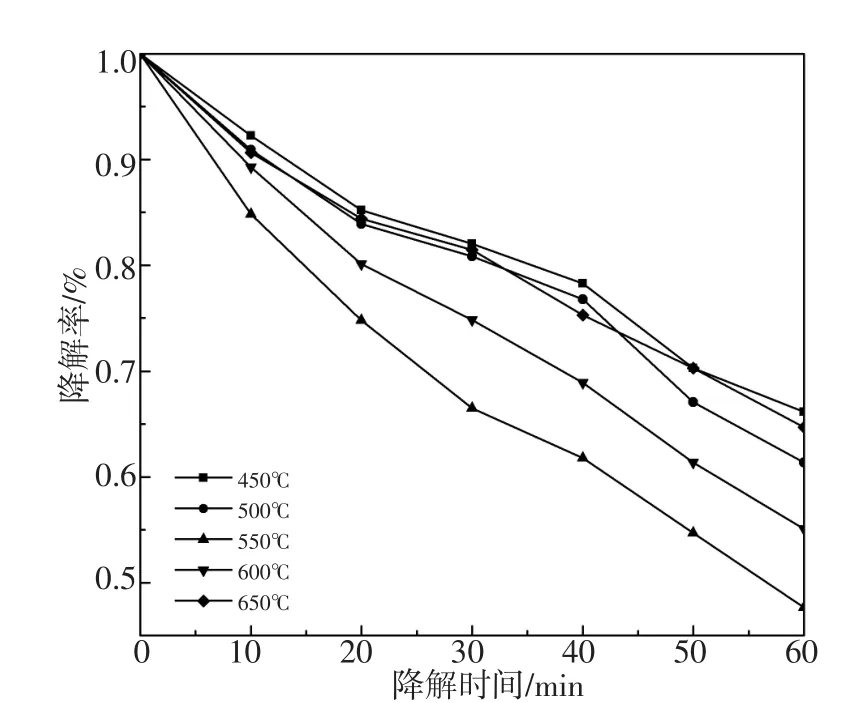
图6 1%Nd-1%Er/5%ZnO-TiO2光催化剂在不同煅烧温度下可见光光催化降解酸性品红曲线Fig.6 Degradation of acid magenta profiles by the 1%Nd-1%Er/5%ZnO-TiO2photocatalyst calcined at different temperature under visible light
2.4 助催化剂H2O2的协同作用
滴加30%H2O2与1%Nd-1%Er/5%ZnO-TiO2光催化剂为实验组,以只加入30%H2O2和只加入1%Nd-1%Er/5%ZnO-TiO2光催化剂为对照组,在300 W长弧氙灯照射1 h,进行光催化降解酸性品红实验。结果如图7所示,只加30%H2O2的,光照1 h后测得η为9.34%;只加1%Nd-1%Er/5%ZnO-TiO2光催化剂的,光照1 h后测得η为52.37%;加入30%H2O2与1%Nd-1%Er/5%ZnO-TiO2光催化剂共同作用光照1 h后测得η为67.04%。其中,光催化剂占据主要催化作用,H2O2承担助催作用。光催化降解实验表明30%H2O2与稀土共掺杂光催化剂在可见光下对酸性品红都有降解作用,且两者共同作用可使光催化效果更显著。
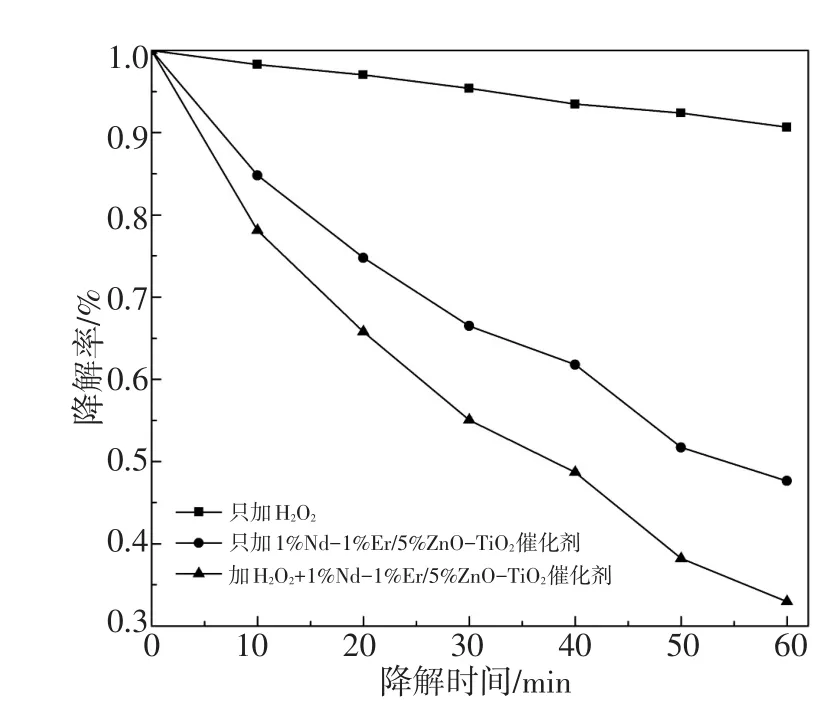
图7 H2O2与1%Nd-1%Er/5%ZnO-TiO2可见光协同光催化降解酸性品红曲线Fig.7 Synergistic photocatalytic degradation of acid magenta profiles by the H2O2and 1%Nd-1%Er/5%ZnO-TiO2under visible light
上世纪80年代末,羟基自由基(·OH)已被证实存在[18]。在光催化反应体系中,·OH发挥着重要作用。光催化剂受合适光激发后生成·OH的过程如图8所示。光催化剂在受到适当光源照射后,形成光生电子——空穴对,空穴本身具有较强氧化能力,可与粉体表面吸附的H2O生成·OH,·OH是一种活性很高的氧化物。由图8可知·OOH与水分子和氧气可生成H2O2,H2O2又可与·O2-反应生成·OH。故在反应体系中适当滴加H2O2,可有效增加·OH,使光催化反应速率更高[19-21]。
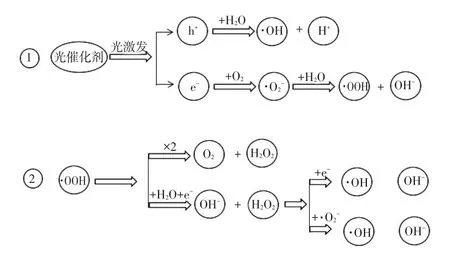
图8 光催化剂光激发生成·OH示意图Fig.8 Diagram of photo excited formation·OH of photocatalyst
3 结 论
(1)采用溶胶凝胶法制备稀土共掺杂的Nd-Er/ZnO-TiO2光催化剂,在550℃下煅烧2 h的样品1%Nd-1%Er/5%ZnO-TiO2在300 W长弧氙灯照射下具有较高光催化活性。所制得的稀土掺杂的光催化剂进行表征,结果说明经稀土共掺杂改性后的ZnO-TiO2光催化剂不仅粒径更小,比表面积也更大。
(2)经ZnO-TiO2复合与稀土掺杂后的样品其光催化活性明显高于纯TiO2,ZnO与TiO2复合产生掺杂能级,使光生空穴与光生电子扩散长度增大,寿命更长,有助于提高光催化性能。而稀土掺杂的样品光催化活性也高于只经ZnO-TiO2复合的样品,表明稀土Nd-Er的存在提高了TiO2光催化活性。
(3)H2O2为强氧化剂,·OH在光催化反应过程中发挥着重要作用。适当滴入助催剂H2O2与光催化剂协同催化,可有效增加反应体系中的羟基自由基·OH的活性,增强在可见光下对酸性品红的光催化降解。
[1]LAN X,WANG L Z,ZHANG B Y,et al.Preparation of lanthanum and boron co-doped TiO2by modified sol–gel method and study their photocatalytic activity[J].Catalysis Today,2014,224:163-170.
[2]KUBACKA A,FEMÁNDEZ-GARCÍA M,COLÓN G.Ad⁃vanced nanoarchitectures for solar photocatalytic applica⁃tions[J].Chemical Reviews,2012,112(3):1555-1614.
[3]王振阳,何洪,戴洪兴,等.稀土掺杂TiO2光催化的研究进展[J].中国稀土学报,2006,24(2):94-99.
[4]林燕,冉谷,付川.BaTiO3-TiO2异质结构光催化性能的理论研究[J].重庆三峡学院学报,2016,32(3):57-60.
[5]陈星,王小丽,付川,等.不同氮源制备的N-TiO2及其光催化活性比较[J].硅酸盐通报,2016,35(10):3178-3183.
[6]徐顺,杨鹏飞,杜宝石,等.掺杂TiO2的光催化性能研究进展[J].化学研究与应用,2003,15(2):146-150.
[7]付川,郭劲松,潘杰,等.三维电场协同TiO2光催化降解水中双酚A的研究[J].中国给水排水,2009,25(7):79-82.
[8]杨武,郭昊,张文皓,等.Pr掺杂TiO2光催化剂的制备及其对酸性品红降解反应的催化性能[J].光谱学与光谱分析,2008,28(4):922-925.
[9]刘丽静.纳米Yb3+-Er3+/TiO2的制备及其在降解染料废水中的应用[J].四川大学学报(自然科学版),2015,52(6):1337-1341.
[10]丁士文,王利勇,张绍岩,等.纳米TiO2-ZnO复合材料的合成、结构与光催化性能[J].无机化学学报,2003,19(6):631-635.
[11]刘丽静.Sm3+/TiO2光催化剂降解酸性品红实验研究[J].四川大学学报(自然科学版),2015(2):354-358.
[12]刘丽静.Eu3+/TiO2光催化剂降罗丹明B[J].信阳师范学院学报(自然科学版),2014,27(1):96-99.
[13]易志刚,熊雄.TiO2-ZnO光催化性能及其降解苯酚废水动力学研究[J].安徽农业科学,2010,38(33):18646-18647,18650.
[14]WHANG Y,ZHOU G,LI T,et al.Catalytic activity of mesoporous TiO2-xNx photocataiysts for the decomposition of methyl orange under solar simulated light[J].Catalysis Communications,2009,10(4):412-415.
[15]李川,李兆华,柳松,等.氟掺杂纳米氧化钛的制备及日光敏催化活性的研究[J].科技创新导报,2009(17):1-2.
[16]姜鸿基,李彦锋,叶正芳,等.纳米TiO2光催化剂的制备及在降解有机物方面的研究进展[J].功能材料,2002,33(4):360-362.
[17]徐文国,贾燕,沙晶,等.铜钕共掺杂纳米TiO2光催化降解偏二甲肼废水[J].北京理工大学学报,2010,30(8):988-991.
[18]ANPO M,SHIMA T,KODAMA S,et al.Photocatalytic hydrogenation of propyne with water on small-particle tita⁃nia:size quantization effects and reaction intermediates[J].TheJournalofPhysicalChemistry,1987,91(16):4305-4310.
[19]许第发,周玲玲,罗寄希,等.过氧改性纳米TiO2溶胶光催化降解苯酚的研究[J].工业水处理,2014,34(2):22-25.
[20]CARBAJO J,ADAN C,REY A,et al.Optimization of H2O2use during the photocatalyticdegradation of ethid⁃ium bromide with TiO2and iron-doped TiO2catalysts[J].Applied Catalysis B:Environmental,2011,102(1/2):85-93.
[21]鲁秀国,孟锋,徐沁,等.H2O2协同TiO2光催化处理模拟苯胺废水[J].化工环保,2012,32(6):489-492.

