miR⁃155在PM2.5染毒大鼠中的表达及意义
李男 王士娜 赵龙 毛明清 宋楠 李云霞 加慧 夏书月
沈阳医学院12015级专业硕士研究生,32016级专业硕士研究生(沈阳 110034);沈阳医学院附属中心医院2病理科,4呼吸科(沈阳 110024)
随着空气污染的日益加重,雾霾无疑已成为我国的一个棘手问题。雾霾的主要成分为大气细颗粒(airborne fine particulate matter,PM2.5),为大气总悬浮颗粒物中直径≤2.5 μm的细颗粒物,其主要来源于工业燃料燃烧释放、冬季采暖燃烧释放、交通工具气体排放、日常生活中的烹调及吸烟烟雾释放,还包括自然灾害燃烧产物的释放等[1]。细颗粒物主要成分为硫酸盐、硝酸盐、铵盐、含碳颗粒、重金属、矿物质、细菌和病毒等[2]。由于呼吸系统与外界环境直接接触,导致其是受PM2.5影响的最首要的部位。当PM2.5与肺组织细胞接触后,刺激肺巨噬细胞吞噬细颗粒物,并可释放多种细胞因子如IL⁃1β、IL-8、IL⁃6、肿瘤坏死因子(TNF)⁃α等诱发炎症导致呼吸道局部免疫力下降[3]。研究表明,急性下呼吸道感染、慢性阻塞性肺疾病、肺癌等呼吸系统疾病均与PM2.5暴露有关[4-6],并可通过呼吸而沉积在肺泡中,甚至可以通过气血屏障进入血液循环而到达其他组织器官,引起多个系统损伤[7]。microRNAs是由基因组编码的一组非编码微小RNA分子,由18~22个核苷酸组成,其通过与相应的靶mRNA的3′非翻译区(UTR)以碱基配对形式结合,调节基因的表达,参加者多种细胞生物学进程[8]。miR⁃155(microRNA⁃155)是miRNAs家族的重要成员之一,是由23个核苷酸组成的短链非编码RNA。PM2.5可导致肺部的炎性损伤,而miR⁃155在炎症应答中起重要调控作用[9]。本实验通过PM2.5染毒大鼠,检测miR⁃155的表达量,分析miR⁃155与炎性因子的相关性,进而解释miR⁃155在PM2.5染毒大鼠致炎损伤中的意义。
1 材料与方法
1.1实验动物及材料
1.1.1实验动物选用12周清洁级健康雄性SD大鼠32只[购自辽宁长生生物技术有限公司,许可证号:SCXK(辽)2015-0001],体质量200~220 g,体质量降次排序,按随机数字表法将大鼠分为PM2.5一次染毒组(P1)、PM2.5三次染毒(P3)、盐水对照染毒组(N)、空白对照组(O),每组8只。大鼠在无特定病原体(SPF)级饲养,同温(18~20℃)、同湿度(40%~60%),自由饮水,普通食料喂养4周。
1.1.2主要材料仪器及试剂Trizol试剂(美国Invitrogen公司);多样品研磨珠均质仪(Omni:Bead Ruptor 12多样品研磨珠均质仪);台式高速冷冻型微量离心机(DragonLab:D3024R);荧光定量PCR仪(ABI:Stepone plus);超净工作台(苏净安泰:SW⁃CJ⁃1FD);标准试剂型纯水仪(青岛富勒姆科技有限公司:FBZ2001⁃up⁃p);微量移液器(苏州BIOHIT公司:Proline);酶标仪(美国BIOTEK公司:ELX⁃800);电热恒温培养箱(天津泰斯特公司:DH36001B)RNA提取液(武汉赛维尔生物科技有限公司);三氯甲烷、异丙醇、无水乙醇(国药集团化学试剂有限公司);HyPureTMMolecular Biology Grade Water(HyClone:SH30538.02);RevertAid First Strand cDNA Synthesis Kit(Thermo:#K1622);Fast⁃Start Universal SYBR Green Master(Rox)(Roche:04 913 914 001);大鼠IL⁃1β ELISA试剂盒、大鼠白介素⁃6 ELISA试剂盒、大鼠TNF⁃α ELISA试剂盒(中国Boster公司)。
1.2方法
1.2.1PM2.5的采集及悬液的制备采于某市环境监测中心提供的11个监测子站和1个流动监测站组成的环境空气质量自动监测系统,对2016年11月至2017年2月的某市中心PM2.5进行采样,每次采样时间为24 h,颗粒物采集在直径9 cm的玻璃纤维滤膜上,连续采样4个月。纤维滤膜在采样前恒温干燥24 h后称重,采样结束后在相同的条件下平衡24 h后,称重,置于-20℃避光保存。将采样后的纤维滤膜用Milli⁃Q超纯水洗脱颗粒物,并于低温冷冻离心机中以12 000 r/min超速离心,收集细颗粒物悬浮液进行真空冷冻干燥,-80℃保存。实验前称取干燥的细颗粒物用生理盐水配制浓度为2 mg/mL的颗粒物混悬液,超声振荡5 min使颗粒物混匀并灭菌。
1.2.2动物模型的建立将3组染毒组大鼠(饲养4周后,老鼠体质量300~350 g)经乙醚麻醉处理后,应用气管滴注法[10]进行染毒。P1组给予每只大鼠30 mg/kg的PM2.5染毒(PM2.5悬液,浓度为2 mg/mL)。P3组分别在第1、3、6天进行麻醉染毒,每次PM2.5染毒剂量相同。N组应用同样方法,给予相同剂量的盐水染毒。O组不做任何处理。在各组最终染毒后的24 h后进行10%的水合氯醛腹腔麻醉,进行标本取材。
1.2.3标本采集
1.2.3.1动脉血将麻醉的大鼠仰卧固定于操作板上,暴露大鼠腹腔,找到腹主动脉,用20 mL注射器抽取动脉血10 mL,用低速离心机以3 000 r/min离心15 min,留取上清液于-80℃保存,用于检测TNF⁃α、IL⁃6、IL⁃1β炎性指标。
1.2.3.2肺组织取下肺叶,由肺门至肺缘作最大切面。一部分肺组织加入Trizol保存液,保存在-80℃中,用于检测miR⁃155,其余肺组织浸泡于10%中性甲醛中固定4 h,用于石蜡固定保存及常规制备5 μm石蜡切片进行HE染色观察病理改变,并进行病理评分。气管炎症的病理学评分标准[11]:选取直径为300 ~ 1 000 μm的支气管,观察以下指标:(1)上皮脱落、糜烂和溃疡形成;(2)上皮杯状细胞增生肥大;(3)黏膜上皮纤毛倒伏;(4)管壁有炎症细胞浸润,管腔有渗出;(5)管壁有淋巴小结形成;(6)支气管管腔狭窄;(7)呼吸道平滑肌增殖紊乱;(8)气管管壁结缔组织增生;(9)黏膜细胞鳞状化生;(10)管壁充血、水肿;(11)管壁色素沉积。各项指标满分为3分,各病理切片任意选取3个小气管,每项指标得分=总分×100/3。每只大鼠的病理学评分为得分和×100/33。
1.2.3.3miR⁃155的检测总RNA抽提:取100 mg组织于匀浆器充分研磨,12 000 r/min离心10 min取上清,加入250 μL三氯甲烷,充分混匀,静置3 min,4℃ 下12 000 r/min离心10 min,将上清转移至新的离心管中,加入0.8倍体积的异丙醇,颠倒混匀,-20℃放置15 min,4℃下12 000 r/min离心10 min,管底的白色沉淀即为RNA,吸除液体,加入75%乙醇1.5 mL洗涤沉淀,4℃下12 000 r/min离心5 min,将液体吸除干净,将离心管置于超净台上吹3 min,加入15 μL无RNA酶的水溶解RNA,55℃ 孵育5 min,使用Nanodrop 2000检测RNA浓度及纯度,检测吸光值,将浓度过高的RNA进行适当比例的稀释,使其终浓度为200 ng/μL。PCR反转录条件:65℃、5 min,42℃、60 min,80℃、5 min,PCR扩增条件:预变性95℃、10 min,循环(40次)95℃、15 s→60℃、60 s,溶解曲线75℃→95℃,每20秒升温1℃,处理方法:ΔΔCT法:A=CT(目的基因,待测样本)-CT(内标基因,待测样本),B=CT(目的基因,对照样本)-CT(内标基因,对照样本),K=A-B,表达倍数=2-K。表1为逆转录荧光定量PCR序列[12]。
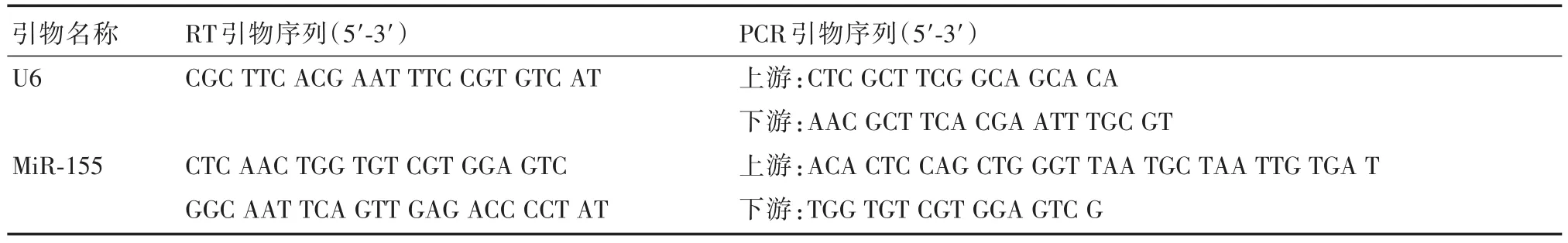
表1 引物信息表Tab.1 Primers list
1.2.3.4TNF⁃α、IL⁃6、IL⁃1β的检测采用双抗体夹心ELISA法检测各组大鼠血清中的TNF⁃α、IL⁃6、IL⁃1β,完全按照试剂盒说明说进行操作。
1.3统计学方法采用SPSS 22.0软件对数据进行统计学分析,计量资料采用表示,多组间比较采用单因素方差分析(ANOVA)进行显著性检验,Pearson相关分析评估血清miR⁃155的表达分别与TNF⁃α、IL⁃6、IL⁃1β之间的关系,以P< 0.05为差异有统计学意义。
2 结果
2.1一般情况空白对照组大鼠活泼好动,皮毛光亮,体形肥胖,强壮,呼吸平稳。盐水对照组染毒后略有少许喷嚏,数小时后症状消失。染毒组染毒后出现咳嗽、喷嚏,活动量减少,食量减少,不活泼等症状。三次染毒组大鼠除了活动减少及食量减少,又出现拱背蜷卧,且咳嗽、喷嚏更加频繁,呼吸加深且急促等症状,且染毒组咳嗽及喷嚏数小时不见缓解。
2.2各组大鼠血清中TNF⁃α、IL⁃6、IL⁃1β的表达结果3组干预组中炎性指标TNF⁃α、IL⁃6、IL⁃1β的表达较O组均有显著增加,P3组炎性因子表达高于P1组和N组,P1组炎性因子表达较N组增加,且4组炎性指标比较,差异具有统计学意义(均P<0.01)。见表2。
表2 各组大鼠血清TNF⁃α、IL⁃6、IL⁃1β表达水平的变化Tab.2 Changes of serum TNF⁃α、IL⁃6、IL⁃1β expression levels in rats ±s,pg/mL
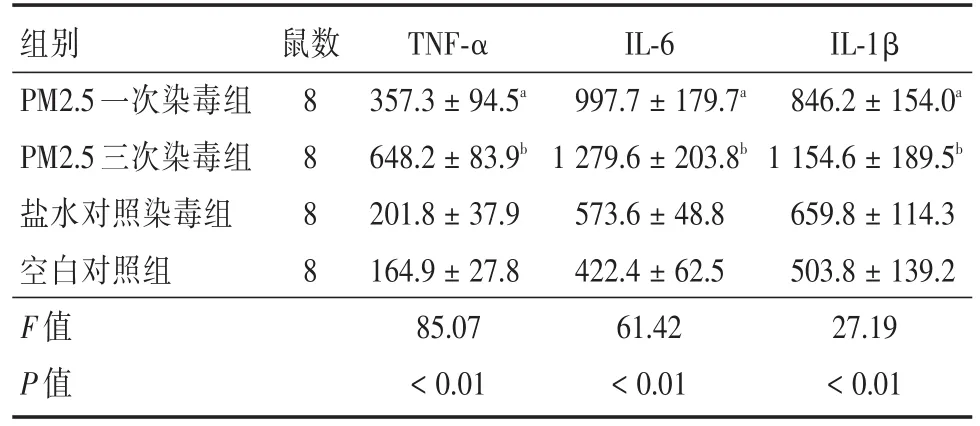
表2 各组大鼠血清TNF⁃α、IL⁃6、IL⁃1β表达水平的变化Tab.2 Changes of serum TNF⁃α、IL⁃6、IL⁃1β expression levels in rats ±s,pg/mL
注:与对照组相比,aP<0.01,bP<0.01
组别PM2.5一次染毒组PM2.5三次染毒组盐水对照染毒组空白对照组F值P值鼠数8 8 8 8 TNF⁃α 357.3±94.5a 648.2±83.9b 201.8±37.9 164.9±27.8 85.07<0.01 IL⁃6 997.7±179.7a 1 279.6±203.8b 573.6±48.8 422.4±62.5 61.42<0.01 IL⁃1β 846.2±154.0a 1 154.6±189.5b 659.8±114.3 503.8±139.2 27.19<0.01
2.3各组大鼠肺组织HE染色病理结果见图1,O组大鼠肺泡大小均匀,气管可见柱状上皮细胞,肺泡结构完整,细胞排列较整齐,肺间质及肺泡腔无明显炎性细胞浸润、出血;P1组、P3组、N组均见肺间质水肿、毛细血管扩张充血、大量肺泡腔内可见炎性细胞浸润,P3组肺泡壁破坏程度、肺泡间充血量以及炎性细胞浸润量最严重,P1组较P3组病理改变程度轻,较N组病理改变程度重。各组肺组织气管炎症的病理学评分比较见表3。
2.4各组大鼠肺组织miR⁃155的表达结果O组中miR⁃155表达量(0.22±0.06)最低,P3组miR⁃155表达量(2.36±1.18)最大,P1组表达(01.77±0.33)和N组表达(0.36±0.15)较其表达少,且各组进行相关分析具有显著差异(F=20.19,P<0.01)。

图1 各组SD大鼠肺组织病理光镜观察Fig.1 Pathological light microscopic observation of SD rats′lung tissue in each group
表3 各组大鼠气管炎症病理学评分Tab.3 Pathological scores of trachea of rats in each group±s
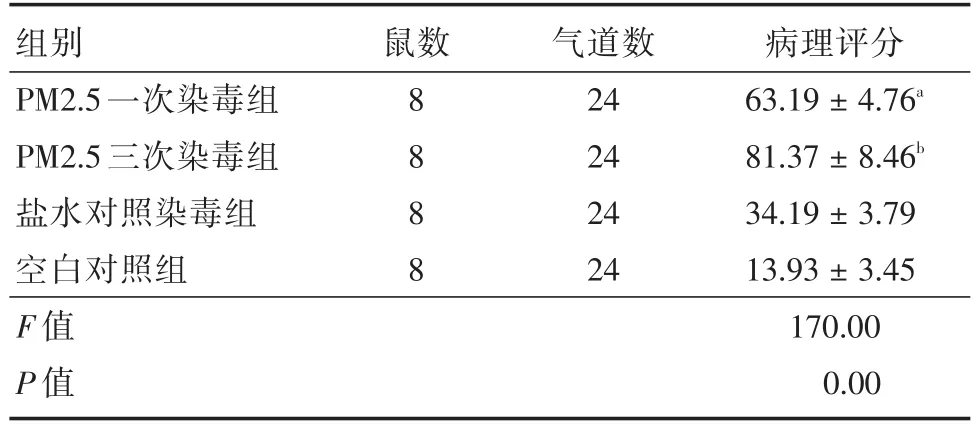
表3 各组大鼠气管炎症病理学评分Tab.3 Pathological scores of trachea of rats in each group±s
注:与对照组相比,aP<0.01,bP<0.01
组别PM2.5一次染毒组PM2.5三次染毒组盐水对照染毒组空白对照组F值P值鼠数8888气道数24 24 24 24病理评分63.19±4.76a 81.37±8.46b 34.19±3.79 13.93±3.45 170.00 0.00
2.5miR⁃155与TNF⁃α、IL⁃6、IL⁃1β表达水平的相关分析Pearson相关分析结果显示,肺组织miR⁃155与血清中TNF⁃α、IL⁃6、IL⁃1β的表达水平呈正相关(r=0.768,0.752,0.729;P< 0.01),见图3。
3 讨论
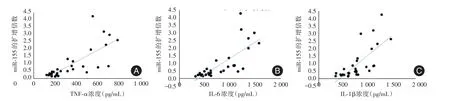
图3 miR⁃155与TNF⁃α、IL⁃6、IL⁃1β的相关分析图Fig.3 Correlation analysis of miR⁃155 and TNF⁃α,IL⁃6,IL⁃1β
PM2.5具有粒径小,表面积大,且可吸附多种有毒有害物质的特点,可以深入沉积在呼吸道细支气管和肺泡内,其中细小的成分甚至可以穿过肺间质,进入血液循环,对机体全身造成有害影响[13]。miRNAs(microRNAs)是一类高度保守的短链非编码RNA,调控基因表达,参与细胞生长、分化、代谢、凋亡等多个生物学过程[14]。miR⁃155是miRNAs的主要成员之一,被认为是一种典型的能针对不同基因起作用调控多种生物途径的微小RNA,可通过调节靶向miRNA以及介导多种细胞因子的表达来参与如肺癌、哮喘、肺炎、肺结核及急性肺损伤等肺部疾病的形成。在ZHENG等[15]动物试验中显示miR⁃155可有效地增加促炎反应分子TNF⁃α、IL⁃6和NO的释放。RODRIGUEZ等[16]研究发现miR⁃155在小鼠肺部炎中的作用,并证实了miR⁃155在调节与T细胞功能相关的基因表达和炎症反应方面的重要作用。WANG等[17]在以鼠为实验动物的LPS(脂多糖)所致肺损伤的模型中得出,miR⁃155可以通过抑制其下游的靶标⁃沉默细胞因子信号转导抑制因子1(suppressor of cyto⁃kine signaling,SOCS⁃1)表达而导致肺损伤的形成。
本实验采用气管滴注法对SD大鼠进行PM2.5染毒制作动物模型。通过SD大鼠肺组织HE染色病理切片结果显示,PM2.5对肺部组织具有炎性损伤作用,并随着染毒次数及剂量的增加,其破坏程度逐渐加重。通常情况下,血清中的炎性因子处于低表达状态,当发生炎性反应时,其表达可显著增加。本实验通过检测SD大鼠血清中TNF⁃α、IL⁃6、IL⁃1β炎性指标可发现,血清中TNF⁃α、IL⁃6、IL⁃1β随着PM2.5的染毒增加而表达增强,提示PM2.5所致炎性反应随染毒次数及剂量增加而增强。由此可见,PM2.5对肺部的炎性损伤作用随着PM2.5接触的增加而增强。
通过检测各组大鼠肺组织中miR⁃155的表达,发现P3组miR⁃155表达量最大,P1组表达较其次之,N组和O组表达较少,且各组进行相关分析具有显著差异。对miR⁃155与TNF⁃α、IL⁃6、IL⁃1β的表达进行Pearson相关分析,结果示miR⁃155与TNF⁃α、IL⁃6、IL⁃1β存在正向相关(P< 0.01)。
本研究证实了PM2.5对肺部的炎性损伤作用,且随着PM2.5接触量的增加,损伤作用逐渐增强。同时通过检测miR⁃155的表达量及相关性分析可发现,miR⁃155的表达增加与PM2.5所致的肺部炎性反应相关,因此,miR⁃155可能参与PM2.5致肺的炎性反应中,为PM2.5致肺损伤的研究提供一个新的思路,但由于其具体通路及机制尚不清晰,有待于进一步研究。
[1]WICHMANN H E,SPIX C,TUCH T,et al.Daily mortality and ultrafine particles in Erfurt[M].Germany:Health Effects Institute Report,2000:98⁃101.
[2]KIM S Y,PEEL J L,HANNIGAN M P,et al.The temporal lag structure of short⁃term associations of fine particulate matter chemical constituents and cardiovascular and respiratory hospi⁃talizations[J].Environ Health Perspect,2012,120(8):1094⁃1099.
[3]JENSEN A,KAROTTLI D G,CHRISTENSEN J M,et al.Bio⁃markers of oxidative stress and inflammation after wood smoke exposure in a reconstructed viking Age house[J].Environ Mol Mutagen,2014,55(8):652⁃661.
[4]ANALITIS A,KATSOUVANNI K,DIMAKOPOULOU K,et al.Short⁃term effects of ambient particles on cardiovascular and respiratory mortality[J].Epidemiology,2006,17(2):230⁃233.
[5]ZANOBETTI A,FRANKLIN M,KOUTRAKIS P,et al.Fine particulate air pollution and its components in association with cause ⁃specific emergency admissions[J].Environ Health,2009,8:58.
[6]DOMINCI F,PENG R D,BELL M L,et al,Fine particulate air pollution and hospital admission for cardiovascular and respi⁃ratory diseases[J].JAMA,2006,295(10):1127⁃1134.
[7]World Health Organization(WHO ).Health effects of particu⁃late matter.Policy implications for countries in eastern Europe,Caucasus and central Asia[S].Copenhagen:WHO Regional Of⁃fice for Europe:2013.
[8]BARTEL D P.MicroRNAs:genomics,biogenesis,mecha⁃nism,and function[J].Cell,2004,116(2):281⁃297.
[9]TILI E,MICHAILLE J J,CIMINO A,et al.Modulation of miR⁃155 andmiR⁃125b levels following lipopolysaceharide/TNF⁃α stimulation and their possible roles in regulating the response to endotoxin shock[J].J Immunol,2007,179(8):5082⁃5089.
[10]李男,加慧,李云霞,等.使用耳镜改良的大鼠气管滴注法[J].医药卫生,2016,40:83⁃84.
[11]VERNOOY H J,DENTENER M A,ROBERT J,et al.Long⁃term intratracheal lipopolysaccharide exposure in mice results in chronic lung inflammation and persistent pathology[J].Am J Respir Cell Mol Biol,2002,26:152⁃159.
[12]杨勇,周勇,曹政,等.miR⁃155下调心肌细胞ATRlα表达改善心肌细胞肥大[J].重庆医学,2015,44(21):2890⁃2894.
[13]SUM M,KAUFMAN J D,KIM S Y,et al.Particulate matter components and subclinical atherosclerosis:Common approach⁃es to estimating exposure in a Multi⁃Ethnic Study of Atheroscle⁃rosis cross⁃sectional study[J].Environ Health,2013,12:39.
[14]李男,李云霞,夏书月,等.miR⁃155与肺部疾病的研究进展[J].国际呼吸杂志,2017,37(8):619⁃624.
[15]ZHENG Y,XIONG S,JIANG P,et al.Glucocorticoids inhibit lipopolysaccharide⁃mediated inflammatory response by downreg⁃ulating micmRNA⁃155:a novel anti⁃inflammation mechanism[J].Free Radic Bio1 Med,2012,52(8):1307⁃1317.
[16]RODRIGUEZ A,VIGORITO E,CLARE S,et al.Require⁃ment of hic/microRNA⁃155 for noriilal immune function[J].Sci⁃ence,2007,316(5824):608⁃611.
[17]WANG W,LIU Z,SU J,et al.Macrophage micro⁃RNA⁃155 promotes lipopolysaccharide⁃induced acute lung injury in mice and rats[J].Am J Physiol Lung Cell Mol Physiol,2016,311(2):494⁃504.

