鼻黏膜间充质干细胞的培养、鉴定及诱导分化
卓毅,吴沛,段答,葛丽特,王昊,龙浪,胡莉,卢明*
(1湖南师范大学第二附属医院,解放军第163医院神经外科,长沙410003;2湖南师范大学生命科学学院,蛋白质化学与发育生物学教育部重点实验室,长沙410006)
随着对干细胞研究的不断深入,神经损伤的修复与再生已成为可能。间充质干细胞(mesenchymal stem cells,MSCs)不仅具有多向分化的潜能,还具有自我复制、造血支持以及免疫调节等功能[1,2]。目前研究比较广泛的MSCs主要有骨髓间充质干细胞(bone marrow MSCs, BM-MSCs),脂肪间充质干细胞(adipose tissue-derived MSCs, AD-MSCs)及脐带间充质干细胞(umbilical cord MSCs, UC-MSCs)3种,但是这些细胞仍有伦理、免疫排斥等问题以及细胞来源不足等局限。
2010年有研究者在人鼻黏膜的嗅区中发现了嗅黏膜间充质干细胞(olfactory mucosa mesenchymal stem cells,OM-MSCs),因其属于外胚层,也被称为也称为外胚间充质干细胞[3](ectomesenchymal stem cells,OE-MSC)。又因其解剖位置属于固有层,所以也称为固有层间充质干细胞[4](lamina propria mesenchymal stem cell,LP-MSCs)。OM-MSCs 易于获取培养,广泛分布于鼻内[5],不受年龄限制[6],且具有多向分化的潜能;又因其安全性高,且无免疫排斥反应,可用于自体移植治疗中枢神经系统损伤的修复[7]。本研究则从SD大鼠鼻内直接获取鼻黏膜组织块,在体外进行培养、扩增鼻黏膜间充质干细胞(nasal mucosa mesenchymal stem cells,NMMSCs),并研究其细胞形态、免疫表型、生物学特性及细胞周期等特性,旨在建立SD大鼠的NMMSCs培养体系,初步探讨其生物学特性,为接下来治疗中枢神经系统损伤修复的动物实验研究提供更为优越的种子细胞来源奠定基础。
材料与方法
1 实验材料与仪器
高糖 DMEM-F12 培养基 (1 ∶ 1)(GIBCO 公司,美国);10% FBS(HyClone 公司,澳大利亚);双抗(青霉素20 000 U/mL、链霉素 20000 ng/mL);胰蛋白酶消化液;一抗CD19、CD31、CD34、CD45、HLA-DR、CD90、CD105(Sigma 公司,美国);油红O、茜草红(GIBCO 公司,美国);湿化CO2培养箱;流式细胞仪;倒置显微镜、免疫荧光显微镜(Olympus 公司,日本)。
2 NM-MSCs的取材和原代培养
成年 SD 大鼠,质量 250~300g(中南大学实验动物研究中心),经 16%的水合氯醛(350mg/kg)腹腔注射麻醉,消毒整个头部毛发,并将毛发尽量剪除,再用络合碘消毒皮肤,再将大鼠断颈处死后将整个头部离断,然后在无菌条件下经双侧鼻孔沿鼻腔向上至内眦部剪开皮肤及鼻骨,显露上、中、下鼻甲,用眼科剪剪下上、中、下鼻甲内鼻黏膜置于 PBS 中,然后在光学显微镜下仔细分离全层鼻黏膜。鼻黏膜取出后用双抗(青霉素200U/ml和链霉素200U/ml)漂洗3次去除血迹,再置于含10% FBS的DF-12培养基(含双抗),用眼科剪充分剪碎,剪成0.5mm3组织块,置于离心管中离心弃掉上清,最后将组织块接种于用多聚赖氨酸(PLL)包被的培养瓶中,置于湿化培养箱内(37℃,5% CO2) 进行培养。待细胞从组织块爬出来后进行半量换液,以后每2~3d换液1次,当细胞爬出较多时开始进行传代。每天于倒置显微镜下观察细胞生长情况、细胞形态并照相。
3 免疫荧光染色
对培养至第4代的NM-MSCs进行免疫荧光染色鉴定。步骤如下:取出6孔板内铺满细胞的载玻片,先用PBS溶液清洗细胞载玻片3次,每次时间为5min;再将细胞进行固定:固定液位4%多聚甲醛溶液15min即可;固定时间结束后首先冲洗掉固定液,兔抗Nestin (1:1000)、兔抗STRO-1(1:1000)放置于4℃的冰箱内孵育过夜;次日从冰箱内取出孵育好的载玻片,先用PBS平衡盐溶液清洗一抗3次,每次5min即可;清洗完毕后再加入二抗(稀释倍数为200倍),避光常温下孵育1h,最后用PBS平衡盐溶液洗掉二抗,每遍5min,洗3次;洗净后最后便加入DAPI染细胞核,孵育时间为15min;最后用甲醇再清洗1次(因DAPI可以溶于甲醇),接着用抗荧光猝灭剂进行最后的封片,置于荧光显微镜下观察实验结果并拍照记录。
4 NM-MSCs的细胞流式鉴定
取第4代NM-MSCs,PBS洗涤3次,0.25%胰蛋白酶37℃消化后,用含血清培养基终止消化,分为每管0.1ml。阴性对照管加鼠抗IgG-FITC、鼠抗IgG-PE抗体、鼠抗IgG-APC抗体;其他管分别加入兔抗鼠抗体CD19-FITC,CD31-APC,CD34-FITC,CD45-FITC,HLA-DR-PE,CD90-PE,CD105-PE,室温孵育30min,流式细胞仪进行检测。
5 NM-MSCs体外定向诱导分化
选择第4代NM-MSCs,按2.0×106/ml接种于用多PLL包被的无菌盖玻片的6孔板内,待细胞贴壁生长至细胞密度达80%时,于各孔内分别加入下列诱导剂:成脂细胞诱导剂油红O (StemPro,Invitrogen,UK)和成骨细胞诱导剂茜素红(StemPro,Invitrogen,UK)。每2~ 3d换液1次,各组细胞诱导2周后,经4%多聚甲醛固定15min,对诱导分化的脂肪细胞进行油红O染,对诱导分化的成骨细胞进行茜素红染色。
6 NM-MSCs细胞周期检测
取第4代NM-MSCs,用胰蛋白酶消化5min,离心得细胞沉淀,PBS洗2~3次,制成单细胞悬液。加入1ml预冷PBS重悬细胞,800r/min离心5min,吸净上清,加入400µl PBS,轻轻重悬细胞,使细胞分离为单个,逐滴加入预冷的100% 乙醇1.2 ml,使其终浓度为 75%,4℃放置过夜固定。取出固定的样品,800r/min离心5min,弃上清。加入1ml预冷的PBS重悬细胞,800r/min离心5min,离心收集细胞。重复1~2次,去除乙醇加入150μl(碘化丙啶)PI工作液,4℃避光染色30min。转至流式检测管,上机检测,排除粘连细胞和碎片后分析PI荧光直方图上各细胞周期的百分率。
结 果
1 NM-MSCs的形态特征
NM-MSCs广泛分布于鼻腔中,上、中、下鼻甲均有分布,组织块取自上、中、下鼻甲的鼻黏膜(图1 A),然后在光学显微镜下仔细分离全层鼻黏膜(图1 B)。采用组织贴壁法培养NM-MSCs,组织块多于1d内即可贴壁,3d后可见大部分组织块开始有细胞爬出,此时以杂质细胞居多;随着时间延长,从组织块爬出的细胞面积越来越大,至第8d即可进行细胞传代(图2 A-E)。传代后的细胞生长速度明显加快,约2~3d可传代1次,传代至第4代时细胞多呈梭形与多角形态,整体细胞形态以平行排列生长为主,且呈漩涡状生长(图2 F)。

图 1 SD大鼠鼻黏膜组织块获取。A,鼻腔内上、中、下鼻甲内鼻黏膜;B,光学显微镜下仔细分离全层鼻黏膜Fig. 1 Collection of nasal mucosa from SD rats. A, nasal mucosa of the upper, middle and lower turbinate of SD rat nasal cavity; B, separation of complete nasal mucosa under light microscope.
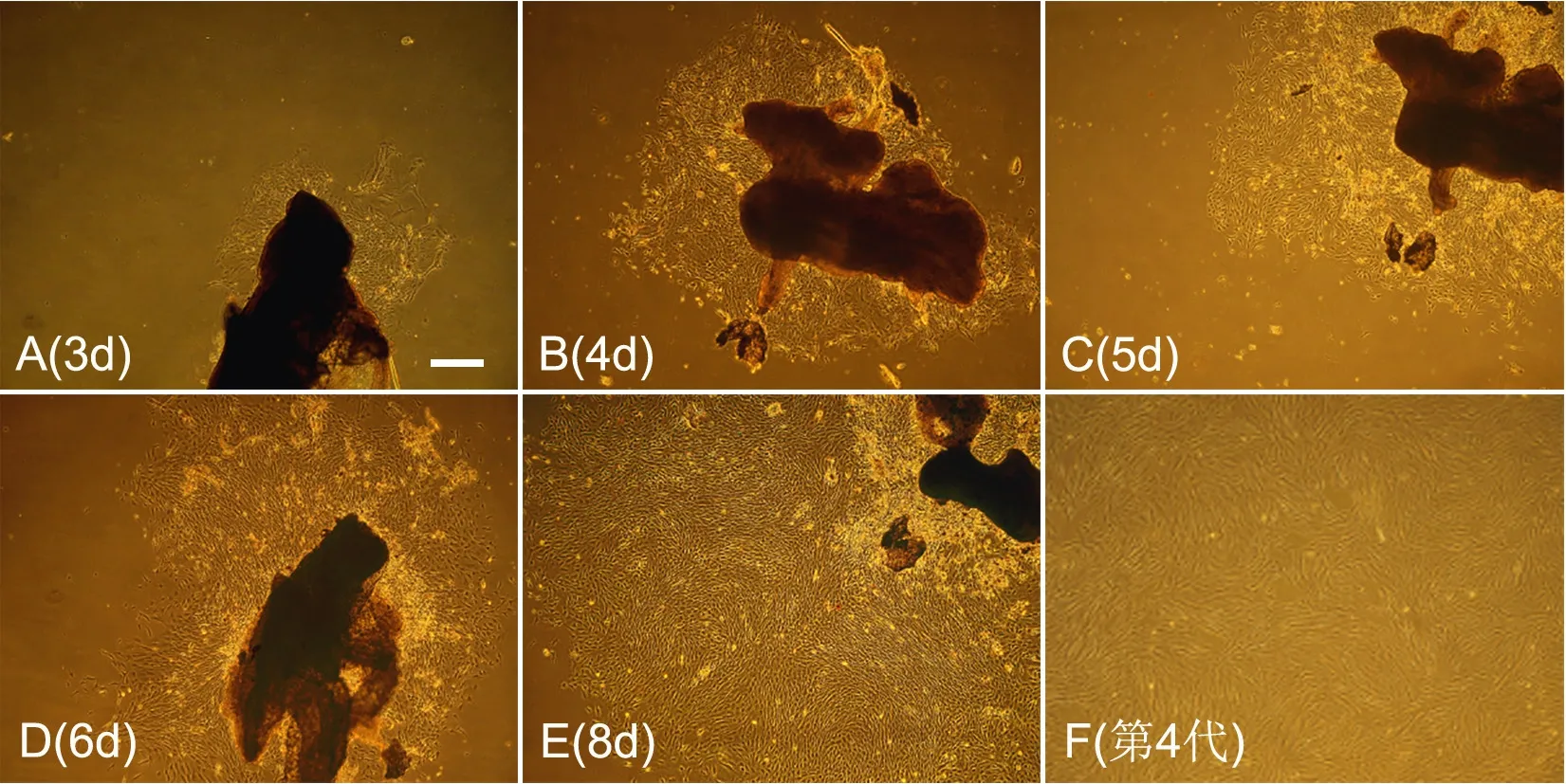
图 2 培养不同时间的NM-MSCs光学显微镜下的形态特征。比例尺,100μmFig. 2 Morphological features of NM-MSCs in culture at different time. Scale bar, 100μm
2 NM-MSCs标志物
对培养至第4代的NM-MSCs进行免疫荧光染色鉴定显示,NM-MSCs不仅表达间充质干细胞标记物STRO-1(图3 A),还可以同时表达神经干细胞标记物nestin(图3 B)。流式细胞术分析显示:NM-MSCs不表达CD19、CD31、CD34、CD45及HLA-DR细胞表面标记物,但表达CD90、CD105等基质细胞标记物(图4)。
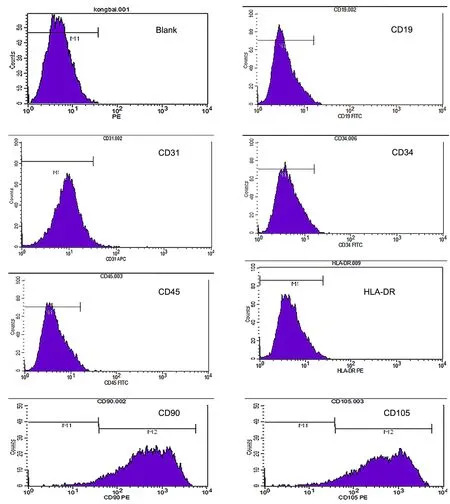
图 4 第四代NM-MSCs表面标志物表达的流式细胞术检测Fig. 4 Flow cytometry detection of surface marker expression in osteogenic or adipogenic induced NM-MSCs at passage 4

图 3 第四代NM-MSCs标志物的免疫荧光染色鉴定。A,STRO-1染色;B,nestin染色;比例尺,100μmFig. 3 Identi fi cation of NM-MSCs markers by immuno fl uorescence staining. A, STRO-1; B, nestin; scale bar, 100μm
3 第4代NM-MSCs体外成骨成脂诱导分化
第4代的NM-MSCs经成骨诱导剂诱导3周后,细胞表面可见茜素红染色阳性的钙结节沉积,说明NM-MSCs在体外具有向成骨细胞分化的潜能(图5A);第4代的NM-MSCs经成脂诱导剂诱导3周后,经油红O染色,可见油红O染色阳性的脂滴形成,说明NM-MSCs在体外有向脂肪组织分化的潜能 (图 5B) 。
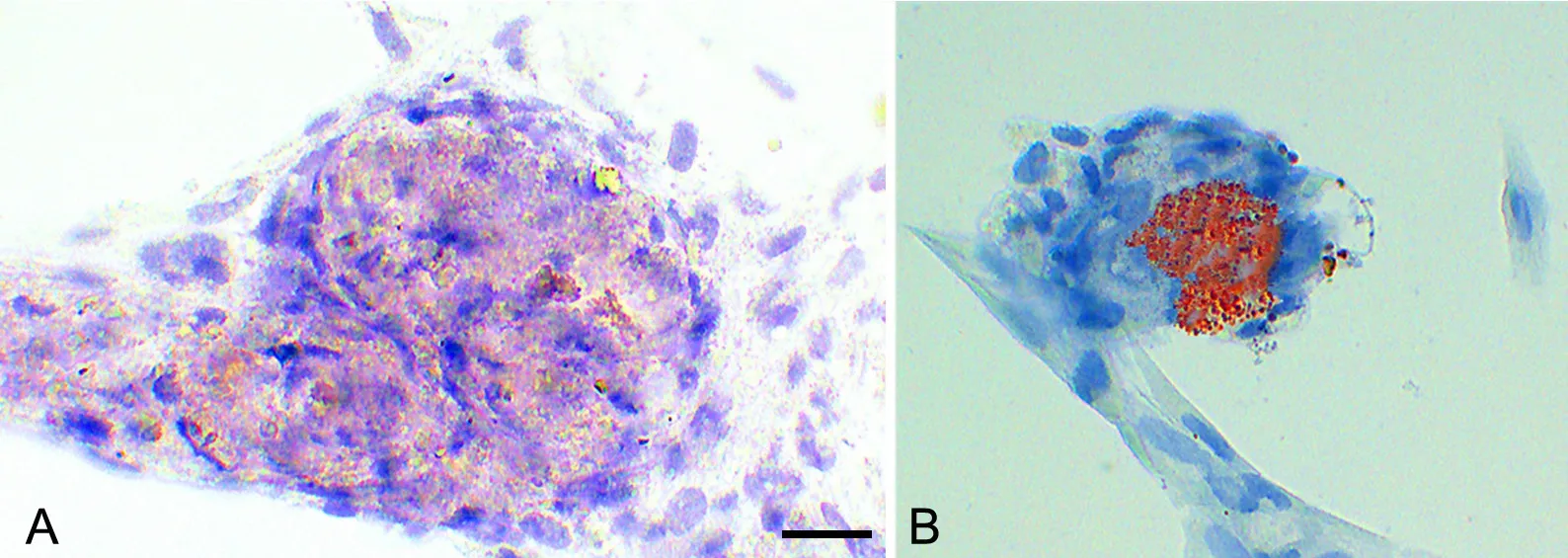
图5 第4代NM-MSCs成骨(A)成脂(B)诱导分化后茜素红(A)及油红O (B) 染色。A,茜素红染色后细胞间矿化结节呈现红色;B,油红O染色可见细胞间有红色颗粒形成;比例尺,100μmFig. 5 Oil red O and Alizarin red staining for NM-MSCs at 3 weeks after induction. A, the mineralized nodules of the cells were alizarin red staining positive; B, positive oil red O staining indicates the formation of lipid particles between cells; scale bar, 100μm
4 第4代NM-MSCs的细胞周期
对第4代SD大鼠NM-MSCs的细胞周期进行流式细胞术检测显示, 57.96%处于G1期,G2期占28.26%,而S期仅占13.78%。结果提示NM-MSCs处于静止状态下的细胞占了大部分,小部分处于复制期,仍保留了细胞的更新、增殖能力,符合干细胞的生长特性(图6)。

图6 第4代NM-MSCs的细胞周期分析Fig. 6 Cell cycle analysis of NM-MSCs at the 4th passage
讨 论
间充质干细胞(MSCs)是一种在机体分布极为广泛的成体干细胞,具有迅速增殖及多向分化的潜能[8,9]。它既可以分化为脂肪组织、骨组织等中胚层的组织细胞,也被证实能够向神经元、神经胶质细胞等外胚层的细胞分化[10]。NM-MSCs在鼻腔内分布比较广泛,于鼻中隔、上、中、下鼻甲的黏膜内均有分布[11]。而中胚层来源的骨髓间充质干细胞等虽具有向各类中胚层组织结构分化的趋势,但它们在体外培养过程中向外胚层的神经细胞分化的能力较弱,因为此过程需要跨胚层来完成[12]。而NM-MSCs存在于鼻黏膜的固有层内,来源于外胚层,其不仅可分化为中胚层来源的组织,还可以无需跨胚层分化为神经元和神经胶质细胞[13,14]。目前,寻找更好来源的种子细胞仍是神经损伤修复与组织细胞工程研究领域的一个热点,也是今后大量动物实验研究的基础及突破口。
本实验便将鼻黏膜通过组织块贴壁法进行体外培养、纯化及扩增NM-MSCs。用含10%胎牛血清的DMEM/F-12培养基进行的鼻黏膜组织块贴壁法培养NM-MSCs,经换液、传代去除杂细胞,传至第4代时便可获得较高纯度的NM-MSCs,且此时细胞形态绝大部分为梭形,少部分成多角形状,整体细胞贴壁呈现出旋涡状或平行排列生长。我们为了证实NM-MSCs与其他来源的MSCs不同之处,对其进行了MSCs标记物STRO-1和神经干细胞标记物nestin的免疫荧光染色检测,结果显示两者均显著表达。再用流式细胞仪检测发现细胞不表达CD19、CD31、CD34、CD45及HLA-DR细胞表面标记物,而表达CD90、CD105等基质细胞标记物,符合MSCs的细胞流式检测的特性。为了进一步验证NM-MSCs的多向分化的潜能,我们分别对其进行诱导向成骨细胞及脂肪组织定向分化,结果显示:在成骨诱导剂诱导后,NM-MSCs在细胞表面可见茜素红染色阳性的钙结节沉积;用脂肪诱导剂诱导后,也可见油红O染色阳性的脂滴形成。上述结果表明通过组织块贴壁法培养出来的NM-MSCs具有MSCs的一般细胞形态、细胞表型和多向分化的潜能。第4代SD大鼠NM-MSCs的细胞周期检测结果显示:57.96%处于G1期,G2期占28.26%,而S期仅占13.78%,提示NM-MSCs处于静止状态下的细胞占了大部分,小部分处于复制期,但仍保留了细胞的更新、增殖能力,符合干细胞的生长特性。
本实验通过对鼻黏膜进行组织块贴壁法建立了一种能有效地富集纯度很高的NM-MSCs培养体系,并通过细胞免疫荧光及流式细胞术检测所培养的细胞表达间充质干细胞的特异性表面抗原,且不表达造血干细胞特异性抗原,再将其诱导分化成了成骨细胞及脂肪组织,最后对其进行了细胞周期检测与分析。证实了该培养体系培养的细胞为纯度高、扩增能力强且数量充足的NM-MSCs,为接下来我们大量的动物实验研究及组织细胞工程提供了更为优越的种子细胞来源。
[1] Fayyad-Kazan H, Faour WH, Badran B, et al. The immunomodulatory properties of human bone marrow-derived mesenchymal stromal cells are de fi ned according to multiple immunobiological criteria. In fl amm Res, 2016, 65(6): 501-510.
[2] Ge L, Jiang M, Duan D, et al. Secretome of Olfactory Mucosa Mesenchymal Stem Cell, a Multiple Potential Stem Cell.Stem Cells Int, 2016, 2016: 1243659.
[3] Delorme B, Nivet E, Gaillard J, et al. The human nose harbors a niche of olfactory ectomesenchymal stem cells displaying neurogenic and osteogenic properties. Stem Cells Dev, 2010, 19(6): 853-866.
[4] Lindsay SL, Johnstone SA, Mountford JC, et al. Human mesenchymal stem cells isolated from olfactory biopsies but not bone enhance CNS myelination in vitro. Glia, 2013,61(3): 368-382.
[5] Hwang SH, Park SH, Choi J, et al. Characteristics of mesenchymal stem cells originating from the bilateral inferior turbinate in humans with nasal septal deviation. PLoS One,2014, 9(6): e100219.
[6] Hwang SH, Park SH, Choi J, et al. Age-related characteristics of multipotent human nasal inferior turbinate-derived mesenchymal stem cells. PLoS One, 2013, 8(9): e74330.
[7] Feron F, Perry C, Girard SD, et al. Isolation of adult stem cells from the human olfactory mucosa.MethodsMol Biol,2013, 1059: 107-114.
[8] Tanna T, Sachan V. Mesenchymal stem cells: potential in treatment of neurodegenerative diseases. Curr Stem Cell Res Ther, 2014, 9(6): 513-521.
[9] Pal R, Gopinath C, Rao NM, et al. Functional recovery after transplantation of bone marrow-derived human mesenchymal stromal cells in a rat model of spinal cord injury. Cytotherapy, 2010, 12(6): 792-806.
[10] 葛丽特,卓毅,段答,等. 人嗅黏膜间充质干细胞的生物学特性. 中南大学学报(医学版),2015,40(01):53-58.
[11] Bas E, Van De Water TR, Lumbreras V, et al. Adult human nasal mesenchymal-like stem cells restore cochlear spiral ganglion neurons after experimental lesion. Stem Cells Dev,2014, 23(5): 502-514.
[12] Wagner W, Wein F, Seckinger A, et al. Comparative characteristics of mesenchymal stem cells from human bone marrow, adipose tissue, and umbilical cord blood. Exp Hematol,2005, 33(11): 1402-1416.
[13] 黄秋生,陆汉强,周月鹏,等. 成人鼻黏膜间充质干细胞的体外培养和多向诱导分化. 临床耳鼻咽喉头颈外科杂志,2012,11:490-493,498.
[14] Lindsay SL, Riddell JS, Barnett SC. Olfactory mucosa for transplant-mediated repair: a complex tissue for a complex injury. Glia, 2010, 58(2): 125-134.
[15] Parekkadan B, Milwid JM. Mesenchymal stem cells as therapeutics. Annu Rev Biomed Eng, 2010, 12: 87-117.
[16] Lee PH, Kim JW, Bang OY, et al. Autologous mesenchymal stem cell therapy delays the progression of neurological de fi cits in patients with multiple system atrophy. Clin Pharmacol Ther, 2008, 83(5): 723-730.
[17] Tavakoli F, Ostad SN, Khori V, et al. Outcome improvement of cellular cardiomyoplasty using triple therapy: mesenchymal stem cell +erythropoietin+vascular endothelial growth factor. Eur J Pharmacol, 2013, 714(1-3): 456-463.
[18] Zemel’ko VI, Kozhukharova IV, Kovaleva ZV, et al. BDNF secretion in human mesenchymal stem cells isolated from bone marrow, endometrium and adipose tissue. Tsitologiia,2014, 56(3): 204-211.
[19] Himes BT, Neuhuber B, Coleman C, et al. Recovery of function following grafting of human bone marrow-derived stromal cells into the injured spinal cord. Neurorehabil Neural Repair, 2006, 20(2): 278-296.

