促结缔组织增生性小圆细胞肿瘤临床病理分析并文献复习
张修云,袁静萍,阎红琳,吴昊
(武汉大学人民医院病理科,武汉430060)
促结缔组织增生性小圆细胞肿瘤(desmoplastic small round cell tumor,DSRCT)是一种高度恶性的小圆形细胞肿瘤,主要发生于青少年或年轻人的腹腔及盆腔,好发于男性。DSRCT病因不明,超微结构和免疫组化研究显示瘤细胞分化方向尚不确定,表现为上皮、肌肉或神经分化,目前认为起源于具有多向分化潜能的原始祖细胞[1]。遗传学上,DSRCT具有特征性的t(11;22)(p13;q12)易位,形成EWS-WT1融合基因[2]。现报道1例在穿刺活检小标本中诊断为DSRCT的病例,并结合相关文献讨论其临床特点、组织病理学特征、鉴别诊断、治疗与预后。
材料与方法
1 临床资料
患者,男性,29岁,于2015年4月来我院就诊,主诉:一周前无明显诱因腹部出现一包块,无疼痛感,大便次数增加,一天4~5次,颜色及性状均属正常,并伴有排尿困难。下腹可触及约8cm×8cm大小实质性肿块,质硬,活动度差,无压痛。胃肠外科肿瘤标记物示:NSE升高(88.05ng/mL)。核磁共振成像(magnetic resonance imaging,MRI)提示:左侧盆腔实性肿块,肿块大小为10.9cm×14.1cm,肿块包绕主动脉(图1A)。遂在B超引导下行腹腔肿块穿刺检查,病理确诊后采取放化疗,患者于2016年7月13日复查MRI显示肿块消失(图1B)。
2 HE染色与免疫组织化学染色
穿刺活检标本4% 中性福尔马林固定,常规脱水,石蜡包埋,4μm厚切片,HE染色,光镜观察。采用免疫组化SP法进行染色,所用抗体包括:desmin、CD117、PCK、vimentin、EMA、WT-1、LCA、NSE、CgA、DOG1、SMA、CD34、Bcl-2、myoglobin、myogenin、MyoD1、S-100、CD99、BCL-2及Ki67均购于福州迈新公司。以磷酸盐缓冲液代替一抗作为阴性对照,已知阳性切片作为阳性对照。
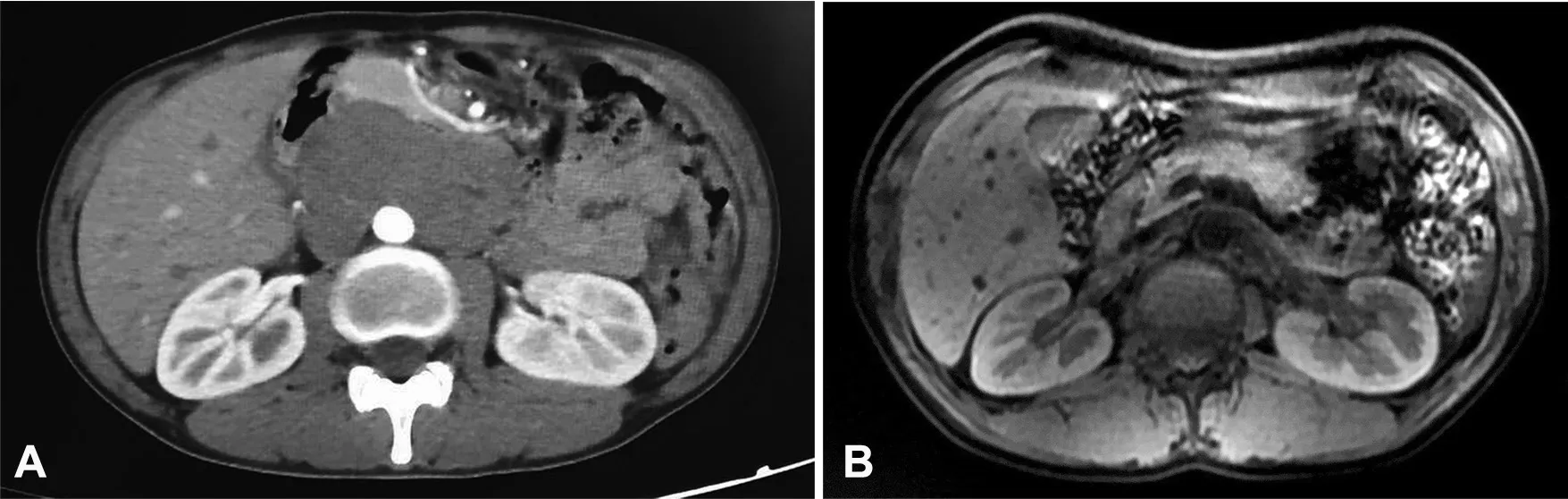
图1 患者治疗前后MRI结果。A,患者治疗前MRI提示左侧盆腔实性肿块;B,患者治疗后复查MRI显示肿块消失Fig. 1 MRI results before and after treatment. A, before treatment, MRI revealed a solid mass in the left pelvic cavity; B, MRI showed mass disappeared after treatment
结 果
1 组织学形态
低倍镜下,致密的纤维结缔组织中见大小不一、边界清楚的细胞巢和孤立小细胞岛(图2A),部分肿瘤细胞坏死。高倍镜下,细胞核深染,圆形或卵圆形,核仁不明显,胞质少,界限不清,核分裂象易见,可见核内包涵体(图2B),瘤细胞间为增生的致密结缔组织,并可见血管增生。
2 免疫组织化学表型
肿瘤细胞CD117阳性,desmin(图2C)、PCK(图2D)、vimentin、EMA核旁散点灶阳性,MyoD1(图2E)、WT-1、LCA、NSE、CgA、DOG1、SMA、CD34、Bcl-2、myoglobin、myogenin、S-100、CD99、BCL-2均阴性,Ki-67增殖指数约70%。
3 病理学诊断
根据形态学与免疫组织化学,该肿瘤诊断为促结缔组织增生性小圆细胞肿瘤。
4 治疗
治疗方案为化疗+放疗,共给予环磷酰胺联合表阿霉素及长春新碱化疗6周期,同时给予恩度抗血管靶向治疗2周期,期间多次复查腹部MRI提示腹部病灶明显缩小;后给予盆腔病灶放疗,共完成放疗计划70Gy/38F,2016年7月13日复查盆腔MRI未见明显肿块(图1B)。
5 随访
随访至今(29个月)病人状况良好。
讨 论
DSRCT是一种高度侵略性的小圆细胞肿瘤,预后很差,通常发生在年轻男性腹部或盆腔腹膜。病变特征表现为丰富的促结缔组织增生间质内小圆细胞增生,免疫组化检测显示多方向分化的特征。
临床表现:DSRCT多发于20~24岁的年轻人,平均年龄28.3岁(年龄范围为10~41岁),男女比例4:1,没有明显种族偏好[3]。常发生于腹腔,易累及骨盆、后腹膜、网膜、肠系膜等部位,亦可发生于其他罕见部位,如头、颈部(包括鼻腔鼻窦腔、唾液腺和脑),手和内脏器官(如小肠、大肠、卵巢、肾等),有时还可广泛播散性转移至肺和脑[3]。临床症状常表现为腹痛,腹胀或腹水,常伴有排尿困难、便秘、脐疝等压迫症状。由于转移性肿瘤分泌肾素,还可出现副肿瘤性现象,如严重的高血压和低钾血症和代谢性碱中毒[4]。影像学通常表现为多发性腹膜、大网膜肿块。肿块可单发或多发,但后者更常见。肿块较大,直径≥5厘米[3]。本例患者为29岁的年轻男性,发生于左侧盆腔,伴有排尿困难,MRI提示左侧盆腔实性肿块,肿块大小为10.9cm×14.1cm,与文献报道一致。

图2 促结缔组织增生性小圆细胞肿瘤病理学观察。A,低倍镜下,DSRCT示致密纤维结缔组织中大小不等形态不规则的小圆细胞巢;B,高倍镜下,DSRCT肿瘤巢内细胞排列紧密,细胞较小,深染,核仁不清,胞质少,局部细胞可见核内包涵体(黄色箭头);C,肿瘤细胞desmin染色呈特征性核旁散点状着色;D,肿瘤细胞PCK呈核旁散点状阳性;E,肿瘤细胞MyoD1阴性;比例尺,100μmFig. 2 Pathological observation of desmoplastic small round cell tumor. A, under low magni fi cation, DSRCT showed irregular small round cell nests scattered in dense fi brous connective tissue; B, under high magni fi cation, small DSRCT cells were densely packed with strong nuclei stain, obscue nucleoli, and little cytoplasm. Nuclear inclusions (yellow arrows) were seen in some cells; Desmin (C) and PCK (D) typically showed puncta stains in paranuclear region; E, the tumor cells were negative for MyoD1; scale bar, 100μm
病理学特征:肉眼观上,DSRCT通常为腹膜表面的多个白色结节,可伴有有坏死或出血,切面实性鱼肉状,有时伴囊性变。组织学上,肿瘤细胞大小不一,呈边界清楚的细胞巢和孤立小细胞岛,核深染,圆形、卵圆形或泡状核,核仁不明显,胞质少,界限不清,癌巢内可见有大量的有丝分裂和坏死。通常情况下,显著增生的结缔组织将肿瘤分成大小不同的癌巢,其内含有梭形的成纤维细胞以及肌纤维母细胞,并可见血管增生。鉴于肿瘤和肿瘤之间或个别肿瘤的不同区域在细胞组成、结构、间质成分的数量或外观、细胞学和免疫反应都有显著的变化,所以在小的活捡标本中可能不会出现典型的特征,加大诊断的难度,本例患者即是穿刺活检标本,镜下可见大小不一、边界清楚的细胞巢和孤立小细胞岛,瘤细胞巢之间为增生的致密结缔组织,并可见血管增生,细胞核深染,圆形或卵圆形,核仁不明显,胞质少,界限不清,核分裂象易见,符合DSRCT组织学特征。少数的病例中,细胞异型性较大,具有大核甚至是巨大的奇异核,甚至肿瘤主要由具有非典型细胞核的细胞或梭形细胞组成[3]。大细胞变异体主要发生在间变酷似转移癌的区域,细胞呈上皮样细胞及胞质透亮或空泡变,有时细胞巢内可见花环或小管样结构,局灶肿瘤细胞核内有嗜酸性包涵体,本例局部可见核内包涵体。还有一些病例中肿瘤表现为局灶性上皮细胞分化,形成腺体或单列线样排列(类似乳腺浸润性小叶癌)[3]。
免疫组织化学表型:经典DSRCT具有多重免疫组织化学表型,大部分情况下表达desmin、vimentin、EMA和细胞角蛋白(包括AE1/AE3、CAM5.2而不是CK5/6或CK20),其中desmin、vimentin和角蛋白呈核旁点状分布[5]。多数情况下还表达神经标志物,如NSE和CD57,少数表达嗜铬粒素、突触素、CD56、CD117、神经丝蛋白、S100、肌特异性肌动蛋白或αSMA[1]。值得注意的是,通常情况下阳性表达的desmin或细胞角蛋白有时也可能是阴性,例如在穿刺活检标本中有时desmin不表达[3]。此外,近90%的DSRCT表达WT1基因羧化端[1,5],而CD99、myogenin、myoD1、myoglobin、CK5/6、CK20、HMB45通常不表达。本例为穿刺活检标本,肿瘤细胞CD117阳性,desmin、PCK、vimentin、EMA核旁散点灶阳性,LCA、NSE、CgA、DOG1、SMA、CD34、Bcl-2、myoglobin、myogenin、MyoD1、S-100、CD99、Bcl-2均阴性,与文献报道相似。
超微结构:DSRCT超微结构特点为未分化的小细胞,胞质内含少量糖原、游离核糖体、粗面内质网及中等量的线粒体。多数细胞之间连接不丰富,少数细胞之间可见小的、较成熟的桥粒。多数可见核旁中间丝聚集体和漩涡状结构,对应免疫组织化学vimentin和desmin核旁点状染色[1,9]。癌巢周围可见肌纤维母细胞样的间质。有些肿瘤还可显示树突样突起,含有微管和致密核心颗粒,可对应免疫组织化学神经标记物染色[1,9]。
遗传学:DSRCT与EWSR1-WT1基因融合密切相关,具有特征性的t(11;22)(p13;q12)易位,使位于22号染色体上的EWSR1基因与位于11号染色体上的WT1基因融合,融合性基因中含有EWSR1基因的最初7个外显子和WT1基因的8、9、10号外显子[10]。EWSR1-WT1融合基因表达特异的 EWS-WT1 蛋白,复合基因产物含有EWSR1氨基末端结构域及WT1基因锌指DNA结合结构域,WT1锌指结构域可激活PDGFA、PAX2的表达,胰岛素样生长因子-1受体,表皮生长因子受体等,其中PDGFA是一种强有力的成纤维细胞生长因子,EWSR1-WT1诱导PDGFA表达可能是DSRCT中纤维结缔组织显著增生的原因[11]。
鉴别诊断:由于DSRCT与其他小圆细胞肿瘤在组织学上有些类似,鉴别诊断较难,特别是在小的活检标本中诊断DSRCT更具有挑战性,因为一些在大标本中比较鲜明的组织学特点可能在小标本中并不突出(如间质),某些特异性的免疫组化标记物在组织有限的小标本中也可能不具代表性[12-15]。此外,EWSR1-WT1基因融合不单单在DSRCT中出现,在某些肿瘤中也是缺失的。因此DSRCT鉴别诊断是广泛的:① 尤文肉瘤:当出现在腹膜后,DSRCT常被误认为是尤文肉瘤。但典型的尤文肉瘤CD99呈弥漫强阳性表达,WT1阴性,大多数肿瘤含有EWSR1和ETS家族转录因子的特征性易位,缺乏EWSR1-WT1基因融合。② 腺泡状横纹肌肉瘤(ARMS):都发生在年轻的患者人群,但ARMS主要发生在四肢、躯干、头部和颈部,腹腔内原发不常见。虽然ARMS也表达desmin,但常呈弥漫强阳性,除desmin外,还表达Myogenin和MyoD1,但是DSRCT不表达这两种蛋白。 此外,ARMS通常包含PAX3/7-FOXO1基因融合可用于鉴别。③ 腹腔转移性小细胞癌或默克尔细胞癌:主要发生在老年患者,均不表达desmin和WT1。④ 神经母细胞瘤:通常发生在婴幼儿,大多数持续表达NB84、神经丝蛋白、嗜铬素、突触素和CD56,不表达desmin和WT1。⑤ 以胚芽成分为主的肾母细胞瘤:两者组织学特征相似的,都同时表达desmin和细胞角蛋白,并且desmin核旁点状表达在 DSRCT和以胚芽成分为主的肾母细胞瘤中出现的频率相同,这会增加诊断难度。区分两种疾病的最佳方法是EWSR1-WT1融合基因的检测及WT1羧化端和氨基端的双重免疫组化检测。DSRCT选择性表达WT-1羧化端,而肾母细胞瘤同时表达WT1羧化端和氨基端。⑥ 胃肠道间质瘤(gastrointestinal stromal tumors,GISTs):GISTs至少局部仍然表达CD117和DOG1,也表达CD34和高分子量钙结合蛋白(H-caldesmon),一般不表达CK和desmin。⑦子宫内膜间质肉瘤(endometrial stromal sarcoma,ESS): 多发生在老年女性患者,紧密排列的细胞单个散在或成巢分布,和DSRCT相似,CD10、ER、PR弥漫阳性可鉴别。⑧间皮瘤:DSRCT瘤中不表达CK5/6和calretinin等间皮性标记,而间皮瘤中瘤细胞无desmin核旁点状染色特点。
治疗与预后:DSRCT是一种预后较差的侵袭性肿瘤,易转移,多数患者在确诊后的前两年死亡。总体而言,DSRCT的3年和5年生存率分别为44%和15%[16]。DSRCT最初的治疗方案是采用治疗尤文氏肉瘤的联合化疗方案,但随后发现,尽管都是小圆细胞肿瘤,但DSRCT很少获得病理学上的完全缓解,最大限度的肿瘤细胞减灭术及腹盆腔放疗可显著提高生存率[17]。目前,以多药物强化化疗、最大限度的肿瘤细胞减灭术以及全腹盆腔放疗为基础的多模式综合疗法已成为无腹腔外转移的DSRCT患者的标准疗法[18]。然而,本例患者不同于报道病例,通过给予环磷酰胺联合表阿霉素及长春新碱化疗6周期,同时给予恩度抗血管靶向治疗2周期,期间多次复查腹部MRI提示腹部病灶明显缩小,后给予盆腔病灶放疗,共完成放疗计划70Gy/38F,复查盆腔MRI未见明显肿块,随访至今,肿块消失,预后较好。
[1] Ordóñez NG. Desmoplastic small round cell tumor: II: an ultrastructural and immunohistochemical study with emphasis on new immunohistochemical markers. Am J Surg Pathol,1998, 22(11): 1314-1327.
[2] Thomas R, Rajeswaran G, Thway K, et al. Desmoplastic small round cell tumour: the radiological, pathological and clinical features. Insights Imaging, 2013, 4(1): 111-118.
[3] Thway K, Noujaim J, Zaidi S, et al. Desmoplastic small round cell tumor: pathology, genetics, and potential therapeutic strategies. Int J Surg Pathol, 2016, 24(8): 672-684.
[4] Lee HJ, Hyun JS, Jang HS, et al. Paraneoplastic secondary hypertension due to a renin-secreting desmoplastic small round cell tumor: A case report. Oncol Lett, 2014, 8(5):1986-1992.
[5] Zhang PJ, Goldblum JR, Pawel BR, et al. Immunophenotype of desmoplastic small round cell tumors as detected in cases with EWS-WT1 gene fusion product. Mod Pathol, 2003,16(3): 229-235.
[6] Murphy AJ, Bishop K, Pereira C, et al. A new molecular variant of desmoplastic small round cell tumor: signi fi cance of WT1 immunostaining in this entity. Hum Pathol, 2008,39(12): 1763-1770.
[7] Hung YP, Fletcher CD, Hornick JL. Evaluation of NKX2-2 expression in round cell sarcomas and other tumors with EWSR1 rearrangement: imperfect specificity for Ewing sarcoma. Mod Pathol, 2016, 29(4): 370-380.
[8] Yoshida A, Sekine S, Tsuta K, et al. NKX2.2 is a useful immunohistochemical marker for Ewing sarcoma. Am J Surg Pathol, 2012, 36(7): 993-999
[9] Pasquinelli G, Montanaro L, Martinelli GN. Desmoplastic small round-cell tumor: a case report on the large cell variant with immunohistochemical, ultrastructural, and molecular genetic analysis. Ultrastruct Pathol, 2000, 24(5): 333-337.
[10] Liu J, Nau MM, Yeh JC, et al. Molecular heterogeneity and function of EWS-WT1 fusion transcripts in desmoplastic small round cell tumors. Clin Cancer Res, 2000, 6(9): 3522-3529.
[11] Cliteur VP, Szuhai K, Baelde HJ, et al. Paratesticular desmoplastic small round cell tumour: an unusual tumour with an unusual fusion; cytogenetic and molecular genetic analysis combining RT-PCR and COBRA-FISH. Clin Sarcoma Res,2012, 2(1): 3.
[12] Antonescu C. Round cell sarcomas beyond Ewing: emerging entities. Histopathology, 2014, 64(1): 26-37.
[13] Thway K, Fisher C. Malignant peripheral nerve sheath tumor: pathology and genetics. Ann Diagn Pathol, 2014,18(2):109-116.
[14] Ud Din N, Pekmezci M, Javed G, et al. Low-grade small round cell tumor of the cauda equina with EWSR1-WT1 fusion and indolent clinical course. Hum Pathol, 2015, 46(1):153-158.
[15] 钱华,肖蔚,于鸿,等. 促结缔组织增生性小圆细胞肿瘤1例. 临床与实验病理学杂志,2011,27(9):1025-1026.
[16] Bono F, Testi MA, Rosai J. Desmoplastic small cell tumor with bizarre giant nuclei. Int J Surg Pathol, 2011, 19(6): 843-846.
[17] Schwarz RE, Gerald WL, Kushner BH, et al. Desmoplastic small round cell tumors: prognostic indicators and results of surgical management. Ann Surg Oncol, 1998, 5(5): 416-422.
[18] Honoré C, Amroun K, Vilcot L, et al. Abdominal desmoplastic small round cell tumor: multimodal treatment combining chemotherapy, surgery, and radiotherapy is the best option.Ann Surg Oncol, 2015, 22(4):1073-1079.

