LncRNA NNT-AS1对胃癌细胞增殖、凋亡作用机制研究
帅勇锋 王小军 张一中
胃癌是世界范围内常见的恶性肿瘤,发病率在所有肿瘤中排第4位,病死率排第2位;据统计,2012年全球共有951 600人诊断为胃癌,723 100人死于胃癌[1]。约70%的胃癌病例发生于发展中国家,以55~80岁人群高发,5年生存率为10%~30%[2];而日本得益于早发现、早诊断、早手术,胃癌的5年生存率为50%~70%[3]。深入研究胃癌的发病机制对研制有效的治疗药物,提高治疗效果具有重要意义。长链非编码RNA(Long non-coding RNAs,LncRNAs)是一类长度超过200个核甘酸的RNA,不具有编码蛋白质的功能,其可通过染色质重塑介导基因的沉默或激活[4],在肿瘤细胞增殖、凋亡、侵袭、转移等过程中起重要作用[5-6]。LncRNA NNT-AS1由5p12染色体编码,在结肠癌细胞中高表达,下调LncRNA NNT-AS1表达可降低结肠癌细胞增殖、迁移和侵袭能力[7]。然而,LncRNA NNT-AS1在胃癌发生、发展过程中所起的作用,目前报道少见。本实验在体外条件下研究LncRNA NNT-AS1对胃癌细胞增殖、凋亡的作用机制,以供临床参考,现报道如下。
1 材料和方法
1.1材料正常人胃成纤维细胞系NSFC、胃癌细胞系KATO-Ⅲ、NUGC-3、AGS、N87均购自中国医学科学院,DMEM培养基、FBS、胰蛋白酶均购自美国Gibco公司,Trizol购自美国Invitrogen公司;Western blot所用一抗购自美国BD公司,HRP标记的二抗购自英国Abcam公司;罗氏HP DNA转染试剂、polybrane购自Sigma公司,慢病毒及转染序列设计由广州锐博生物科技有限公司完成。
1.2方法
1.2.1慢病毒包装与感染取慢病毒包装质粒1.5μg、shRNA慢病毒质粒0.5μg,用罗氏转染试剂以DNA(μg):转染试剂(μl)为1∶2的比例,共转染至接种于6孔板的HEK293T细胞中,转染48h后,收集细胞培养液,即慢病毒液。此慢病毒液可直接感染KATO-Ⅲ细胞,加入终浓度为8μg/ml的polybrane,慢病毒感染24h后,更换新鲜培养基,继续培养24h,加入puromycin筛选3~5d,待细胞不死亡,即提示稳定细胞株构建成功。
1.2.2细胞培养、慢病毒感染及分组将胃癌细胞系KATO-Ⅲ、NUGC-3、AGS、N87及正常人胃成纤维细胞系NSFC培养于含10%FBS、1%双抗的RPMI1640培养基中,于5%二氧化碳、37℃条件下培养。将KATO-Ⅲ细胞系分成对照组、sh-vector组及sh-NNT-AS1组共3组,分别不感染慢病毒、感染阴性shRNA慢病毒及感染lenti-sh-NNT-AS1慢病毒,构建成稳定细胞株后进行后续实验。
1.2.3RNA提取和实时荧光定量PCR检测LncRNA NNT-AS1采用Trizol提取细胞总RNA,并按TaqMan RNA reverse transcription kit(ABI,USA)说明书,将5ng的总RNA逆转录合成cDNA。在ABI 7500实时荧光定量PCR仪中,使用SYBR Green PCR master mix试剂(Roche,USA),以β-actin作为内参,量化LncRNA NNTAS1的表达水平。选取的引物如下:LncRNA NNT-AS1上游引物5′-TGAAGTTTTCAGGGACACAT-3′,下游引物5′-TTTAGACCTGTTTCTTTGTT-3′;β-actin正向引物5′-TGGCACCCAGCACAATGAA-3′,反向引物3′-CTAAGTCATAGTCC-GCCTAGAAGCA-5′,使用2-ΔΔCt方法定量,计算LncRNA NNT-AS1的相对表达水平。
1.2.4MTT细胞增殖实验3组细胞在培养箱中培养24h后添加5mg/ml MTT溶液40μl,孵育4h后每孔加入200μl DMSO,摇床上充分震荡。接着培养12、24、48、72h,490nm波长测定吸光度值(OD490值),OD490值越高表示细胞增殖能力越强。实验重复3次,取平均值。
1.2.5细胞克隆形成实验将3组细胞按600个细胞/孔培养7d后,测定克隆形成数。先去除培养液,用PBS清洗3遍,再用甲醇固定细胞20min,然后1%亚甲基蓝染色40min,去离子水清洗2遍,晾干。显微镜下计算>50个细胞的克隆形成数量。
1.2.6流式细胞术检测细胞凋亡采用Annexin V/PI染色检测,将3组细胞消化成单细胞悬液后,PBS清洗2次,Binding Buffer重悬,加入相应比例的Annexin V抗体,避光染色10min后加入适量PBS溶液以及PI染料,流式细胞仪检测Annexin V阳性细胞比例来确定细胞凋亡情况。
1.2.7Western blot法检测细胞凋亡蛋白Caspase3、8、9表达提取sh-vector组和sh-NNT-AS1组细胞总蛋白,每孔30μg总蛋白上样,常规湿法转膜,5%脱脂奶粉封闭2h;分别加入caspase3、8、9、β-actin一抗(1∶200),孵育过夜,PBS漂洗,再加入二抗1∶1 000,孵育2h,ECL液发光,凝胶成像系统显影。用Quantity One 1-D分析软件(美国Bio-Rad公司)对蛋白质印迹条带进行定量。以目的蛋白测定值与GAPDH的比值作为蛋白的相对表达水平。
1.3观察指标(1)比较胃癌细胞与正常胃成纤维细胞LncRNA NNT-AS1表达水平;(2)比较sh-NNT-AS1组、sh-vector组、对照组细胞增殖情况;(3)比较sh-NNTAS1组、sh-vector组、对照组细胞凋亡情况;(4)比较sh-NNT-AS1组、sh-vector组细胞凋亡蛋白Caspase3、8、9表达水平。
1.4统计学处理应用SPSS20.0统计软件;计量资料以表示,两组比较采用两独立样本t检验,3组比较采用单因素方差分析,组间两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1胃癌细胞与正常胃成纤维细胞LncRNA NNT-AS1表达水平比较见图1。
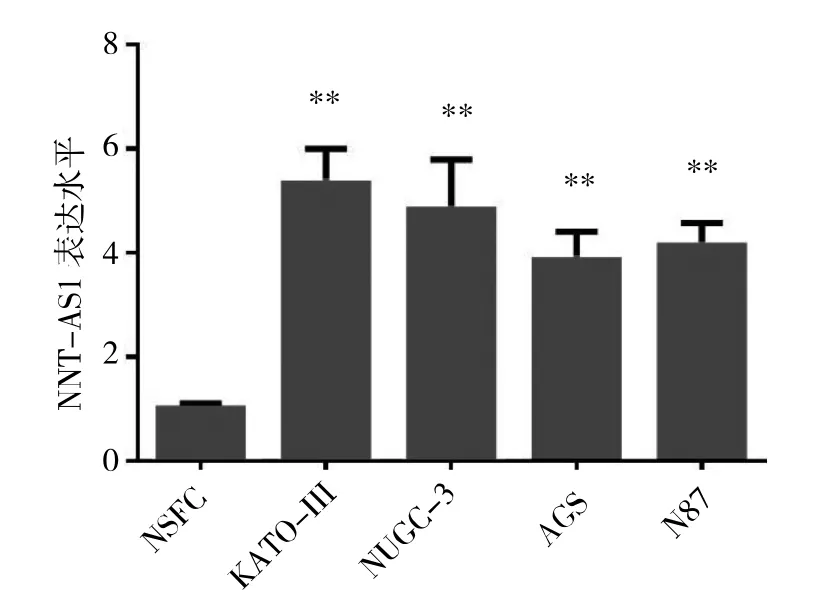
图1 胃癌细胞与正常胃成纤维细胞LncRNA NNT-AS1表达水平比较(**P<0.01)
由图1可见,LncRNA NNT-AS1在胃癌细胞系KATO-Ⅲ、NUGC-3、AGS、N87的相对表达水平分别为5.33±0.67、4.82±0.97、3.86±0.54及4.13±0.44,在正常胃成纤维细胞NSFC的相对表达水平为1.0±0.03。胃癌细胞系KATO-Ⅲ、NUGC-3、AGS、N87 LncRNA NNT-AS1的表达水平均明显高于正常胃成纤维细胞系NSFC(均P<0.01)。
2.2sh-NNT-AS1组、sh-vector组、对照组细胞增殖情况比较见图2。
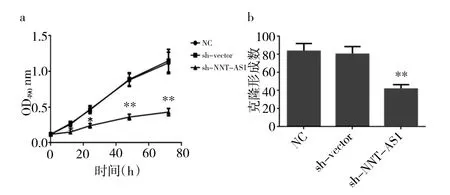
图2 sh-NNT-AS1组、sh-vector组、对照组细胞增殖情况比较(a:OD490值比较;b:克隆形成数比较;*P<0.05,**P<0.01,***P<0.001)
由图2可见,细胞培养12、24、48、72 h后,相比sh-vector组、对照组,sh-NNT-AS1组OD490值明显降低(均P<0.05)。细胞培养7d后,sh-NNT-AS1组克隆形成数明显低于sh-vector组、对照组(均P<0.05)。即LncRNA NNT-AS1沉默抑制胃癌细胞增殖。
2.3sh-NNT-AS1组、sh-vector组、对照组细胞凋亡情况比较见图3。
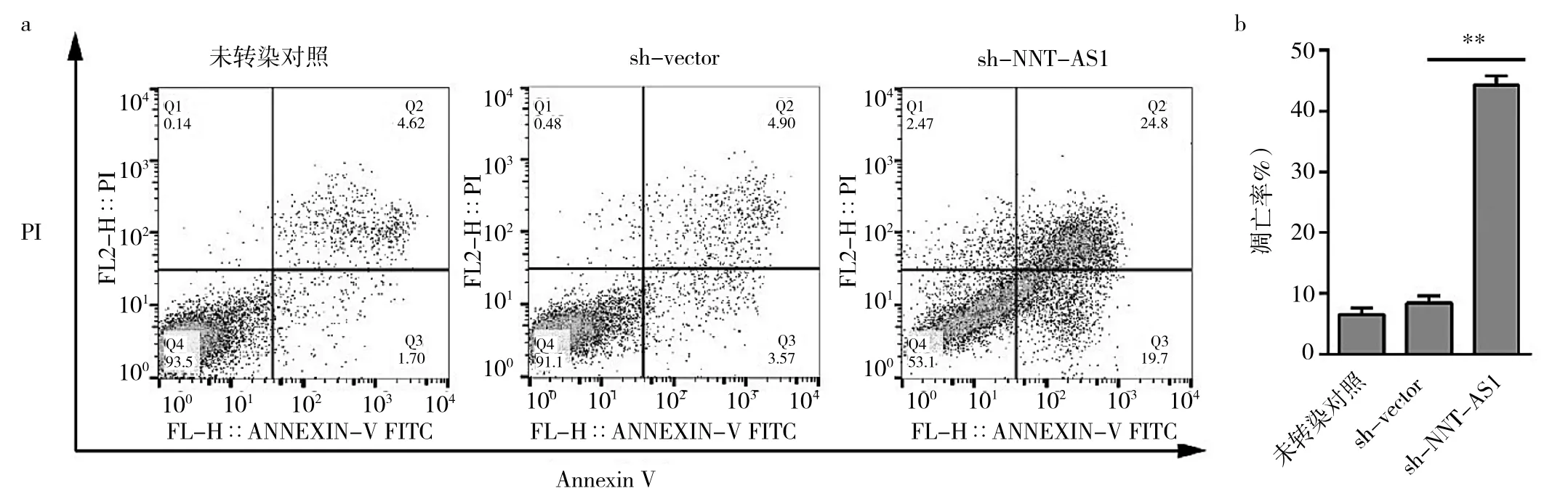
图3 sh-NNT-AS1组、sh-vector组、对照组细胞凋亡情况比较(a:流式细胞图比较;b:凋亡率比较;**P<0.01)
由图3可见,sh-NNT-AS1组细胞凋亡率明显高于sh-vector组、对照组(均P<0.01),即LncRNA NNTAS1沉默促进胃癌细胞凋亡。
2.4sh-NNT-AS1组、sh-vector组细胞凋亡蛋白Caspase3、8、9表达水平比较见图4。
由图4可见,sh-NNT-AS1组细胞凋亡蛋白Caspase3、9表达水平均高于sh-vector组(均P<0.05),而Caspase 8表达水平比较差异无统计学意义(P>0.05)。即LncRNA NNT-AS1沉默促进胃癌细胞凋亡的机制是通过上调凋亡蛋白Caspase3、9表达来诱导。
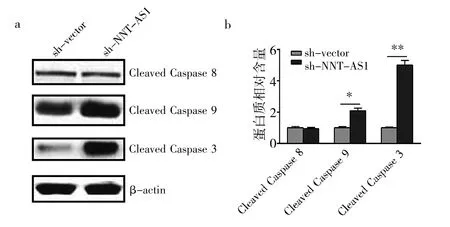
图4 sh-NNT-AS1组、sh-vector组细胞凋亡蛋白Caspase3、8、9表达水平比较(a:蛋白电泳图比较;b:蛋白表达水平比较;*P<0.05,**P<0.01)
3 讨论
胃癌的发生、发展是涉及到一系列病因的多步骤、复杂过程。幽门螺杆菌感染、高盐饮食、家族史、吸烟都是影响胃癌发病的因素[8-9]。约95%的胃癌为腺癌,依据大体形态可分为弥散型和肠型。早发现、早手术仍是治疗胃癌的最有效方法,但胃癌在临床发现时往往已是晚期,明确胃癌的发病机制对提高胃癌治疗效果显得尤为重要。
肿瘤的发生、发展涉及一系列重要分子和信号通路突变,如miRNA[10-11]、p53[12]、Ras[13]、LncRNAs[14]等。LncRNAs是近年来肿瘤界研究的热点分子,其被报道在肿瘤发生、发展过程中起重要作用。Tuo等[15]报道LncRNA UCA1通过下调miR-143表达在乳腺癌中起促癌作用。Shi等[16]报道LncRNA GAS5过表达可诱导非小细胞肺癌凋亡和生长阻滞。Ding等[17]报道LncRNA PVT1在肝癌组织中表达上调,且与肝癌复发相关。Li等[18]报道LncRNA HOTAIR通过下调肝癌干细胞的SETD2表达促进肿瘤发生。
LncRNA NNT-AS1是种新发现的LncRNAs分子,包含3个外显子,定位于5号染色体的43573185-43603230区[7]。Wang等[7]报道LncRNA NNT-AS1高表达于结肠癌组织,且是影响结肠癌无瘤生存和总生存率的独立影响因素,抑制其表达可在体外及体内抑制结肠癌细胞增殖、克隆形成、迁移及侵袭,并抑制上皮间质转化过程。本研究在体外实验中发现,LncRNA NNT-AS1在胃癌细胞系中较在正常胃上皮细胞系中高表达,沉默LncRNA NNT-AS1表达可抑制胃癌细胞系KATO-Ⅲ细胞增殖和克隆形成。这表明沉默LncRNA NNT-AS1可在体外抑制胃癌细胞增殖。
细胞凋亡是程序性的细胞死亡,是细胞自杀性的过程,以凋亡小体形成为特征,进而DNA裂解成200bp左右的不等片段。细胞凋亡由一系列信号通路所触发,主要包括两条路径[19],其一为外源性路径,由TNF受体1、Fas/CD95、DR3和TRAIL-R1等死亡受体介导,配体与受体结合后,进一步激活Caspase 3、8酶活性并诱导凋亡[20];其二为内源性路径,也即线粒体途径,各种凋亡刺激导致线粒体外膜通透性改变,进一步激活Caspase3、8、9,裂解多聚(ADP-核糖)聚合酶,使DNA修复终止,活化核酸内切酶,并将DNA裂解为180~200bp大小的片段,同时破坏细胞骨架蛋白、细胞外基质蛋白、核蛋白等,使细胞失去正常形态,最终诱导细胞走向凋亡[21-22]。本研究对3组分别行流式细胞术,发现sh-NNT-AS1组细胞凋亡率明显高于对照组、sh-vector组,提示沉默LncRNA NNT-AS1表达可诱导胃癌细胞系KATO-Ⅲ凋亡。进一步对sh-NNT-AS1组、sh-vector组行Western blot,发现sh-NNT-AS1组凋亡蛋白Caspase 8表达水平与sh-vector组比较差异无统计学意义,而sh-NNT-AS1组Caspase3、9表达水平均高于sh-vector组,这表明其诱导凋亡的机制是通过内源性通路诱导。
综上所述,本研究结果显示LncRNA NNT-AS1在胃癌细胞中高表达,沉默NNT-AS1表达可抑制胃癌细胞系KATO-Ⅲ增殖,并诱导胃癌细胞系KATO-Ⅲ凋亡,机制可能与上调凋亡蛋白Caspase3、9表达有关。LncRNA NNT-AS1或可作为胃癌治疗的一个新靶点。当然,本研究也存在一些不足,如尚缺乏动物体内的研究数据,LncRNA NNT-AS1靶向调节miRNA分子机制也不清楚,均值得进一步深入研究。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA:a cancer journal for clinicians,2015,65(2):87-108.
[2]Chen W,Zheng R,Zuo T,et al.National cancer incidence and mortality in China,2012[J].Chinese Journal of Cancer Research,2016,28(1):1.
[3]Matsuda T,Saika K.The 5-year relative survival rate of stomach cancer in the USA,Europe and Japan[J].Japanese journal of clinical oncology,2013,43(11):1157-1158.
[4]Kapranov P,Cheng J,Dike S,et al.RNA maps reveal new RNA classes and a possible function for pervasive transcription[J].Science,2007,316(5830):1484-1488.
[5]Kogo R,Shimamura T,Mimori K,et al.Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modification and is associated with poor prognosis in colorectal cancers[J].Cancer Research,2011,71(20):6320-6326.
[6]Zhao J,Sun BK,Erwin JA,et al.Polycomb proteins targeted by a short repeat RNA to the mouse X chromosome[J].Science,2008,322(5902):750-756.
[7]Wang Q,Yang L,Hu X,et al.Upregulated NNT-AS1,a long noncoding RNA,contributes to proliferation and migration of colorectal cancer cells in vitro and in vivo[J].Oncotarget,2017,8(2):3441.
[8]Helicobacter A.Helicobacter and Cancer Collaborative Group.Gastric cancer and Helicobacter pylori:A combined analysis of 12 case control studies nested within prospective cohorts[J].Gut,2001,49(3):347-353.
[9]Piazuelo MB,Correa P.Gastric cancer:overview[J].Colombia Medica,2013,44(3):192-201.
[10]吴春蓉,罗治彬,陈伟.miR-451对结肠癌细胞系SW620生物学行为的影响[J].解放军医学杂志,2011,36(5):478-482.
[11]张超,姚志勇,朱鸣阳,等.MicroRNA-34a通过Notch1对膀胱肿瘤细胞株T24增殖的影响[J].解放军医学杂志,2012,37(5):426-430.
[12]周洁,李华仁,张锦波,等.p53,rasp21及C-myc癌基因蛋白在胃癌中的表达及分布特征[J].解放军医学杂志,2005,30(11):1009-1011.
[13]李陈婕,羊志辉,陈森林,等.HER-2与K-RAS在结直肠癌中的表达及意义[J].解放军医学杂志,2007,32(6):598-600.
[14]石永国,王科明.lncRNA在消化系统肿瘤中的研究进展[J].中国肿瘤临床,2013(15):938-940.
[15]Tuo YL,Li XM,Luo J.Long noncoding RNA UCA1 modulates breast cancer cell growth and apoptosis through decreasing tumor suppressive miR-143[J].European Review for Medical&Pharmacological Sciences,2015,19(18):3403.
[16]Shi X,Sun M,Liu H,et al.A critical role for the long non-coding RNA GAS5 in proliferation and apoptosis in non-small-cell lung cancer[J].Molecular Carcinogenesis,2015,54(S1):E1.
[17]Ding C,Yang Z,Lv Z,et al.Long non-coding RNA PVT1 is associated with tumor progression and predicts recurrence in hepatocellular carcinoma patients[J].Oncology Letters,2015,9(2):955.
[18]Li H,An J,Wu M,et al.LncRNA HOTAIR promotes human liver cancer stem cell malignant growth through downregulation of SETD2[J].Oncotarget,2015,6(29):27847-27864.
[19]An Q,Han C,Zhou Y,et al.Matrine induces cell cycle arrest and apoptosis with recovery of the expression of miR-126 in the A549 non-small cell lung cancer cell line[J].Molecular Medicine Reports,2016,14(5):4042-4048.
[20]Wang L,Yang JK,Kabaleeswaran V,et al.The Fas-FADD death domain complex structure reveals the basis of DISC assembly and disease mutations[J].Nat Struct Mol Biol,2010,17(11):1324-1329.
[21]Tait SWG,Green DR.Mitochondrial regulation of cell death[J].Csh Perspect Biol,2013,5(9):8706.
[22]McIlwain DR,Berger T,Mak TW.Caspase functions in cell death and disease[J].Csh Perspect Biol,2013,5(4):a008656.

