SIRT1、FoxO3a在DHEA诱导多囊卵巢综合征模型大鼠卵巢组织中的表达及意义
何轶然 张治芬 王芳 吴红艳 贾涔琳 魏双双 黄坚 卓广超
多囊卵巢综合征(polycystic ovary syndrome,PCOS),是青春期和育龄期妇女常见的生殖内分泌疾病,以卵巢分泌的雄激素过多、排卵障碍、糖脂代谢紊乱、月经失调为主要特征,其临床表现具有高度异质性,在育龄期妇女中发病率高达5%~10%[1]。近年来大量研究显示,PCOS患者普遍处于一种慢性轻度炎症状态[2],其通过炎症信号传导通路与胰岛素信号传导通路进行交叉对话,诱发胰岛素抵抗,是PCOS患者胰岛素抵抗的始动因素和核心环节[3]。且PCOS患者体内炎症因子水平与其循环中雄激素水平呈正相关[4]。沉默信息调节因子1(silent information regulator 1,SIRT1)是依赖于烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的脱乙酰酶,SIRT1可通过对组蛋白和非组蛋白以及多种转录因子的去乙酰化作用,影响多条信号通路,从而参与细胞衰老凋亡、胰岛素分泌、糖脂类代谢、血管生成、炎症反应等过程[5-7]。SIRT1过表达的转基因小鼠表现出卵泡发育成熟受抑制以及性成熟推迟[8];而SIRT1基因缺失的小鼠,无论雄雌,均无生育功能[9-10],提示SIRT1在调控哺乳动物生殖系统功能方面有着重要作用。目前关于SIRT1与PCOS的关系尚存在争议,我们找到了SIRT1下游的重要调控因子——叉头蛋白盒转录因子3a(forkhead-box transcription factor 3a,Fox-O3a),该因子在细胞自噬调控中具有重要作用。本研究拟通过定位与定量检测其在大鼠卵巢中的表达,探讨SIRT1/FoxO3a信号通路在PCOS大鼠卵巢发育中的作用机制。
1 实验动物和方法
1.1实验动物和试剂选取21日龄清洁级雌性SD大鼠20只,由浙江省医学科学院动物实验中心提供,饲养于(22±2)℃条件下,自由饮水,标准饲料喂养。主要试剂:脱氢表雄酮(DHEA)试剂(中国国药集团化学试剂有限公司,XW00534303,规格:98%)、ELISA试剂盒(美国CUSABIO公司)、一抗SIRT1、FoxO3a(武汉三鹰生物技术有限公司)、HRP标记山羊抗兔鼠二抗(武汉塞维尔生物科技有限公司)、总RNA提取试剂盒(武汉塞维尔生物科技有限公司)、引物:SIRT1、FoxO3a(武汉塞维尔生物科技有限公司)。
1.2方法
1.2.1动物分组和模型制备大鼠适应性喂养4d后(25日龄),将体质量相当(60±10)g的大鼠采用简单随机化分组法分为两组:PCOS模型组(DHEA组)及正常对照组(NC组),每组10只。DHEA组颈部皮下注射DHEA 6mg/(100g·d)(DHEA溶于0.2ml芝麻油),NC组颈部皮下注射芝麻油0.2ml/d。两组均持续给药20d。1.2.2标本采集20d后,给予大鼠10%水合氯醛麻醉,腹主动脉采血,2 000r/min离心20min取血清,-80℃冻存待用。摘取大鼠双侧卵巢组织,剔除周围的脂肪及结缔组织后,称重,一侧卵巢经液氮浸没后于-80℃冰箱保存备用,另一侧卵巢采用4%多聚甲醛固定,常规脱水,石蜡包埋,切片厚度为5μm。观察光镜下(HE染色)形态学改变。
1.2.3观察指标
1.2.3.1动情周期监测药物干预后10d,连续阴道涂片10d以监测大鼠动情周期的变化,显微镜下大鼠动情周期判断标准:(1)动情前期:以大而圆、形状规则的有核上皮细胞为主;(2)动情期:以无核的角质化细胞为主;(3)动情后期:可见有核上皮细胞、角质化细胞及白细胞,且3者构成比例相当;(4)动情间期:以大量白细胞为主。根据大鼠阴道上皮细胞是否存在周期性变化来判定造模是否成功。
1.2.3.2相关激素及生化指标测定采用ELISA法测定各组大鼠血清黄体生成素(LH)、卵泡刺激素(FSH)、睾酮(T)、空腹血糖值(FPG)及胰岛素(FINS)水平。采用终点法测定血清HDL、LDL、TC和TG水平。根据HOMA-IR的计算公式(HOMA-IR=FPG×FINS/22.5)计算HOMA-IR指数值。
1.2.4免疫组化取各组大鼠卵巢组织标本,石蜡切片脱蜡至水后置于柠檬酸抗原修复缓冲液(PH6.0)的修复盒中修复抗原20min,滴加一抗(SIRT1、FoxO3a稀释浓度为1∶100),4℃孵育切片,过夜。然后滴加HRP标记山羊抗兔鼠二抗覆盖,室温孵育50min。DAB显色,常规脱水封片,显微镜镜检,观察并比较各组棕黄色颗粒的阳性细胞表达情况。每组内每张切片随机挑选至少3个200倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0(Media Cybernetics,Inc.,Rockville,MD,USA)软件选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的累积光密度值(IOD)以及组织的像素面积(AREA)。并求出平均光密度值IOD/AREA(Mean Density)用以定量分析。
1.2.5逆转录聚合酶链反应(RT-PCR)采用总RNA抽提试剂盒提取卵巢组织总RNA。取2μg RNA逆转录合成cDNA,再取逆转录产物2.5μl进行PCR扩增。SIRT1引物序列上游:5′-TGACCTCCTCATTGTTATTGGG-3′,下游:5′-GGCATACTCGCCACCTAAC-CT-3′;FoxO3a引物序列上游:5′-AACAGTACCGTGTTCGGACC-3′,下游:5′-AGTGTCTGGTTGCCGTAGTG-3′;内参GAPDH引物序列上游:5′-TTCCTACCCCCAATGTATCCG-3′,下游:5′-CATGAGGTCCACCACCCTGTT-3′。PCR反应:95℃预变性10min,95℃变性15s,60℃复性1min,共40个循环。反应结束后,收集数据,采取2-ΔΔCT法进行相对定量分析。
1.3统计学处理采用SPSS 23.0统计软件,计量资料以表示,先采用正态性检验和方差齐性检验,若方差齐采用两独立样本t检验,方差不齐则采用t′检验;不符合正态分布的计量资料采用非参数检验。
2 结果
2.1大鼠动情周期观测结果NC组10只大鼠均保持规律的4d动情周期的阴道涂片变化,排卵率100%。DHEA组动情周期均出现紊乱,见大量角化上皮细胞,排卵率0%。
2.2大体解剖学及镜下改变NC组卵巢色泽红润,DHEA组卵巢表面偏白,体积增大,隐约见多个囊状扩张的卵泡。DHEA组HE染色后光镜下见多个囊性扩张的卵泡,卵泡体积异常增大,见闭锁卵泡,卵泡膜细胞细胞层局部凹凸不平,颗粒细胞层几乎消失不见,卵泡内充满大量的卵泡液;黄体中多见粒黄体细胞肿胀,胞质内大量圆形空泡,间质中少量淋巴细胞浸润。见图1(插页)。
2.3两组大鼠血清学指标比较见表1。
由表1可见,DHEA组血清T、TG、LDL水平高于NC组(均P<0.05)。两组血清FSH、LH、TC、HDL、FPG、FINS、HOMA-IR水平差异均无统计学意义(均P>0.05)。
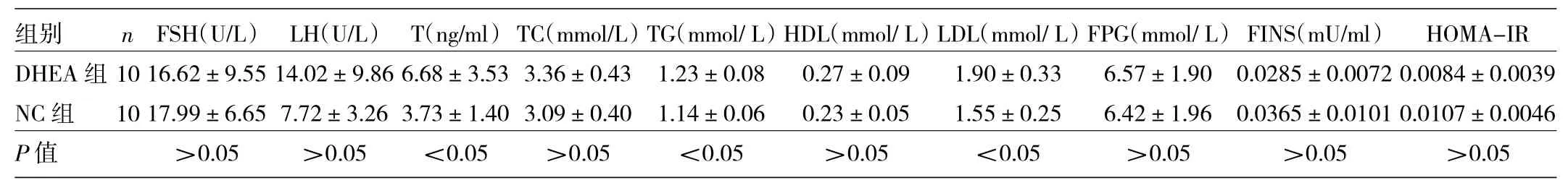
表1 两组大鼠血清学指标比较
2.4两组大鼠卵巢组织免疫组化染色结果SIRT1、FoxO3a阳性染色细胞在两组卵巢组织中均可见,染色呈浅黄色至深棕色,见图2(插页)。平均光密度值定量分析结果可见DHEA组卵巢SIRT1表达明显增加(P<0.01),FoxO3a表达水平呈升高趋势,但与NC组比较差异无统计学意义(P>0.05),详见表2。

表2 两组大鼠卵巢组织SIRT1、FoxO3a蛋白平均光密度值比较
2.5两组大鼠卵巢组织RT-PCR结果DHEA组大鼠卵巢SIRT1 mRNA 38.75±34.31、FoxO3a mRNA 1.45±0.31,显著高于NC组(3.46±2.93、0.82±0.15),差异均有统计学意义(均P<0.05),详见图3。
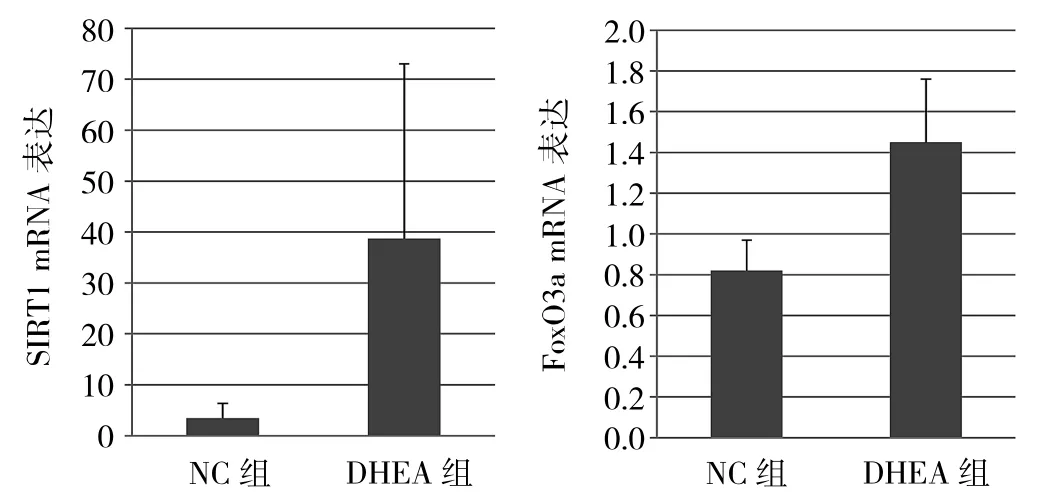
图3 两组大鼠卵巢组织SIRT1mRNA及FoxO3amRNA表达比较
3 讨论
3.1DHEA诱导PCOS大鼠模型的评价运用DHEA对SD大鼠进行PCOS造模是研究PCOS的经典造模方法[10]。本实验中,经DHEA皮下注射20d后,DHEA组大鼠动情周期全部失去规律性变化,提示大鼠无排卵。肉眼可见卵巢体积异常增大,隐约见多个囊状扩张的卵泡。镜下显示卵巢内多个囊性扩张的卵泡,卵泡体积异常增大,见闭锁卵泡,卵泡膜细胞细胞层局部凹凸不平,颗粒细胞层几乎消失不见,卵泡内充满大量的卵泡液;黄体中多见颗粒黄体细胞肿胀,胞质内大量圆形空泡,间质中少量淋巴细胞浸润。DHEA组大鼠血清T、TG、LDL水平明显增加。以上数据表明,本实验所复制的动物模型无论是从病理形态学变化,还是血清激素水平均与PCOS患者相似。说明PCOS大鼠模型制备成功。
3.2SIRT1与PCOS的关系SIRT1为Sirtuins家族成员之一,在感知细胞的能量状态中可能起着关键作用[11-13]。SIRT1通过去乙酰化多种蛋白(如组蛋白、转录因子等)修饰的赖氨酸残基,发挥对基因表达的调节作用。在这个过程中,来自乙酰化底物的乙酰基被转移到NAD的ADP-核糖部分,释放出2-O-乙酰-ADP-核糖[14],并由NAD+/NADH的比率变化控制SIRT1的活性。(1)SIRT1信号通路通过感知和调节细胞氧化还原状态,降低转录因子如NF-κB和AP-1的表达,降低组蛋白的乙酰化修饰水平来发挥抗炎作用[15-16],从而在体内外为暴露于氧化应激物的细胞和组织提供保护性作用。(2)雷帕霉素及其靶向因子mTOR可通过调节SIRT1信号抑制原始卵泡的发育,从而保留卵泡储备功能[17-18]。SIRT1被认为在与黄体相关的激素生成(大鼠颗粒细胞终末分化)的激活中起到了关键作用[19]。
对于PCOS患者,卵泡发育异常、脂肪代谢紊乱、机体的慢性轻度炎症状态,均提示SIRT1在PCOS的病理过程可能起到重要调控作用。Caglayan等[20]发现PCOS人群的血清SIRT1含量高于健康对照组,猜测这与PCOS人群普遍处于慢性轻度炎症状态相关。然而Tao等[21]在大鼠上却得到了相反的结论,他们认为PCOS大鼠卵巢组织SIRT1表达低于健康对照大鼠,且在二甲双胍治疗后SIRT1的表达上调。本研究显示,PCOS大鼠卵巢中SIRT1蛋白和mRNA水平与正常对照组大鼠相比明显增加。免疫组化显示,SIRT1在颗粒细胞及卵泡膜细胞中均有表达。在PCOS卵巢的形态学观察可见卵泡中卵泡膜细胞细胞层局部凹凸不平,颗粒细胞的层数及细胞数明显减少。因此,我们推测PCOS卵巢因暴露于氧化应激状态使得SIRT1信号通路反应性的增高,从而降低组蛋白的乙酰化修饰水平来发挥抗炎作用。SIRT1的过表达又通过对颗粒细胞、卵泡膜细胞的调控从而抑制卵泡正常发育。
本研究经ELISA测定DHEA组血清TG、LDL水平显著高于NC组,PCOS大鼠存在明显的脂代谢紊乱,提示卵巢SIRT1水平的增高可能与其循环脂质过氧化物的含量增加有关。目前研究普遍认为,PCOS患者脂代谢紊乱与慢性炎症是互为启动、互为因果的关系。白细胞和脂肪组织分泌的细胞因子作用于细胞,刺激机体产生炎症反应,脂肪组织中分泌一些炎症因子诱导巨噬细胞浸润到脂肪组织,导致机体炎症反应[22]。SIRT1保护性的升高,这也与Azza等[23]研究结果一致。
3.3FoxO3a与PCOS的关系FoxO(forkhead box O)转录因子是一类关键的自噬调控因子,以FoxO1、FoxO3的作用最为广泛。其活性主要受SIRT1的去乙酰化调节,在细胞自噬调控中具有重要作用[24]。目前未见FoxO3a对PCOS影响的相关报道。
虽然FoxO3a在大多数哺乳动物组织中高度表达,但在FoxO3a基因敲除后卵巢中观察到明显的紊乱,提示FoxO3a在卵巢功能中具有重要作用。猪卵巢的免疫组化实验表明,颗粒层中的FoxO3a染色比卵母细胞多,表明FoxO3a在颗粒细胞中具有更重要的作用[25]。这也与本研究的免疫组化结果一致。近年研究发现,在卵泡闭锁期间,猪颗粒细胞中FoxO3a的mRNA表达较高。采用TUNEL法和总FoxO3蛋白染色,发现FoxO3蛋白在闭锁卵泡颗粒层高表达。表明FoxO3a在颗粒细胞的凋亡中起到调控作用[25]。本研究显示,PCOS大鼠卵巢中FoxO3a蛋白和mRNA水平与正常对照组大鼠相比明显增加。我们推测FoxO3a的激活诱导颗粒细胞凋亡,进一步导致卵泡闭锁。这是PCOS重要的病理过程,提示其在PCOS的病理发展中起到重要调控作用。而这一作用又受到SIRT1的调节。
综上所述,SIRT1/FoxO3a信号通路在PCOS模型大鼠的病理过程中可能通过调节颗粒细胞发挥作用,这可能与患者体内慢性轻度炎症相关。本研究将为进一步探讨PCOS的发病机制提供一定的理论基础,最终机制有待细胞实验确定。
[1]Fauser BC,Tarlatzis BC,Rebar RW,et al.Consensus on women's health aspects of polycystic ovary syndrome(PCOS):the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group[J].Fertil Steril,2012,97(1):28-38.
[2]楼向明,刘文华,汤珊珊,等.NLR、hs-CRP、MPV与肥胖、非肥胖型PCOS的关系[J].浙江医学,2016,38(4):248-251.
[3]Kelly CC,Lyall H,Petrie JR,et al.Low grade chronic inflammation in women with polycystic ovarian syndrome[J].The Journal of clinical endocrinology and metabolism,2001,86(6):2453-2455.
[4]Zhang R,Liu H,Bai H,et al.Oxidative stress status in Chinese women with different clinical phenotypes of polycystic ovary syndrome[J].Clin Endocrinol(Oxf),2017,86(1):88-96.
[5]Schug TT,Xu Q,Gao H,et al.Myeloid deletion of SIRT1 induces inflammatory signaling in response to environmental stress[J].Molecular and cellular biology,2010,30(19):4712-4721.
[6]Meng X,Tan J,Li M,et al.Sirt1:role under the condition of ischemia/hypoxia[J].Cell Mol Neurobiol,2017,37(1):17-28.
[7]张红艳,岑加萍,刘元伟,等.雌激素上调SIRT1抗衰老机制研究进展[J].国际妇产科学杂志,2015,42(2):180-182.
[8]Bordone L,Cohen D,Robinson A,et al.SIRT1 transgenic mice show phenotypes resembling calorie restriction[J].Aging cell,2007,6(6):759-767.
[9]Coussens M,Maresh JG,Yanagimachi R,et al.Sirt1 deficiency attenuates spermatogenesis and germ cell function[J].PLoS one,2008,3(2):e1571.
[10]Seifert EL,Caron AZ,Morin K,et al.SirT1 catalytic activity is required for male fertility and metabolic homeostasis in mice[J].FASEB journal:official publication of the Federation of American Societies for Experimental Biology,2012,26(2):555-566.
[11]Carafa V,Rotili D,Forgione M,et al.Sirtuin functions and modulation:from chemistry to the clinic[J].Clin Epigenetic,2016,8:61.
[12]Houtkooper RH,Canto C,Wanders RJ,et al.The secret life of NAD+:an old metabolite controlling new metabolic signaling pathways[J].Endocrine reviews,2010,31(2):194-223.
[13]Canto C,Auwerx J.Targeting sirtuin 1 to improve metabolism:all you need is NAD(+)?[J].Pharmacological reviews,2012,64(1):166-187.
[14]Verdin E.The many faces of sirtuins:Coupling of NAD metabolism,sirtuins and lifespan[J].Nature medicine,2014,20(1):25-27.
[15]Lin QQ,Yan CF,Lin R,et al.SIRT1 regulates TNF-alpha-induced expression of CD40 in 3T3-L1 adipocytes via NF-kappaB pathway[J].Cytokine,2012,60(2):447-455.
[16]Matsushita T,Sasaki H,Takayama K,et al.The overexpression of SIRT1 inhibited osteoarthritic gene expression changes induced by interleukin-1beta in human chondrocytes[J].Journal of orthopaedic research:official publication of the Orthopaedic Research Society,2013,31(4):531-537.
[17]Luo LL,Chen XC,Fu YC,et al.The effects of caloric restriction and a high-fat diet on ovarian lifespan and the expression of SIRT1 and SIRT6 proteins in rats[J].Aging clinical and experimental research,2012,24(2):125-133.
[18]Zhang XM,Li L,Xu JJ,et al.Rapamycin preserves the follicle pool reserve and prolongs the ovarian lifespan of female rats via modulating mTOR activation and sirtuin expression[J].Gene,2013,523(1):82-87.
[19]Morita Y,Wada-Hiraike O,Yano T,et al.Resveratrol promotes expression of SIRT1 and StAR in rat ovarian granulosa cells:an implicative role of SIRT1 in the ovary[J].Reproductive biology and endocrinology:RB&E,2012,10:14.
[20]Kiyak Caglayan E,Engin-Ustun Y,Gocmen AY,et al.Serum sirtuin 1 levels in patients with polycystic ovary syndrome[J].Journal of obstetrics and gynaecology:the journal of the Institute of Obstetrics and Gynaecology,2015,35(6):608-611.
[21]Tao X,Zhang X,Ge SQ,et al.Expression of SIRT1 in the ovaries of rats with polycystic ovary syndrome before and after therapeutic intervention with exenatide[J].International journal of clinical and experimental pathology,2015,8(7):8276-8283.
[22]王秋毅,冯桂梅,王薇,等.青春期和育龄期多囊卵巢综合征的临床生化特征分析比[J].现代妇产科进展,2013,8(8):647-650.
[23]Abd Elwahab AH,Ramadan BK,Schaalan MF,et al.A Novel Role of SIRT1/FGF-21 in Taurine Protection Against Cafeteria Diet-Induced Steatohepatitis in Rats[J].Cellular physiology and biochemistry:international journal of experimental cellular physiology,biochemistry,and pharmacology,2017,43(2):644-659.
[24]Ferdous A,Battiprolu PK,Ni YG,et al.FoxO,autophagy,and cardiac remodeling[J].Journal of cardiovascular translational research,2010,3(4):355-364.
[25]Pelosi E,Omari S,Michel M,et al.Constitutively active Foxo3 in oocytes preserves ovarian reserve in mice[J].Nat Commun,2013,4:1843.

