IRF3调控瘢痕疙瘩成纤维细胞增殖和细胞外基质表达的研究
张谊 洪炜龙 徐云升 李智铭 张璃 林孝华 张启瑜
瘢痕疙瘩是以成纤维细胞过度增殖和细胞外基质过度沉积为主要特征的皮肤纤维增生性疾病[1]。瘢痕疙瘩可导致肢体功能障碍并破坏容貌,影响患者生理、心理健康。目前发现转化生长因子β1(TGF-β1)是最强的促纤维化细胞因子,可促进胶原合成、成纤维细胞向肌成纤维细胞分化,加剧瘢痕疙瘩的形成[2]。因此,抑制TGF-β1信号通路是治疗瘢痕疙瘩的新思路。干扰素调节因子(IRFs)是一类在IFN信号通路中起重要调控作用的多功能转录因子,它们在IFN的诱导、病毒防御、免疫调节、细胞分化、细胞生长与凋亡中起重要作用[3-5]。IRF3是IRF家族的一员,研究发现IRF3在纤维化过程中起重要调节作用[6-7]。Ni等[8]报道下调IRF3表达可显著抑制TGF-β1诱导的肝星状细胞(HSCs)增殖,诱导其凋亡,并且降低HSCs的细胞外基质Ⅰ型胶原蛋白(collagenⅠ)和a-平滑肌肌动蛋白(a-SMA)的表达水平。基于此,本研究通过观察IRF3对瘢痕疙瘩成纤维细胞的增殖和细胞外基质表达的作用,探讨IRF3在皮肤纤维化中的调控机制,现报道如下。
1 对象和方法
1.1对象选取2013年8月至2016年5月在本院行瘢痕疙瘩切除手术的患者10例,其中男7例,女3例;年龄17~61岁,中位年龄45岁。所有患者均无激素、中药、放化疗等病史,留取其术中切除的瘢痕疙瘩组织,另择8例外科手术患者的正常皮肤组织为对照,标本迅速用液氮冷冻保存备用。组织标本均由病理科医师明确诊断。本研究经医院医学伦理委员会批准,患者及家属知情同意并签署知情同意书。
1.2方法
1.2.1主要试剂10%FBS(美国Gibco公司),100 U/ml青霉素、0.1g/ml链霉素(美国Sigma公司),IRF3靶向siRNAs(siRNAs-IRF3)、阴性对照siRNA(scramble)(广州市锐博生物科技有限公司合成),LipofectamineTM2000、SYBR Green超混合液(美国Invitrogen公司),人重组TGF-β1(10ng/ml,美国Sigma公司),iScript cDNA合成试剂盒、全自动定量绘图酶标仪(美国Bio-Rad公司),Favorgen RNA提取试剂盒(台湾惠晶生物科技),ABI Prism 7500型荧光定量PCR仪(美国Applied Biosystems公司),anti-IRF3、anti-typeⅠcollagen、antia-SMA、anti-TGF-β receptorⅠ(TGF-β RⅠ)、anti-TGF-β RⅡ、anti-p-Smad2、anti-Smad2、anti-p-Smad3、anti-p-Smad3、anti-GAPDH、辣根过氧化物酶标记多克隆羊抗兔二抗(美国Santa Cruz公司),增强化学发光试剂盒(英国Amersham公司)。
1.2.2成纤维细胞培养方法如下:用含10%FBS、100 U/ml青霉素和0.1 g/ml链霉素的DMEM培养液,37℃、5%二氧化碳、100%湿度条件下培养组织。以等体积含10%FBS的LG-DMEM培养液终止消化,过滤,1 200rpm离心10min,弃去上清液,获得组织细胞团,高糖培养液重悬,以4×104个/cm2密度接种于直径10cm培养皿,37℃、5%二氧化碳、100%湿度条件下培养,24h后第1次换液,以后隔日换1次,待细胞长成单层后消化传代,取第2、3代细胞用于实验。
1.2.3瘢痕疙瘩成纤维细胞转染siRNAs-IRF3IRF3靶向siRNAs序列:siRNA1:5′-GGAGUGAUGAGCUACGUGA-3′,siRNA2:5′-CCCUUCAUUGUAGAUCUGATT-3′。用脂质体法为瘢痕疙瘩成纤维细胞转染siRNAs-IRF3和scramble,严格按照说明书操作,转染48h后加入人重组TGF-β1(10ng/ml)培养24h,并分成control组(空白对照组)、TGF-β1组、TGF-β1+scramble组、TGF-β1+siRNA1-IRF3组和TGF-β1+siRNA2-IRF3组。
1.2.4瘢痕疙瘩成纤维细胞增殖能力检测应用WST-1细胞增殖及细胞毒性检测试剂盒检测各组瘢痕疙瘩成纤维细胞增殖情况。将待检测细胞按1×104/孔密度种在96孔板上,每孔设3个复孔,培养24h后,每孔加入10μl WST-1底物,37℃孵育3h后,用全自动定量绘图酶标仪在570nm波长处测定各孔的吸光度值(OD570nm),OD570nm越高代表增殖能力越强。
1.2.5real-time RT-PCR检测IRF3 mRNA表达水平用Favorgen RNA提取试剂盒提取总RNA,严格按照说明书操作。取总RNA 3μg用iScript cDNA合成试剂盒,通过逆转录反应获得cDNA,模板cDNA于-20℃冰箱保存。采用SYBR Green超混合液。应用ABI Prism 7500型荧光定量PCR仪进行RT-PCR。IRF3上游引物5′-AGAGGCTCGTGATGGTCAAGGTT-3′,下游引物5′-AGAGTGGGTGGCTGTTGGAAATG-3′。β-actin上游引物5′-GATCATTGCTCCTCCTGAGC-3′,下游引物5′-ACTCCTGCTTGCT-GATCCAC-3′。每个标本设3个复孔,结果采用2-ΔΔCt法进行计算,计算IRF3/β-actin比值。
1.2.6Western blot检测IRF3、细胞外基质、TGF-β受体、TGF-β1信号通路调节蛋白表达水平按蛋白裂解液说明书提取总蛋白,用BCA蛋白浓度测定试剂盒测定样品浓度后,取20μg蛋白质上样,加十二烷基硫酸钠缓冲液煮沸5min,进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,冰浴条件下100V恒压转膜2h,5%脱脂牛奶室温封闭1h,加一抗及内参蛋白一抗4℃孵育过夜(anti-IRF3,anti-typeⅠcollagen,anti-a-SMA,anti-TGF-β RⅠ,anti-TGF-β RⅡ,anti-p-Smad2,anti-Smad2,anti-p-Smad3,anti-p-Smad3和anti-GAPDH),扩增后用含有Tween 20 PBS冲洗3次,每次15min,辣根过氧化物酶标记多克隆羊抗兔二抗。室温孵育1h。然后用含有Tween 20的PBS冲洗3次,每次15min,应用增强化学发光试剂盒,将膜置于发光液中反应,于凝胶成像系统中曝光并采集图像,采用iGel-Pro Analyzer v4.0.分别获取蛋白质信号条带图像,进行信号分析,collagenⅠ、a-SMA、TGF-β受体Ⅰ(TGF-β RⅠ)、TGF-β受体Ⅱ(TGF-β RⅡ)及TGF-β1信号通路调节蛋白p-Smad2、Smad2、p-Smad3、Smad3蛋白条带的灰度值与内参β-actin条带的灰度值之比即为蛋白相对表达水平。
1.3观察指标(1)比较瘢痕疙瘩与正常皮肤成纤维细胞IRF3 mRNA、蛋白表达水平;(2)观察转染siRNAs-IRF3后瘢痕疙瘩成纤维细胞IRF3蛋白表达变化;(3)比较TGF-β1组、TGF-β1+scramble组、TGF-β1+siRNA1-IRF3组、TGF-β1+siRNA2-IRF3组及空白对照组瘢痕疙瘩成纤维细胞增殖能力;(4)比较4组瘢痕疙瘩成纤维细胞collagenⅠ、a-SMA表达水平;(5)比较4组瘢痕疙瘩成纤维细胞TGF-β RⅠ、TGF-β RⅡ表达水平;(6)比较4组瘢痕疙瘩成纤维细胞p-Smad2、Smad2、p-Smad3、Smad3表达水平。
1.4统计学处理应用SPSS18.0统计软件;计量资料以表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1瘢痕疙瘩与正常皮肤成纤维细胞IRF3 mRNA、蛋白表达水平比较见图1。
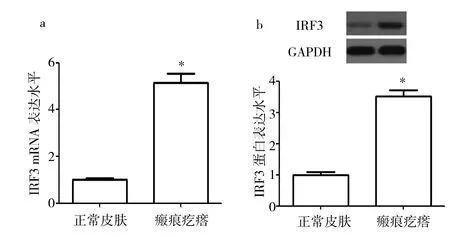
图1 瘢痕疙瘩与正常皮肤成纤维细胞IRF3 mRNA、蛋白表达水平比较(a:mRNA表达水平;b:蛋白表达水平;与正常皮肤比较,*P<0.05)
由图1可见,瘢痕疙瘩成纤维细胞IRF3 mRNA、蛋白表达水平分别为5.140±0.387、3.373±0.179,正常皮肤成纤维细胞IRF3 mRNA、蛋白表达水平分别为1.002±0.056、1.000±0.087。瘢痕疙瘩成纤维细胞mRNA、蛋白表达水平均高于正常皮肤成纤维细胞(均P<0.05)。
2.2转染siRNAs-IRF3后瘢痕疙瘩成纤维细胞IRF3蛋白表达变化见图2。
由图2可见,转染siRNA1-IRF3、siRNA2-IRF3后,瘢痕疙瘩成纤维细胞IRF3蛋白表达水平分别为0.326±0.043、0.443±0.038,与阴性对照比较明显下调(均P<0.05)。

图2 转染siRNAs-IRF3后瘢痕疙瘩成纤维细胞IRF3蛋白表达变化(与转染scramble比较,*P<0.05)
2.34组瘢痕疙瘩成纤维细胞增殖能力比较见图3。
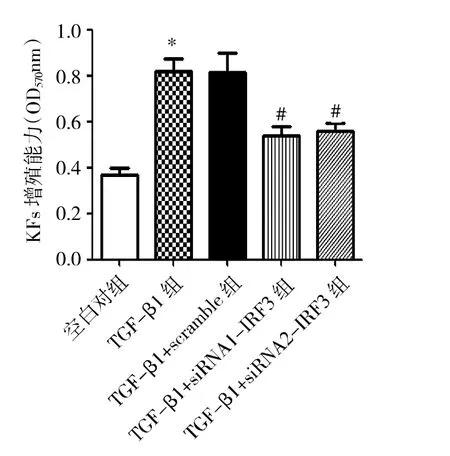
图3 4组瘢痕疙瘩成纤维细胞增殖能力比较(与空白对照组比较,*P<0.05;与TGF-β1+scramble组比较,#P<0.05)
由图3可见,TGF-β1组瘢痕疙瘩成纤维细胞吸光度值为0.820±0.056,空白对照组为0.370±0.026,TGF-β1明显增强瘢痕疙瘩成纤维细胞增殖能力,两组比较差异有统计学意义(P<0.05)。TGF-β1+scramble组瘢痕疙瘩成纤维细胞吸光度值为0.787±0.058,TGF-β1+siRNA1-IRF3组、TGF-β1+siRNA2-IRF3组分别0.540±0.036、0.560±0.032,与TGF-β1+scramble组比较,TGF-β1+siRNA1-IRF3组、TGF-β1+siRNA2-IRF3组瘢痕疙瘩成纤维细胞增殖能力均明显下降,差异有统计学意义(均P<0.05)。
2.44组瘢痕疙瘩成纤维细胞collagen I、a-SMA表达水平比较见图4。
由图4可见,TGF-β1组collagen I、a-SMA表达水平为3.763±0.329、2.763±0.277,空白对照组为1.000±0.029、1.000±0.023,TGF-β1组collagen I、a-SMA表达水平均高于空白对照组(均P<0.05)。TGF-β1+siRNA1-IRF3 collagen I、a-SMA表达水平为2.287±0.271、1.547±0.147组,TGF-β1+siRNA2-IRF3组为2.477±0.314、1.817±0.168,TGF-β1+scramble组为3.760±0.296、2.760±0.238,TGF-β1+siRNA1-IRF3组、TGF-β1+siRNA2-IRF3组collagen I、a-SMA表达水平均低于TGF-β1+scramble组(均P<0.05)。
2.54组瘢痕疙瘩成纤维细胞TGF-β RⅠ、TGF-β RⅡ表达水平比较见图5。
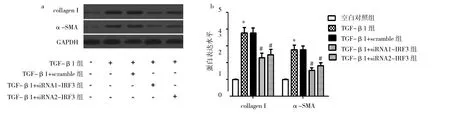
图4 4组瘢痕疙瘩成纤维细胞collagen I、a-SMA表达水平比较(a:蛋白电泳图;b:蛋白定量分析;与空白对照组比较,*P<0.05;与TGF-β1+scramble组比较,#P<0.05)
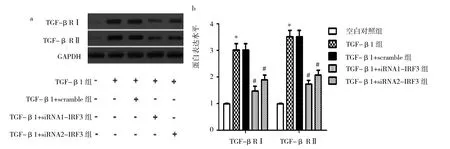
图5 4组瘢痕疙瘩成纤维细胞TGF-β RI、TGF-β RII表达水平比较(a:蛋白电泳图;b:蛋白定量分析;与空白对照组比较,*P<0.05;与TGF-β1+scramble组比较,#P<0.05)
由图5可见,TGF-β1组TGF-β RⅠ、TGF-β RⅡ表达水平为3.013±0.244、3.520±0.236,空白对照组为1.000±0.012、1.000±0.023,TGF-β1组TGF-β RⅠ、TGF-β RⅡ表达水平均高于空白对照组(均P<0.05)。TGF-β1+siRNA1-IRF3组TGF-β RⅠ、TGF-β RⅡ表达水平为1.473±0.171、1.733±0.141,TGF-β1+siRNA2-IRF3组为1.890.±0.178、2.070±0.180,TGF-β1+scramble组为3.020±0.234、3.520±0.229,TGF-β1+siRNA1-IRF3组、TGF-β1+siRNA2-IRF3组TGF-β RⅠ、TGF-β RⅡ表达水平均低于TGF-β1+scramble组(均P<0.05)。2.64组瘢痕疙瘩成纤维细胞p-Smad2、Smad2、p-Smad3、Smad3表达水平比较见图6。
由图6可见,TGF-β1组p-Smad2、Smad2、p-Smad3、Smad3表达水平均高于空白对照组(均P<0.05)。TGF-β1+siRNA1-IRF3组、TGF-β1+siRNA2-IRF3组p-Smad2、Smad2、p-Smad3、Smad3表达水平均低于TGF-β1+scramble组(均P<0.05)。
3 讨论
本研究结果显示,IRF3在瘢痕疙瘩成纤维细胞中表达显著上调,下调IRF3可显著抑制瘢痕疙瘩成纤维细胞增殖,并抑制collagenⅠ、a-SMA、TGF-β RⅠ、TGF-β RⅡ在TGF-β1诱导的瘢痕疙瘩成纤维细胞中表达,且还抑制了TGF-β1诱导的瘢痕疙瘩成纤维细胞Smad2、Smad3的磷酸化水平。有研究报道称,IRF3参与心肌纤维化的调控,在血管紧张素Ⅱ灌注的大鼠模型中沉默IRF3可显著抑制心肌纤维化进程,并且减少左心室舒张末期内径[10]。本研究结果发现,瘢痕疙瘩成纤维细胞IRF3 mRNA、蛋白的表达水平均较正常组织显著上调。这提示IRF3可能是瘢痕疙瘩形成的生物标记物。
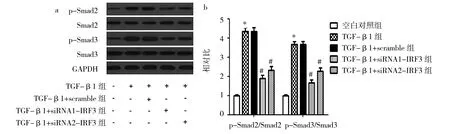
图6 4组瘢痕疙瘩成纤维细胞p-Smad2、Smad2、p-Smad3、Smad3表达水平比较(a:蛋白电泳图;b:蛋白定量分析;与空白对照组比较,*P<0.05;与TGF-β1+scramble组比较,#P<0.05)
瘢痕疙瘩是病理性纤维增殖紊乱,其病理学特征是成纤维细胞过度增生和细胞外基质过度沉积。瘢痕疙瘩成纤维细胞增殖受多种细胞因子的调控,包括TGF-β1[8]。大量研究证实,在瘢痕疙瘩形成过程中,TGF-β1促进了瘢痕疙瘩成纤维细胞增殖[9-10]。本研究也发现TGF-β1显著促进了瘢痕疙瘩成纤维细胞增殖,与以往报道一致。下调IRF3的表达显著抑制了TGF-β1诱导的瘢痕疙瘩成纤维细胞增殖。在瘢痕疙瘩进程中,大量的成纤维细胞增生促进了胶原的分泌并导致大量的胶原沉积[11]。本研究也发现,下调IRF3的表达显著抑制了TGF-β1诱导的瘢痕疙瘩成纤维细胞collagen I、a-SMA的表达。上述结果表明,siRNAs-IRF3通过降低瘢痕疙瘩成纤维细胞增殖和细胞外基质的表达,在瘢痕疙瘩成纤维细胞中发挥抑制作用。
Smads蛋白在TGF-β信号通路对瘢痕疙瘩的形成中发挥重要作用[12-13]。有研究报道,瘢痕疙瘩成纤维细胞中TGF-β RⅠ、TGF-βRⅡ的表达水平较正常皮肤成纤维细胞显著升高[14]。本研究同样发现TGF-β1诱导的瘢痕疙瘩成纤维细胞TGF-β RⅠ、TGF-β RⅡ的表达水平显著上调。而下调IRF3的表达后,显著抑制了TGF-β1诱导的瘢痕疙瘩成纤维细胞TGF-β RⅠ、TGF-β RⅡ的表达。在Smads家族中,Smad3在TGF-β1的作用下介导真皮成纤维细胞胶原蛋白合成,抑制Smad3在瘢痕疙瘩成纤维细胞中的表达,导致Ⅰ、Ⅲ型前胶原的表达现在下降[15]。本研究结果显示,TGF-β1显著增强了瘢痕疙瘩成纤维细胞Smad2、Smad3的磷酸化水平,而下调IRF3显著抑制了瘢痕疙瘩成纤维细胞Smad2、Smad3磷酸化水平。
综上所述,IRF3表达下调通过抑制TGF-β1/Smad信号传导通路,抑制瘢痕疙瘩成纤维细胞增殖和细胞外基质的表达。这提示IRF3或为治疗瘢痕疙瘩新的靶点。
[1]Tan J,He W,Luo G,et al.Involvement of impaired desmosome related proteins in hypertrophic scar intraepidermal blister formation[J].Burns,2015,41(7):1517-1523.
[2]Hahn JM,McFarland KL,Combs KA,et al.Partial epithelial-mesenchymal transition in keloid scars:regulation of keloid keratinocyte gene expression by transforming growth factor-β1[J].Burns Trauma,2016,4(1):30.
[3]Tian WL,Jiang ZX,Wang F,et al.IRF3 is involved in human acute myeloid leukemia through regulating the expression of miR-155[J].Biochem Biophys Res Commun,2016,478(3):1130-1135.
[4]Guinn Z,Lampe AT,Brown DM,et al.Significant role for IRF3 in both T cell and APC effector functions during T cell responses[J].Cell Immunol,2016,310(12):141-149.
[5]Kumari M,Wang X,Lantier L,et al.IRF3 promotes adipose inflammation and insulin resistance and represses browning[J].J Clin Invest,2016,126(8):2839-2854.
[6]Tsushima K,Osawa T,Yanai H,et al.IRF3 regulates cardiac fibrosis but not hypertrophy in mice during angiotensin II-induced hypertension[J].FASEB J,2011,25(5):1531-1543.
[7]Sangbrita S,Chattoraj SG,Andrea Faris,et al.Pseudomonas aeruginosa suppresses interferon response to rhinovirus infection in cystic fibrosis but not in normal bronchial epithelial cells[J].Infect&Immun,2011,79(10):4131-4145.
[8]Ni MM,Xu T,Wang YR,et al.Inhibition of IRF3 expression reduces TGF-β1-induced proliferation of hepatic stellate cells[J].J Physiol Biochem,2015,72(1):9-23.
[9]Lin L,Wang Y,Liu W,et al.BAMBI inhibits skin fibrosis in keloid through suppressing TGF-b1-induced hypernomic fibroblast cell proliferation and excessive accumulation of collagen I[J].Int J Clin Exp Med,2015,8(8):13227-13234.
[10]Liu Y,Li Y,Li N,et al.TGF-β1 promotes scar fibroblasts proliferation and transdifferentiation via up-regulating MicroRNA-21[J].Sci Rep,2016,6(6):32231.
[11]Muthusubramaniam L,Zaitseva T,Paukshto M,et al.Effect of collagen nanotopography on keloid fibroblast proliferation and matrix synthesis:implications for dermal wound healing[J].Tissue Eng Part A,2014,20(10):2728-2736.
[12]He S,Liu X,Yang Y,et al.Mechanisms of transforming growth factor β1/Smad signalling mediated by mitogen-activated protein kinase pathways in keloid fibroblasts[J].Br J Dermatol,2010,162(3):538-546.
[13]Zhang GY,Yu Q,Cheng T,et al.Role of caveolin-1 in the pathogenesis of tissue fibrosis by keloid-derived fibroblasts in vitro[J].Br J Dermatol,2011,164(3):623-627.
[14]Tang B,Zhu B,Liang Y,et al.Asiaticoside suppresses collagen expression andTGF-β/Smadsignalingthroughinducing Smad7 and inhibiting TGF-βRI and TGF-βRII in keloid fibroblasts[J].Arch Dermatol Res,2011,303(8):563-572.
[15]Cho JW,Il KJ,Lee KS.Downregulation of type I collagen expression in silibinin-treated human skin fibroblasts by blocking the activation of Smad2/3-dependent signaling pathways:potential therapeutic use in the chemoprevention of keloids[J].InternationalJournalofMolecularMedicine,2013,31(5):1148-1152.

