CD44和NANOG在上皮性卵巢癌中的表达及其临床意义*
侯小满,林雪艳,田永杰
(山东大学附属省立医院妇科,山东 济南 250021)
上皮性卵巢癌(epithelial ovarian cancer,EOC)是妇科最常见的恶性肿瘤之一,死亡率居妇科恶性肿瘤首位。由于大部分患者确诊时已进展至晚期,且极易发生化疗耐药,导致其五年生存率始终徘徊在30%~40%。“肿瘤干细胞(cancer stem cells,CSCs)学说”认为,在肿瘤实质中,存在小部分具有干细胞特性的细胞,同时具备自我更新和分化的能力,并介导肿瘤化疗耐药和复发[1]。CD44家族是一类跨膜糖蛋白,同属于细胞黏附受体,参与细胞生长、分化和迁移等生物学过程[2],因其特殊的生物学功能,诸多研究将CD44分子作为分离和鉴定CSCs的表面标记物[3]。NANOG作为核转录因子,于多能胚胎干细胞高表达,极少在成体组织中表达,除外“干性”维持,NANOG在肿瘤生发中的作用亦受到越来越多的关注[4]。目前,对上皮性卵巢癌中CD44和NANOG关系的研究不多见,本研究拟通过免疫组织化学法来检测CD44和NANOG在上皮性卵巢癌组织中的表达并探讨其临床意义,为分离鉴定卵巢癌肿瘤干细胞提供理论依据;同时利用Western blot法检测经不同浓度顺铂(cisplatin)处理后的卵巢癌SKOV3细胞中CD44和NANOG蛋白表达水平的变化,探讨化疗对肿瘤干细胞相关基因表达的影响。
材 料 和 方 法
1 组织标本
收集2013年1月~2015年12月于山东大学附属省立医院妇科住院患者的手术切除组织标本,其中EOC组织标本75例(含65例卵巢浆液性囊腺癌,4例卵巢黏液性囊腺癌,3例卵巢子宫内膜样腺癌和3例卵巢透明细胞癌),良性卵巢肿瘤组织标本40例(含16例卵巢浆液性囊腺瘤及24例卵巢黏液性囊腺瘤),相关石蜡切片由山东大学附属省立医院病理科提供并完成病理鉴定。
1.1患者纳入标准EOC组系术后病理确诊为EOC的患者,全部患者均为初次手术,且术前未接受过放、化疗和肿瘤免疫治疗;良性卵巢肿瘤组,即对照(control)组系因卵巢浆液性或黏液性囊腺瘤行卵巢肿瘤切除术的患者,患者术前近6个月未服用过雌、孕激素类药物;所有标本的获取均已征得患者同意及山东大学附属省立医院伦理委员会的许可。
1.2排除标准同时合并有其它恶性肿瘤的患者。
2 细胞培养
人卵巢癌细胞SKOV3购自中国科学院细胞库,采用含10%胎牛血清的McCoy’s 5A培养基,于37 ℃、5% CO2及饱和湿度的培养箱中常规培养,取对数生长期细胞进行实验。
3 主要试剂
兔抗人CD44单克隆抗体、兔抗人NANOG单克隆抗体和兔抗人β-tubulin多克隆抗体均购自Abcam;免疫组化试剂盒、DAB和辣根过氧化物酶标记的山羊抗兔IgG II 抗均购自北京中杉金桥生物科技有限公司;胎牛血清购自BI;Maccoy’s 5A培养基购自Macgene;顺铂购自Sigma。
4 主要方法
4.1免疫组织化学法检测CD44及NANOG的蛋白表达各手术切除标本分别经甲醛固定和石蜡包埋后制成4 μm的连续切片备用。应用免疫组化SP法对实验标本进行分批染色,以PBS代替 I 抗作为阴性对照,具体操作步骤严格遵照免疫组化SP试剂盒说明书进行。
4.2结果判定在光镜下随机观察5个高倍镜视野,按每高倍镜视野中出现阳性染色细胞所占百分比进行计分:阳性染色细胞数<5%计0分,5%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分;观察阳性细胞染色强度,染色呈淡黄色计为1分,棕黄色计为2分,棕褐色者计为3分。5个视野中阳性细胞百分比计分的平均值与染色强度计分平均值的乘积即为最终阳性强度评分:0~1分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(++),>5分为强阳性(+++)。全部免疫组化结果由2名有经验的病理科医师采用双盲法阅片评分。
4.3Western blot法检测顺铂对SKOV3细胞中CD44及NANOG蛋白表达的影响SKOV3细胞分别以浓度为0、1、2和4 mg/L的顺铂处理24 h后进行细胞总蛋白提取和定量。全部蛋白样本按等质量上样,行10% SDS-PAGE分离目的蛋白后转至PVDF膜,以5%脱脂牛奶室温封闭1 h,TBST洗膜3次后分别加入抗CD44(1:2 000)、NANOG(1:2 000)和β-tubulin(1:500) I 抗,4 ℃摇床孵育过夜。次日TBST洗膜3次后加入辣根过氧化物酶标记的山羊抗兔IgG II 抗,室温孵育1 h,TBST洗膜3次后显影。本实验重复3次,应用Image J软件分析目的蛋白与相应内参照蛋白条带的灰度值比值。
5 统计学处理
应用SPSS 19.0软件做统计学处理,计量资料均以均数±标准差(mean±SD)表示,均数间差异应用单因素方差分析进行比较;率之间的比较采用2检验,应用Spearman相关分析计算指标间的相关系数;以P<0.05为差异有统计学意义。
结 果
1 CD44和NANOG在上皮性卵巢癌和良性卵巢肿瘤组织中的表达
CD44阳性染色位于胞膜,NANOG阳性染色主要位于胞核,部分位于胞浆。CD44在EOC中的阳性表达率为66.7%(50/75),显著高于良性卵巢肿瘤组织中的阳性表达率[17.5 %(7/40)](P<0.01);NANOG在EOC中的阳性表达率为70.7 %(53/75),显著高于良性卵巢肿瘤组织的阳性表达率[25.0 %(10/40)](P<0.01),见图1、表1。

Figure 1.The results of immunohistochemical assay (SP,×400).A:positive expression of CD44 in EOC; B:negative expression of CD44 in benign ovarian tumor; C:positive expression of NANOG in EOC; D:negative expression of NANOG in benign ovarian tumor.
图1CD44和NANOG在上皮性卵巢癌和良性卵巢肿瘤中的表达及定位

表1 CD44和NANOG在上皮性卵巢癌和良性卵巢肿瘤组织中的阳性表达率Table 1.The positive expression rates of CD44 and NANOG in EOC and benign ovarian tumor (control) tissues
经Spearman相关分析发现,上皮性卵巢癌中CD44和NANOG的表达水平呈正相关,相关系数r=0.346(P<0.01),见表2;而在良性卵巢肿瘤组织中,CD44和NANOG的表达水平无显著相关性,相关系数r=0.167,见表3。
2 CD44和NANOG的表达与上皮性卵巢癌临床病理之间的关系
上皮性卵巢癌中,CD44在卵巢癌FIGO分期Ⅲ+Ⅳ组的阳性表达率高于FIGO分期Ⅰ+Ⅱ组(P<0.05),在淋巴结转移阳性组的阳性表达率高于淋巴结转移阴性组(P<0.05);而在不同年龄(≤50岁和>50岁)、EOC病理类型(浆液性和其它)、组织病理分级(G1+G2和G3)和肿瘤位置(单侧和双侧)组间的阳性表达率差异无统计学显著性。
NANOG在卵巢癌FIGO分期Ⅲ+Ⅳ组的阳性表达率高于FIGO分期Ⅰ+Ⅱ组(P<0.05),在组织病理分级G3组的阳性表达率高于G1+G2组(P<0.05);而在不同年龄(≤50岁和>50岁),EOC病理类型(浆液性和其它),有、无淋巴结转移和肿瘤位置(单侧和双侧)组间的阳性表达率差异无统计学显著性,见表4。

表2 上皮性卵巢癌中CD44和NANOG的表达水平Table 2.The expression of CD44 and NANOG in EOC

表3 良性卵巢肿瘤中CD44和NANOG的表达水平Table 3.The expression of CD44 and NANOG in benign ovarian tumor

表4 CD44和NANOG的表达与上皮性卵巢癌临床病理间的关系Table 4.The relationship between the expression of CD44,NANOG and clinical features of EOC
3 顺铂对SKOV3细胞中CD44及NANOG表达的影响
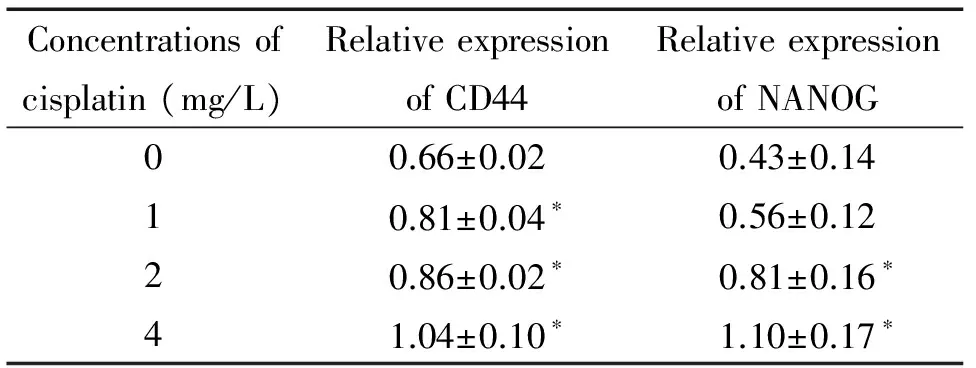
Western blot法检测卵巢癌SKOV3细胞总蛋白发现,顺铂可上调SKOV3细胞中CD44和NANOG的蛋白表达水平,见图2。顺铂作用24 h后,与对照组(0 mg/L)相比,药物浓度1、2和4 mg/L组的CD44表达量均有上调,且差异具有统计学显著性(P<0.05);药物浓度2和4 mg/L组与对照组相比,NANOG表达量亦升高,差异具有统计学显著性(P<0.05),见表5。

Figure 2.The expression of CD44 and NANOG in SKOV3 cells induced by cisplatin were detected by Western blot.
图2顺铂上调SKOV3细胞CD44和NANOG蛋白表达
表5顺铂诱导SKOV3细胞CD44和NANOG蛋白表达升高
Table 5.The expression of CD44 and NANOG in SKOV3 induced by cisplatin were detected by Western blot (Mean±SD.n=3)
Concentrationsofcisplatin(mg/L)RelativeexpressionofCD44RelativeexpressionofNANOG00.66±0.020.43±0.1410.81±0.04∗0.56±0.1220.86±0.02∗0.81±0.16∗41.04±0.10∗1.10±0.17∗
*P<0.05vs0 mg/L group.
讨 论
肿瘤干细胞学说认为,CSCs是一组具有干细胞特性的细胞亚群,其侵袭能力和对细胞毒性药物的耐受力明显高于其它肿瘤细胞[5]。1997年,Bonnet等[6]在白血病患者血液中分离出肿瘤干细胞。实验证实,在急性髓性白血病患者体内,仅有表面标记物CD34+CD38-的肿瘤细胞具有在免疫缺陷小鼠体内形成转移性白血病的能力,其它肿瘤细胞无法形成转移瘤,提示在全部白血病细胞中,只有CD34+CD38-细胞亚群同时具备自我更新和分化成为其它谱系肿瘤细胞的能力。随后,肿瘤干细胞的存在在乳腺癌、结肠癌、肺癌和肝癌等实体肿瘤中得到验证[5]。Zhang等[7]利用单克隆抗体标记细胞表面的CD44和CD117分子分选卵巢癌干细胞,进而发现CD44+CD117+细胞较其它亚群细胞高表达NANOG、OCT-4等多能性基因,且与CD44-CD117-细胞相比具有更强的致瘤能力。
CD44家族成员包括CD44标准型(CD44s)及多种变异型,其氨基末端的球状蛋白结合域包含一个具有锚定功能的模体,介导CD44分子与透明质酸(hyaluronic acid,HA)等细胞外基质成分以高亲和力结合;其羧基末端胞质尾区的模体可与胞内蛋白伴侣的磷酸化位点结合,从而触发下游的分子生物学反应[8]。近来研究表明,CD44与卵巢癌不良预后相关,并有可能直接参与卵巢癌化疗耐药。在转移性和复发性肿瘤中,CD44阳性表达率高于原发性肿瘤,且CD44的表达水平与患者无瘤生存时间和总生存率显著相关,CD44阳性的卵巢癌患者的无瘤生存期显著低于阴性患者[9]。诸多证据表明,CD44在卵巢癌肿瘤干细胞高表达,是介导卵巢癌细胞生存、生长和种植性转移的重要信号分子[2]。Du等[10]发现抗CD44的单克隆抗体A3D8可抑制卵巢癌SKOV3成球细胞增殖并促进其凋亡。
NANOG是维持胚胎干细胞自我更新和多向分化潜能的关键转录因子,正常情况下仅表达于早期胚胎和生殖干细胞,在完全分化的成体组织无表达[11]。NANOG分子的氨基端富含丝氨酸、苏氨酸和脯氨酸,可被磷酸化修饰,其羧基端具有转录激活作用。近年研究发现,NANOG在精原细胞瘤、乳腺癌、前列腺癌和视网膜母细胞瘤等恶性肿瘤中异常表达[12]。国外研究发现,卵巢癌组织中,NANOG在mRNA和蛋白水平均过表达,与肿瘤低分化显著相关,这一结论与本研究结果一致;敲除NANOG基因能够抑制卵巢癌细胞增殖、迁移和侵袭;反之,NANOG过表达可促进卵巢癌细胞迁移和侵袭;进一步分析发现,NANOG过表达与化疗耐药和不良预后相关,是影响卵巢癌患者整体生存率和无瘤生存期的独立预后因素[13]。
在乳腺癌MCF7细胞中,CD44与HA结合可激活蛋白激酶C,促进NANOG表达上调及其下游信号分子丝氨酸磷酸化,抑制抑癌基因PCD4表达,增强细胞成瘤能力,介导化疗耐药[14]。
Wiechert等[15]发现,转录因子OCT-4高表达与膀胱癌化疗耐药及复发显著相关,经顺铂处理后,膀胱癌TCCSUP及J82细胞中CD44和OCT-4的表达量同时出现上调。OCT-4与NANOG同属胚胎干细胞相关转录因子,Chiou等[16]研究指出,NANOG/OCT-4/SLUG三阳性的肺癌患者预后最差,反之,预后最好。Lu等[17]应用GFP在卵巢癌A2780细胞中标记NANOG后,发现GFP+细胞较GFP-细胞具有更强的顺铂耐药性;经顺铂处理后,GFP-细胞的荧光强度和NANOG表达量均有所增加,表明顺铂可诱导肿瘤细胞表达干性基因。
本研究发现,CD44在早期、无浸润转移的卵巢癌组织中低表达,在晚期、有浸润转移的卵巢癌组织中高表达,NANOG在早期及中、高分化的卵巢癌组织中低表达,在晚期、低分化的卵巢癌组织中高表达,且二者的表达水平呈正相关,提示随着卵巢癌FIGO分期级别和恶性程度的增加,CD44和NANOG表达增加,且具有协同性;顺铂可诱导卵巢癌细胞CD44和NANOG表达上调。由此推测,卵巢癌的进展过程伴随HA-CD44介导的干性基因表达激活,化疗亦可诱导肿瘤干细胞相关基因表达,肿瘤干细胞借此参与卵巢癌的发生和发展。
综上所述,CD44和NANOG参与EOC的发生和发展且与EOC不良预后有关。CSCs的产生及NANOG等干性基因表达与化疗直接相关,并贯穿EOC的恶性演进过程;因CD44与EOC浸润、转移等恶性生物学行为有关,HA-CD44信号通路可能介导NANOG的表达激活,将CD44分子作为分选卵巢癌CSCs的表面标志物具有其内在合理性。CD44联合NANOG有望成为划分EOC恶性程度和预后判断的新指标,亦有可能成为临床治疗的新靶标。
[参考文献]
[1]Garson K,Vanderhyden BC.Epithelial ovarian cancer stem cells:underlying complexity of a simple paradigm[J].Reproduction,2015,149 (2):R59-R70.
[2]Sacks JD,Barbolina MV.Expression and function of CD44 in epithelial ovarian carcinoma[J].Biomolecules,2015,5 (4):3051-3066.
[3]Zöller M.CD44:can a cancer-initiating cell profit from an abundantly expressed molecule?[J].Nat Rev Cancer,2011,11 (4):254-267.
[4]Cavaleri F,Scholer HR.Nanog:a new recruit to the embryonic stem cell orchestra[J].Cell,2003,113 (5):551-552.
[5]Visvader JE,Lindeman GJ.Cancer stem cells in solid tumours:accumulating evidence and unresolved questions[J].Nat Rev Cancer,2008,10 (8):755-768.
[6]Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive he-matopoietic cell[J].Nat Med,1997,3 (7):730-737.
[7]Zhang S,Balch C,Chan MW,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res,2008,68 (11):4311-4320.
[8]Revelante N,Gilmartin M.Regulation of and regulation by CD44:a paradigm complex regulatory network[J].Int Trends Immun,2013,6(4):43-58.
[9]Gao Y,Foster R,Yang X,et al.Up-regulation of CD44 in the development of metastasis,recurrence and drug resistance of ovarian cancer[J].Oncotarget,2015,6 (11):9313-9326.
[10] Du YR,Chen Y,Gao Y,et al.Effects and mechanisms of anti-CD44 monoclonal antibody A3D8 on proliferation and apoptosis of sphere-forming cells with stemness from human ovarian cancer[J].Int J Gynecol Cancer,2013,23 (8):136-1375.
[11] Loh YH,Wu Q,Chew JL,et al.The Oct4 and Nanog transcription network regulates pluripotency in mouse embryonic stem cells[J].Nat Genet,2006,38 (4):431-440.
[12] 周嘉嘉,陈汝福,邓小耿,等.沉默NANOG表达对人肝癌细胞HepG2中cyclin D1表达及细胞增殖的影响[J].中国病理生理杂志,2014,30 (2):245-249.
[13] Siu MK,Wong ES,Kong DS,et al.Stem cell transcription factor NANOG controls cell migration and invasion via dysregulation of E-cadherin and FoxJ1 and contributes to adverse clinical outcome in ovarian cancers[J].Oncogene,32 (30):3500-3509.
[14] Bourguignon LY,Spevak CC,Wong G,et al.Hyaluronan-CD44 interaction with protein kinase Cε promotes oncogenic signaling by the stem cell marker Nanog and the production of microRNA-21,leading to down-re-gulation of the tumor suppressor protein PDCD4,anti-apoptosis,and chemotherapy resistance in breast tumor cells[J].J Biol Chem,2009,284 (39):26533-26546.
[15] Wiechert A,Saygin C,Thiagarajan PS,et al.Cisplatin induces stemness in ovarian cancer[J].Oncotarget,2016,7 (21):30511-30522.
[16] Chiou SH,Wang ML,Chou YT,et al.Coexpression of Oct4 and Nanog enhances malignancy in lung adenocarcinoma by inducing cancer stem cell-like properties and epithelial-mesenchymal transdifferentiation[J].Cancer Res,2010,70 (24):10433-10444.
[17] Lu CS,Shieh GS,Wang CT,et al.Chemotherapeutics-induced Oct4 expression contributes to drug resistance and tumor recurrence in bladder cancer[J].Oncotarget,2017,8 (19):30844-30858.

