miR-451通过靶向Psmb8抑制糖尿病肾病小鼠肾小球系膜细胞炎症反应*
姜文豪,孙 艳,彭 睿,彭惠民,张 政
(重庆医科大学基础医学院,重庆 400016)
糖尿病肾病(diabetic nephropathy,DN)是最严重的糖尿病并发症之一,也是导致终末期肾病的主要原因,约1/3的糖尿病患者会发展成为糖尿病肾病[1]。DN的发生涉及细胞外基质堆积、肾小球肥大、肾脏基底膜增厚以及肾小球硬化等多种病理改变[2],其分子发病机制较为复杂。新近研究发现,持续的高糖环境能够诱发炎症反应的发生,造成过量的免疫细胞产生及炎症因子分泌,对DN的发生发展起到一定的促进作用[3-5],但其具体机制仍不明确。
微小RNA(microRNA,miRNA,miR)是一类长度为21~23个核苷酸的单链小分子非编码RNA片段,主要通过抑制蛋白质翻译及mRNA剪切的方式负调控靶基因。研究表明,miRNA在包括细胞分化、细胞凋亡、脂类代谢、发育以及激素分泌等多种生理过程中发挥作用,参与糖尿病肾病。本课题组前期芯片结果发现,与正常组小鼠相比较,miR-451在糖尿病肾病小鼠肾脏组织内表达异常[6];且miR-451可通过Ywhaz/p38 MAPK信号途径抑制DN系膜增生[7],提示miR-451可能是一个重要的DN调节因子。然而,miR-451在DN炎症中的具体作用如何目前未见相关报道。
本研究在前期肺癌细胞实验发现miR-451可直接靶向一个炎症相关基因——β型蛋白酶体亚基8(proteasome subunit β type 8,Psmb8)的基础上[8],应用商品化miR-451 mimics和inhibitor分别转染至高、低糖培养的肾小球系膜细胞(mesangial cells,MCs),观察细胞炎症标志物的表达改变,同时检测Psmb8在系膜细胞中的表达及其对炎症相关标志物表达的影响,探索miR-451通过炎症相关靶基因调控DN炎症的机制。
材 料 和 方 法
1 主要材料与试剂
永生化肾小球系膜细胞株SV40-MES13(中国科学院细胞库);LipofectamineTM2000和Trizol(Invitrogen);miR-451 mimics和miR-451 inhibitor及其阴性对照(negative control,NC)mimics NC 和inhibitor NC(上海吉玛制药技术有限公司);高、低糖DMEM液体培养基和胎牛血清(Gibco);BCA蛋白定量试剂盒(上海碧云天生物科技有限公司);PVDF膜(Millipore);兔抗白细胞介素(interleukin,IL)-18、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、Psmb8和GAPDH多克隆抗体(Abcam);Psmb8 小干扰RNA(small interfering RNA,siRNA)和PCR引物(上海生工生物工程技术服务有限公司);SYBR®Premix Ex TaqTMⅡ和PrimeScript® RT reagent Kit(大连宝生物工程有限公司)。
2 主要方法
2.1细胞培养为模拟正常及糖尿病状态,分别用葡萄糖浓度为5.5 mmol/L和25 mmol/L、含20%胎牛血清的DMEM培养基,于37 ℃、5% CO2浓度培养小鼠肾小球系膜细胞,分别为低葡萄糖(low-glucose MCs,L-MC)组和高葡萄糖(high-glucose MCs,H-MC)组,同时低葡萄糖组中加入19.5 mmol/L的甘露醇以维持等渗环境。当细胞融合度达到80%时,用0.25%胰蛋白酶消化细胞,800 r/min离心5 min,收集细胞进行传代或冻存。
2.2设计合成 Psmb8 siRNA根据Ensembl数据库中公布的小鼠Psmb8基因序列,应用Oligo软件设计3条siRNA,具体序列如下:No.1:5’-UUUGUUCAUCCUUAAGGAGCU-3’; No.2:5’-UUUCCUAAGACUGAAGUAGUC-3’; No.3:5’-AUUGUACUUAGAAGGUAUCUG-3’。由上海生工生物工程技术服务有限公司合成,其干扰效率通过qPCR检测。
2.3细胞转染及分组当MCs达到对数生长期时,运用LipofectamineTM2000将miR-451 mimics及mi-mics NC分别转染到高糖培养的MCs中(即H-MC miR-451组和H-MC miR-NC组),将miR-451 inhibitor及inhibitor NC分别转染到低糖培养的MCs中(即L-MC anti-miR-451组和L-MC anti-miR-NC组),将Psmb8 siRNA转染到高糖培养的MCs中(即H-MC siPsmb8组),37 ℃、5% CO2条件下培养6 h后更换培养基,继续培养48 h后收集细胞。
2.4miR-451表达水平的检测应用qPCR法。待细胞融合度达到80%时,Trizol法裂解细胞提取总RNA,进行逆转录。逆转录的体系为 5× gDNA Era-ser Buffer 2.0 μL、gDNA Eraser 1.0 μL和total RNA 1.0 μg,补加RNase-free dH2O至总体积为10 μL。将混合后的反应液室温静止10 min后于冰上与1.0 μL PrimeScript RT Enzyme MixⅠ、1.0 μL miR-451特异的茎环引物、4.0 μL 5×PrimeScript Buffer 2(for Real Time)和4.0 μL RNase-free dH2O混合,在37 ℃ 15 min、85 ℃ 5 s、4 ℃ 15 min的逆转录反应程序下进行逆转录得cDNA。miR-451逆转录引物序列为5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCA-CTG-3’。然后以cDNA为模板进行qPCR反应,引物序列为5’-CCGAAACCGTTACCATTAC-3’(forward)和5’-GTGCAGGGTCCGAGGT-3’(reverse),其反应体系为SYBR Premix Ex Taq (Tli RNaseH Plus) (2×) 10 μL、 PCR forward primer (10 μmol/L) 0.5 μL、 PCR reverse primer (10 μmol/L) 0.5 μL、cDNA 2 μL和灭菌蒸馏水7 μL。将反应液混合均匀后于CFX96TMReal-Time PCR仪完成qPCR反应,其反应条件为:95℃预变性30 s; 95 ℃变性5 s、60 ℃退火30 s、72 ℃延伸30 s,进行40个循环;95 ℃ 10 s、65 ℃ 5 s、95 ℃,每0.5 ℃进行熔解曲线分析。最后以U6为内参照利用公式2-ΔΔCt计算miR-451的相对表达量。
2.5IL-18和TNF-α的mRNA表达检测应用qPCR检测,操作步骤同前。TNF-α的上游引物序列为5’-CCCTCACACTCAGATCATCTTCT-3’,下游引物序列为5’-GCTACGACGTGGGCTACAG-3’; IL-18的上游引物序列为5’-GACTCTTGCGTCAACTTCAAGG-3’,下游引物序列为5’-CAGGCTGTCTTTTGTCAACGA-3’;内参照β-actin的上游引物序列为5’-ATATCGCTGCGCTG GTCGTC-3’,下游引物序列为5’-AGGATGGCGTGAGGGAGAGC-3’。
2.6Western blot法检测IL-18、TNF-α和Psmb8蛋白的相对表达水平将处于对数生长期的各组细胞收集于EP管中,加入适量蛋白裂解液裂解细胞,BCA法测定蛋白浓度,每组取50 g蛋白进行SDS-PAGE,电泳后应用湿转法将蛋白转膜到PVDF膜上,分别加入兔抗IL-18、TNF-α、Psmb8和GAPDH多克隆抗体,4 ℃孵育过夜;TBST洗膜3次后分别加入辣根过氧化物酶标记的羊抗兔IgG和羊抗小鼠IgG,室温孵育1 h,覆盖ECL发光剂后于化学发光仪上摄取图像。以GAPDH为内参照进行校正,通过CM-2000B型生物医学成像系统进行灰度分析。
3 统计学处理
采用SPSS 20.0软件进行统计学分析。数据以均数±标准差(mean±SD)表示,两组比较采用t检验,两组以上进行比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 miR-451和Psmb8在高糖培养的系膜细胞中呈显著低表达
qPCR检测结果表明,H-MC组miR-451的表达水平明显低于L-MC组(P<0.01),提示miR-451可能与DN的发生相关,见图1A。Western blot检测结果显示,H-MC组中Psmb8蛋白表达量与L-MC组相比较显著升高(P<0.01),提示Psmb8可能在DN中发挥作用,见图1B。
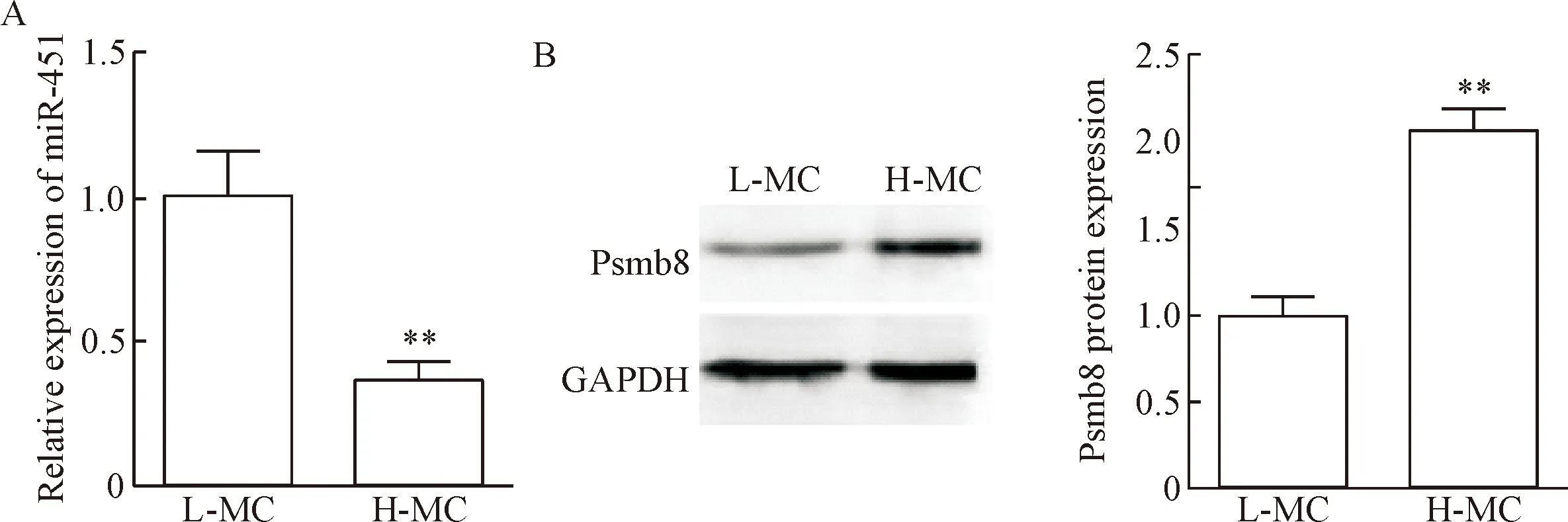
Figure 1.The expression of miR-451 and Psmb8 protein in mouse mesangial cells under high-and low-glucose conditions.A:the expression of miR-451 was down-regulated in H-MC group compared with L-MC group; B:the protein expression of Psmb8 was increased in H-MC group compared with L-MC group.Mean±SD.n=3.**P<0.01vsL-MC group.
图1肾小球系膜细胞中miR-451及Psmb8的表达水平
2 高、低表达miR-451对炎症标志物IL-18和TNF-α表达水平的影响
qPCR结果表明,IL-18和TNF-α的mRNA表达水平在H-MC miR-451组较H-MC组显著降低(P<0.01);L-MC anti-miR-451组较L-MC组IL-18和TNF-α的mRNA表达水平显著升高(P<0.01),见图2A、B。Western blot检测IL-18和TNF-α的蛋白表达水平结果与qPCR结果相一致,见图2C。以上结果均提示miR-451对DN炎症的发生具有抑制作用。
3 高、低表达miR-451对Psmb8蛋白表达水平的影响
Western blot检测结果显示,H-MC miR-451组Psmb8蛋白表达水平较H-MC和H-MC miR-NC组降低 (P<0.01)。同时,L-MC anti-miR-451组Psmb8蛋白表达水平较L-MC和L-MC anti-miR-NC组增高(P<0.01),见图3。结合前期萤光素酶检测结果[8],我们认为miR-451在DN可通过种子序列与Psmb8基因的3’UTR结合,从而靶向抑制Psmb8的表达。
4 沉默Psmb8对IL-18和TNF-α蛋白表达水平的影响
qPCR检测结果显示合成的3条Psmb8 siRNA中,与另外2条siRNA相比较,第2条siRNA对Psmb8 mRNA表达的干扰效率最高(P<0.01),因此选择该条siRNA用于后续实验,见图4A。Western blot检测结果表明H-MC组IL-18和TNF-α蛋白相对表达水平较L-MC组明显升高(P<0.01),与高糖环境能够诱导炎症发生的结果相一致;H-MC siPsmb8组中IL-18和TNF-α蛋白相对表达水平较H-MC组显著降低(P<0.01),提示Psmb8可能参与DN炎症的发生,见图4B。

Figure 2.The effect of miR-451 on inflammatory markers IL-18 and TNF-α in mouse mesangial cells.A and B:the mRNA expression of IL-18 and TNF-α detected by qPCR; C:the protein expression of IL-18 and TNF-α detected by Western blot.Mean±SD.n=3.**P<0.01vsL-MC anti-miR-451 group;△△P<0.01vsH-MC miR-451 group.
图2肾小球系膜细胞中高低表达miR-451对炎症标记物IL-18和TNF-α的影响
讨 论
当机体中存在血管系统的活体组织对损伤因子产生防御性反应时诱发炎症,该过程大多数情况下是机体清除有害物质的自我保护过程,但有时会对机体造成一定的损伤[9]。已有充分的证据表明miRNA对炎症及其相关反应的发生具有一定的影响。miRNA与溃疡性结肠炎[10]、幽门螺杆菌感染[11]和病毒性肝炎[12]等炎症相关疾病的发生与发展有着极为密切的联系。有研究显示miR-21可作为DN诊断的标志物[13]。但miRNA在糖尿病肾病炎症中的作用,目前未见明确报道。
本实验以课题组前期芯片筛查DN相关miRNA结果为基础,发现在糖尿病肾病小鼠肾脏组织表达异常的miR-451。qPCR结果显示miR-451在高糖培养的系膜细胞中较低糖组显著下降,提示它可能在DN中发挥作用。实验表明高糖培养的系膜细胞较低糖培养的系膜细胞炎症标志物IL-18和TNF-α显著升高,明确高糖环境能够诱导炎症的发生。在高糖培养的系膜细胞中高表达miR-451,IL-18和TNF-α表达均下降,而在低糖培养的系膜细胞中沉默miR-451后,IL-18和TNF-α表达水平显著增高,提示miR-451对DN系膜细胞炎症发生具有调控作用。然而,miR-451在DN炎症中的作用究竟如何,需要我们进一步研究。
本课题组前期研究发现,Psmb8的3’UTR存在与miR-451 5’端第2~8个碱基(即“种子序列”)完全互补的碱基位点,且该序列在包括小鼠、大象、黑猩猩和牛等多种物种中高度保守,同时通过双萤光素报告基因实验证明了Psmb8是miR-451的直接靶基因[8]。Psmb8是位于人类6号染色体短臂、含有6个外显子区域、长度为4 219 bp的编码基因,其编码蛋白能够与Psmb9和Psmb10共同构成由4个七聚体层叠形成的空心圆柱样免疫蛋白酶体[14]。免疫蛋白酶体能够降解甲基化的炎症核心调控因子核因子κB(nuclear factor-κB,NF-κB)的抑制蛋白IκB,使处于抑制状态NF-κB活化,启动细胞核内相应炎症相关因子的转录,从而诱发炎症反应[15]。本课题组前期实验[3,5]已经证明高糖环境下,MCs中经免疫蛋白酶体活化的NF-κB能够诱导包括IL-18和TNF-α等在内的炎症相关因子基因的转录,诱导炎症的发生,表明Psmb8能够通过构成的免疫蛋白酶体而活化NF-κB,促进DN炎症的发生与发展。在对类风湿关节炎的研究中发现,对Psmb8的特异性抑制能够减少炎症因子的分泌,从而延缓炎症的发生[16];Koerner等[17]研究发现Psmb8参与的炎症反应与结肠直肠癌的发生发展密切相关。以上结果提示Psmb8与DN炎症的发生密切相关,且miR-451可靶向调控Psmb8的表达,因此Psmb8受到我们的关注。本实验发现在高糖环境下,MCs中Psmb8表达明显升高,且沉默Psmb8的表达可显著抑制炎症相关因子IL-18和TNF-α的表达,提示Psmb8可能参与DN炎症过程。同时,Western blot检测结果显示,在高糖培养的系膜细胞中高表达miR-451后,Psmb8表达水平下降;反之,在低糖培养的系膜细胞中沉默miR-451后,Psmb8表达水平则增高。以上结果提示miR-451对DN系膜细胞炎症发生具有调控作用,且该作用可能通过靶向Psmb8得以实现,从而参与DN的发生、发展。
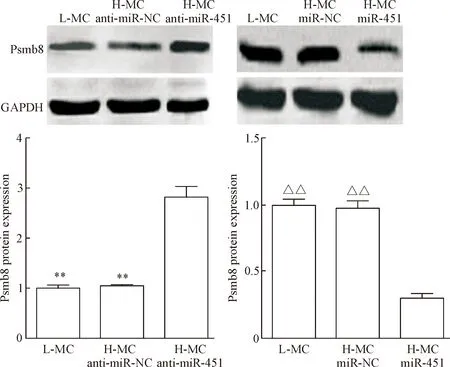
Figure 3.The effect of miR-451 on the expression of Psmb8 in the mouse mesangial cells.Mean±SD.n=3.**P<0.01vsL-MC anti-miR-451 group;△△P<0.01vsH-MC miR-451 group.
图3肾小球系膜细胞中高、低表达miR-451对Psmb8蛋白表达的影响
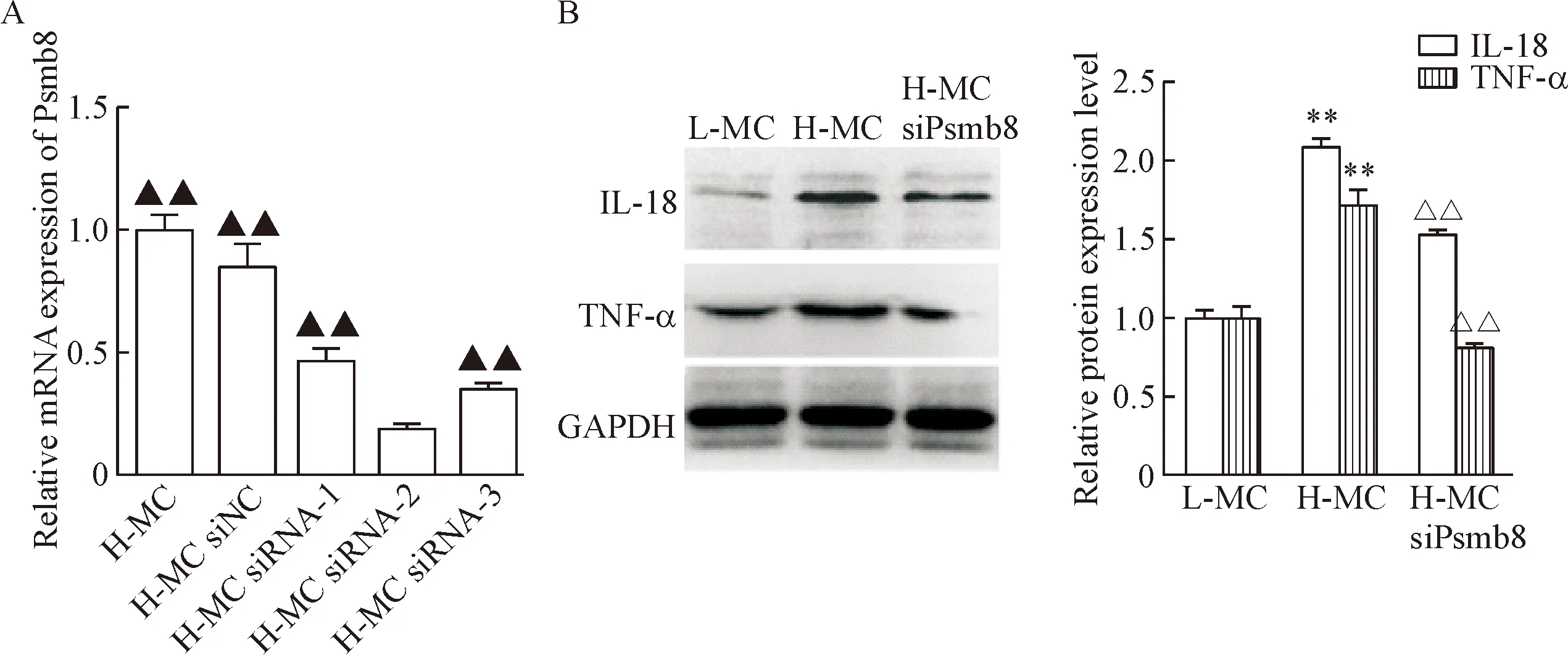
Figure 4.The effect of Psmb8 on the protein expression of IL-18 and TNF-α in mouse mesangial cells.A:the efficiency of siPsmb8 in H-MC siRNA-2 group was the highest when compared with that in H-MC siRNA-1 and H-MC siRNA-3 groups; B:the protein expression levels of IL-18 and TNF-α were increased in H-MC group compared with L-MC group,while those were decreased whenPsmb8 was silenced in H-MC siPsmb8 group compared with H-MC group.Mean±SD.n=3.▲▲P<0.01vsH-MC siRNA-2 group;**P<0.01vsL-MC group;△△P<0.01vsH-MC group.
图4肾小球系膜细胞中低表达Psmb8对IL-18和TNF-α蛋白表达的影响
[参考文献]
[1]Lv M,Chen Z,Hu G,et al.Therapeutic strategies of diabetic nephropathy:recent progress and future perspectives[J].Drug Discov Today,2015,20(3):332-346.
[2]Aroune D,Libdiri F,Leboucher S,et al.Changes in the NFκB and E-cadherin expression are associated to diabe-tic nephropathy inPsammomysobesus[J].Saudi J Biol Sci,2017,24(4):843-850.
[3]Sun Y,Peng R,Peng H,et al.miR-451 suppresses the NF-κB-mediated proinflammatory molecules expression through inhibiting LMP7 in diabetic nephropathy[J].Mol Cell Endocrinol,2016,433:75-86.
[4]Kanasaki K,Taduri G,Koya D.Diabetic nephropathy:the role of inflammation in fibroblast activation and kidney fibrosis[J].Front Endocrinol (Lausanne),2013,4:7.
[5]Yi H,Peng R,Zhang LY,et al.LincRNA-Gm4419 knockdown ameliorates NF-κB/NLRP3 inflammasome-mediated inflammation in diabetic nephropathy[J].Cell Death and Dis,2017,8(2):e2583.
[6]Zhang Z,Peng H,Chen J,et al.MicroRNA-21 protects from mesangial cell proliferation induced by diabetic nephropathy in db/db mice[J].FEBS Lett,2009,583(12):2009-2014.
[7]Zhang Z,Luo X,Ding S,et al.MicroRNA-451 regulates p38 MAPK signaling by targeting of Ywhaz and suppresses the mesangial hypertrophy in early diabetic nephropathy[J].FEBS Lett,2012,586(1):20-26.
[8]武天慧,彭睿,彭惠民,等.miR-451对肺癌细胞的增殖抑制及其靶基因的初步鉴定[J].第三军医大学学报,2015,37(18):1823-1829.
[9]Roy S,Sen CK.miRNA in wound inflammation and angiogenesis[J].Microcirculation,2012,19(9):224-232.
[10] Ben-Shachar S,Yanai H,Horev HS,et al.MicroRNAs expression in the ileal pouch of patients with ulcerative colitis is robustly up-regulated and correlates with disease phenotypes[J].PLoS One,2016,11(8):e0165220.
[11] Shiota1 S,Yamaoka Y.Biomarkers forHelicobacterpyloriinfection and gastroduodenal diseases[J].Biomarkers Med,2014,8(9):1127-1137.
[12] Teng GG,Wang WH,Dai Y,et al.Let-7b is involved in the inflammation and immune responses associated withHelicobacterpyloriinfection by targeting Toll-like receptor 4[J].PLoS One,2013,8(2):e56709.
[13] 朱柄铭,陈文璟,苏运钦,等.血清miR-21在糖尿病肾病中的诊断价值[J].中国病理生理杂志,2013,29(12):2160-2166.
[14] Lip PZ,Demasi M,Bonatto D.The role of the ubiquitin proteasome system in the memory process[J].Neurochem Int,2017,102:57-65.
[15] Pordanjani SM,Hosseinimehr SJ.The role of NF-κB inhibitors in cell response to radiation [J].Curr Med Chem,2016,23(34):3951-3963.
[16] Yamagishi S.Role of advanced glycation end products (AGEs) and receptor for AGEs (RAGE) in vascular damage in diabetes[J].Exp Gerontol,2011,46(4):217-224.
[17] Koerner J,Brunner T,Groettrup M.Inhibition and deficiency of the immunoproteasome subunit LMP7 suppress the development and progression of colorectal carcinoma in mice[J].Oncotarget,2017,8(31):50873-50888.

