丹酚酸B对糖尿病大鼠血管舒张功能、NF-κB活化及炎症因子表达的影响*
赵梦秋,任尤楠,陶善珺,吴元洁,郑书国△, 洪 勇
(1安徽卫生健康职业学院药学教研室,安徽 池州 247099; 2皖南医学院药理学教研室,安徽 芜湖 241002; 3安徽中医药大学中医基础理论教研室,安徽 合肥 230038; 4安徽卫生健康职业学院解剖教研室,安徽 池州 247099)
糖尿病是一种慢性高血糖伴有蛋白质及脂质代谢紊乱综合症,可引起心、肾和血管等多器官并发症,其中大血管病变引起的急性心血管事件是患者死亡的主要原因[1]。因此积极防治糖尿病及其血管并发症具有重要的现实意义和紧迫性。
糖尿病血管病变的基础是内皮损伤,病变表现为中等以上动脉发生动脉粥样硬化(atherosclerosis,AS)[2]。高血糖可通过多种机制诱导内皮损伤,其中氧化应激诱导的炎症反应是主要机制之一[3]。由此推测抑制氧化应激诱导的血管壁慢性炎症过程是保护血管功能、防治糖尿病血管并发症的可靠途径。
丹酚酸B(salvianolic acid B,Sal B)是我国传统中药丹参中提取的水溶性成分,具有抗氧化、抗炎和调血脂等多种作用[4]。目前对丹酚酸B抗糖尿病并发AS的研究主要集中在调血脂和抑制内皮细胞凋亡方面,对血管慢性炎症状态的研究较少。本实验将以炎症为靶点,在糖尿病大鼠模型上进一步研究丹酚酸B对糖尿病血管损伤的干预作用,探讨其可能机制,为丹酚酸 B防治糖尿病AS提供依据。
材 料 和 方 法
1 实验动物
SPF级雄性Sprague-Dawley (SD)大鼠50只,体重(220±20) g,购自浙江省实验动物中心,合格证号为SCXK(浙)2014-0001。高糖高脂饲料(10%猪油、10%蔗糖、5%蛋黄粉、1%胆固醇和74%普通饲料),普通颗粒饲料均购自南京市江宁区青龙山动物繁殖场。大鼠饲养于自然光照、室温(22±2) ℃环境中,自由进食和饮水。
2 药物和试剂
Sal B(批号HK201410)购于西安文竹生物科技有限公司;重酒石酸去甲肾上腺素(noradrenaline,NA)注射液(批号08140604)购自上海禾丰制药有限公司;链脲佐菌素(streptozotocin,STZ; 编号1126C028)、苯肾上腺素(phenylephrine,Phe; 编号MKBK1565V)、乙酰胆碱(acetylcholine,ACh; 编号BCBC9786V)和硝普钠(sodium nitroprusside,SNP; 编号S-0501)均购自Sigma。
大鼠白细胞介素6(interleukin-6,IL-6)检测试剂盒(编号H007)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测试剂盒(编号H052)和C反应蛋白(C-reactive protein,CRP)检测试剂盒(编号H126)均购自南京建成生物工程研究所;抗细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)抗体(编号ab171123)和抗单核细胞趋化因子1(monocyte chemoattractant protein-1,MCP-1)抗体(ab25124)购自Abcam;抗核因子κB p65(nuclear factor-κB p65,NF-κB p65)抗体(编号AN365)、抗β-actin抗体(编号AA128)、抗组蛋白H3抗体(编号AF0009)、辣根过氧化物酶标记的山羊抗小鼠II抗(编号A0216)、辣根过氧化物酶标记、山羊抗兔 II 抗(编号A0208)、RIPA 裂解液(编号P0013C)、PMSF(编号ST506)、细胞核蛋白与细胞浆蛋白抽提试剂盒(编号 P0027)、总抗氧化能力(total antioxidant capacity,TAOC)检测试剂盒(编号S0121)、丙二醛(malondialdehyde)检测试剂盒(MDA,编号S0131)、一氧化氮(nitric oxide,NO)检测试剂盒(编号S0021)和BCA蛋白检测试剂盒(编号P0012)均购自碧云天生物技术研究所。
3 主要仪器
酶标仪(Thermo Fisher Scientific);低温高速离心机(Eppendorf);电泳槽(北京六一仪器厂);半干转膜系统(Bio-Rad);离体组织器官实验系统、数控恒温循环水槽和多通道生物信号处理系统(上海奥尔科特生物科技有限公司);张力换能器(北京新航兴业科贸有限公司)。
4 方法
4.1糖尿病大鼠模型的建立健康雄性SD大鼠50只,体重(220±20) g,自由进食和饮水,经1周适应性喂养后随机分为正常对照组(n=10)与糖尿病组(n=40)。正常对照组大鼠给予普通颗粒饲料喂养,糖尿病模型组给予高糖高脂饲料。喂养4周后禁食12 h,按40 mg/kg一次性腹腔注射1% STZ诱发糖尿病,正常对照组大鼠腹腔注射等体积的柠檬酸缓冲液。1周后以随机血糖>16.7 mmol/L视为糖尿病模型复制成功。将成模大鼠随机分为模型(mo-del)组、Sal B高剂量(high dose of Sal B,HS)组和Sal B低剂量(low dose of Sal B,LS)组。治疗组每日灌胃给予相应剂量的丹酚酸B (160 mg·kg-1·d-1及80 mg·kg-1·d-1),正常对照组和模型组均给予等体积蒸馏水,共6周。期间每周称量体重一次并根据体重调整给药剂量。
4.2血液采集和血管标本制备于末次给药后禁食12 h,腹腔注射戊巴比妥钠 (30 mg/kg) 麻醉大鼠,腹主动脉取血,分离血清用于生化指标测定。钝性分离主动脉后取约1 cm血管置于4 ℃预冷并通有 95% O2及 5% CO2的 K-H 液中,用于离体动脉环实验,剩余主动脉于-80 ℃冰箱保存,用于生化指标检测及Western blot检测。主动脉弓置于4%多聚甲醛固定,常规石蜡包埋,用于病理学观察。
4.3离体动脉环实验(血管舒张功能检测)将动脉环固定于盛有K-H液的37 ℃恒温浴槽中,持续通入95% O2和5% CO2。2 g前负荷下平衡1 h,以3×10-7mol/L 去甲肾上腺素预收缩血管,待动脉环稳定后,以苯肾上腺素(1×10-6mol/L)收缩血管,待收缩稳定后观察累积浓度的乙酰胆碱(1×10-8~1×10-4mol/L)及硝普钠(1×10-9~1×10-5mol/L)诱导的主动脉舒张反应。主动脉舒张反应以累积浓度引起的血管舒张张力占Phe引起的收缩张力的百分比表示(%)。
4.4病理学检查取主动脉弓,4%多聚甲醛溶液固定72 h,梯度乙醇脱水,常规石蜡包埋、切片(5 μm)、脱蜡至水,HE染色,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜观察主动脉病理学变化。
4.5血清IL-6、TNF-α及CRP水平测定取血清样本,ELISA法测定血清IL-6、TNF-α及CRP水平,具体操作步骤按试剂盒说明书进行。
4.6主动脉TAOC、MDA及NO水平测定取血管组织制备10%组织匀浆,3 000 r/min离心10 min,收集上清液。按试剂盒说明书测定组织匀浆TAOC、MDA及NO水平。
4.7Western blot实验取血管组织,按0.1 g组织加入600 μL RIPA裂解液(含1 mmol/L PMSF)提取总蛋白。检测NF-κB p65核转位时按0.1 g组织加入200 μL蛋白抽提试剂(含1 mmol/L PMSF)提取核蛋白。BCA法检测蛋白浓度,行SDS-PAGE、转膜,分别加入 I 抗和II 抗孵育,ECL显色,X光胶片显影,图像扫描后使用Quantity One软件进行分析。蛋白表达结果以β-actin作为内参照,NF-κB p65以组蛋白 H3作为内参照。
5 统计学处理
采用DAS 1.0软件包进行统计学分析。计量资料以均数±标准差(mean±SD)表示,多组均数间比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 丹酚酸B对内皮依赖性血管舒张功能的影响
离体动脉环实验结果可见,糖尿病大鼠主动脉对ACh引起的内皮依赖性舒张反应较正常组显著降低(P<0.01),提示血管内皮受损,内皮依赖性舒张功能减弱;与模型组比较,丹酚酸B治疗组大鼠主动脉对ACh 诱导的内皮依赖性舒张反应明显增强(P<0.05或P<0.01),提示丹酚酸B能改善糖尿病大鼠血管内皮依赖性舒张功能,见图1。
2 丹酚酸B对非内皮依赖性血管舒张功能的影响
离体动脉环实验结果示,不同浓度SNP均能引起血管舒张,且各组间无明显差异,提示糖尿病大鼠非内皮依赖性血管舒张功能无明显受损,见图2。
3 丹酚酸B对糖尿病大鼠主动脉病理改变的影响
HE染色显示对照组大鼠主动脉内膜光滑,内皮细胞完整,无缺损或增厚,中膜层平滑肌细胞排列整齐,见图3A;糖尿病大鼠主动脉呈现粥样硬化趋势,血管内膜失去完整性,平滑肌排列紊乱,见图3B;给予丹酚酸B治疗后主动脉壁病变减轻,见图3C、D。这提示丹酚酸B可在一定程度上改善糖尿病大鼠主动脉病理损伤。
4 丹酚酸B对糖尿病大鼠血清IL-6、TNF-α及CRP水平的影响
糖尿病大鼠血清炎症因子IL-6、TNF-α及CRP水平较正常大鼠显著增高(P<0.05或P<0.01),提示糖尿病大鼠体内存在炎症;丹酚酸B治疗组上述指标较模型组均有明显降低(P<0.05或P<0.01),且高剂量组较低剂量组改善作用更加显著,见表1。
5 丹酚酸B对糖尿病大鼠主动脉NO、TAOC及MDA水平的影响
与对照组相比,糖尿病大鼠主动脉内皮舒张因子NO水平显著降低(P<0.01),与内皮依赖性舒张功能减弱的趋势一致,提示糖尿病大鼠血管明显受损;同时,主动脉TAOC明显降低(P<0.01),脂质过氧化产物MDA含量明显升高(P<0.01)。丹酚酸B能有效提高NO水平,增强血管抗氧化能力,减少MDA堆积(P<0.01),提示丹酚酸B可明显改善糖尿病大鼠血管损伤,见表2。
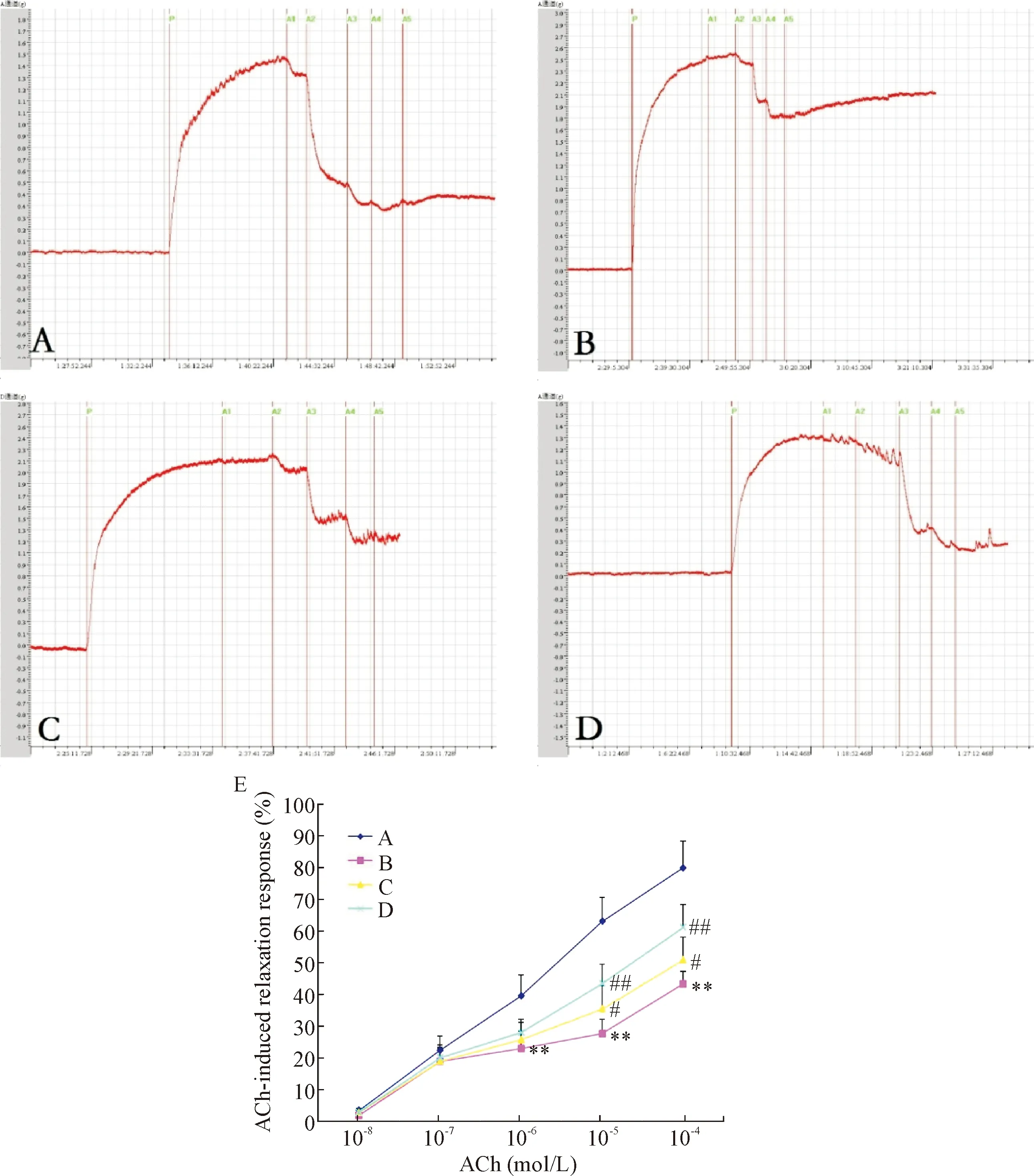
Figure 1.The effect of Sal B on ACh-induced relaxation response of aorta.A:control group; B:model group; C:LS group; D:HS group; E:ACh-induced relaxation response.Mean±SD.n=7.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图1丹酚酸B对Ach诱导糖尿病大鼠主动脉舒张反应的影响
6 丹酚酸B对糖尿病大鼠主动脉NF-κB p65亚基核转位的影响
如图4所示,与对照组相比,糖尿病大鼠主动脉NF-κB p65亚基在细胞核内表达明显增加(P<0.01);丹酚酸B治疗组大鼠主动脉NF-κB p65亚基核转位明显减少(P<0.01)。
7 丹酚酸B对糖尿病大鼠主动脉ICAM-1及MCP-1蛋白表达的影响
由图5可见,糖尿病大鼠主动脉ICAM-1及MCP-1蛋白表达水平明显高于正常大鼠(P<0.01),提示主动脉出现明显的炎性病变;丹酚酸B治疗可有效抑制ICAM-1及MCP-1蛋白表达,减轻炎性细胞黏附(P<0.01)。
讨 论
糖尿病是严重危害人类健康的慢性疾病,可引起心、脑、肾和血管等多种靶器官损伤。糖尿病血管损伤的病理特征主要是内皮细胞损伤、血管壁脂质沉积及平滑肌细胞异常迁移和增殖,最终导致管腔狭窄或粥样斑块破裂[5]。本实验采用国内外常用的糖尿病大鼠模型制备方法,即在高糖高脂饲料喂养的基础上,注射低剂量STZ损伤胰岛功能,获得实验性糖尿病大鼠。主动脉离体灌流结果显示,模型组大鼠主动脉对ACh 引起的内皮依赖性舒张反应显著降低,而对NO直接供体SNP诱导的非内皮依赖性舒张反应并无明显差异。病理检查结果显示糖尿病大鼠主动脉呈现粥样硬化趋势,血管内膜失去完整性,平滑肌排列紊乱,微血管基底膜增厚,糖原沉积、脂肪样及透明样变性。同时我们观察到主动脉NO水平明显降低,而内皮依赖性舒张反应主要由ACh作用于内皮细胞后产生的NO进行调节,当血管内皮受损时NO合成减少则出现舒张功能障碍。上述结果显示糖尿病大鼠主动脉内皮出现明显的结构及功能损伤,而给予丹酚酸B治疗能够明显改善大鼠血管内皮损伤。

Figure 2.The effect of Sal B on SNP-induced relaxation response of aorta.A:control group; B:model group; C:LS group; D:HS group; E:SNP-induced relaxation response.Mean±SD.n=7.
图2丹酚酸B对SNP诱导糖尿病大鼠主动脉舒张反应的影响
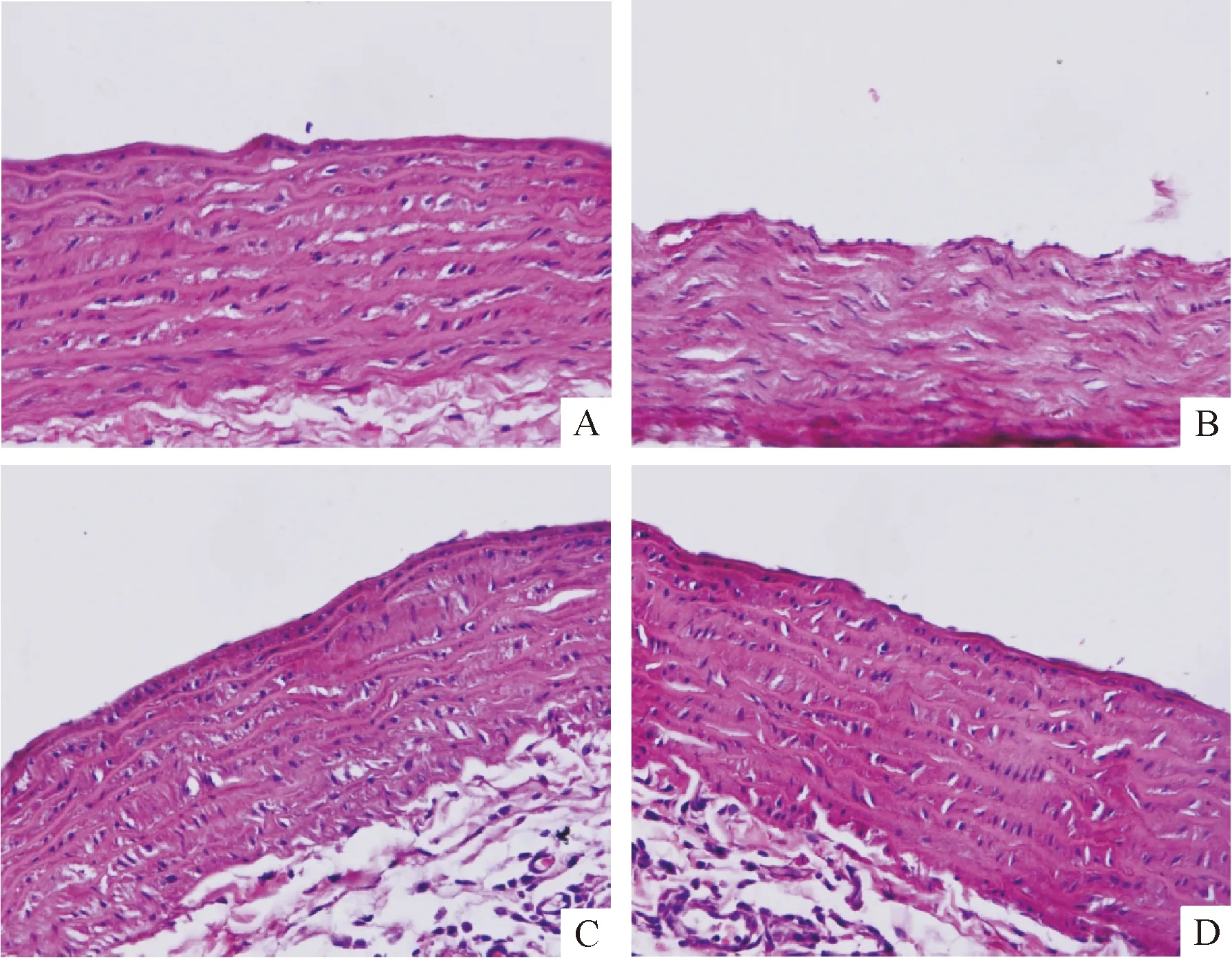
Figure 3.The effect of Sal B on primary histopathological changes of aorta (HE staining,×400).A:control group; B:model group; C:LS group; D:HS group.
图3丹酚酸B对糖尿病大鼠主动脉病理改变的影响
表1丹酚酸B对大鼠血清IL-6、TNF-α及CRP水平的影响
Table 1.The effect of Sal B on serum levels of IL-6,TNF-α and CRP (Mean±SD.n=8)

GroupIL⁃6(ng/L)TNF⁃α(ng/L)CRP(mg/L)Control38±8 156±15 1.9±0.4Model156±17∗∗371±31∗∗7.7±1.0∗∗LS124±12## 302±30##6.2±1.2##HS91±13##267±28##5.4±1.0##
**P<0.01vscontrol group;##P<0.01vsmodel group.
表2丹酚酸B对大鼠主动脉NO、TAOC及MDA水平影响
Table 2.The effect of Sal B on levels of NO,TAOC and MDA in aorta (Mean±SD.n=8)

GroupNO(μmol/gprotein)TAOC(mmol/gprotein)MDA(μmol/gprotein)Control7.7±1.30.36±0.053.7±0.6Model3.8±0.4∗∗0.16±0.03∗∗9.9±1.7∗∗LS4.6±0.80.23±0.03##7.7±1.1##HS5.4±0.9##0.29±0.04##6.2±0.9##
**P<0.01vscontrol group;##P<0.01vsmodel group.
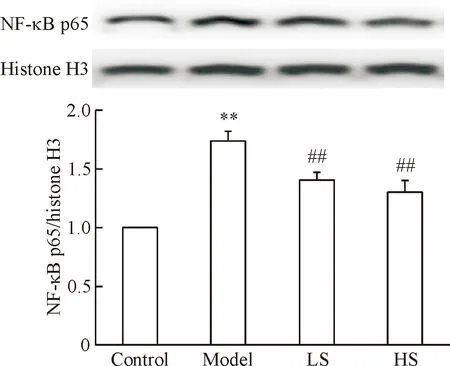
Figure 4.The effect of Sal B on NF-κB p65 nuclear translocation in aorta tissues.Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsmodel group.
图4丹酚酸B对糖尿病大鼠主动脉NF-κBp65亚基核转位的影响
近年来大量研究表明,2型糖尿病与多种细胞因子介导的炎症反应关系密切,而在动脉粥样硬化发病过程中,单核细胞的募集与黏附、巨噬细胞的增殖、血管平滑肌细胞增殖和迁移、基质的降解等均与炎症有关,因此认为炎症参与了糖尿病动脉粥样硬化的进程[6]。高血糖通过一系列复杂的机制诱导内皮细胞大量产生和释放炎症因子、趋化因子和黏附分子,促使循环的白细胞、血小板黏附到内皮细胞表面,然后侵袭至内皮下,造成血管病变。文献报道在糖尿病患者血清中检测到炎症因子水平显著升高[7-8],我们在糖尿病大鼠模型中也观察到血清CRP、TNF-α和IL-6水平明显高于正常大鼠,同时我们还观察到血管组织中ICAM-1和MCP-1的蛋白表达水平明显增加。ICAM-1是一种重要的细胞表面黏附因子,参与炎性细胞向组织移动或定位过程。MCP-1是很强的单核细胞趋化因子,介导单核细胞和淋巴细胞向血管壁迁徙、进入内皮下并分化成巨噬细胞的过程[9]。在糖尿病血管病变进程中ICAM-1和MCP-1均发挥显著的促进作用。本研究中发现糖尿病大鼠血清中炎症因子TNF-α、CRP和IL-6水平及血管组织中MCP-1、ICAM-1 表达明显高于对照组大鼠,丹酚酸B治疗后大鼠体内炎症指标均明显降低,提示丹酚酸B能够改善糖尿病大鼠炎性损伤。

Figure 5.The effect of Sal B on protein expression of ICAM-1 and MCP-1 in the aorta.Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsmodel group.
图5丹酚酸B对糖尿病大鼠主动脉ICAM-1及MCP-1蛋白表达的影响
NF-κB是一种细胞内普遍存在的转录因子,参与免疫反应、炎症和凋亡等多种病理生理过程。正常情况下,NF-κB以非活性形式存在于胞质。当收到外来因素刺激时,NF-κB被激活并发生核移位,与靶基因启动子上的位点结合,启动和调节包括TNF-α、CRP、IL-6、MCP-1以及ICAM-1等多种炎症因子基因的转录[10-11]。临床资料显示[12],糖尿病血管病变过程中 NF-κB 活化伴黏附分子释放增加与血管慢性病变呈正相关,推测NF-κB的过度活化可能是血管炎性病变的关键环节。本实验中观察到糖尿病大鼠血管组织NF-κB核内水平明显高于对照组,而给予丹酚酸B可明显抑制NF-κB核移位,这一结果与丹酚酸B降低TNF-α、CRP及ICAM-1等炎症因子水平有关,提示丹酚酸B抑制糖尿病大鼠炎症反应与抑制NF-κB活化有关。NF-κB是氧化应激敏感的转录因子,高血糖可能通过诱导血管内皮细胞内活性氧产生激活NF-κB。刘江月等[13]的实验发现降糖调脂灵通过抗氧化作用抑制NF-κB核转位,从而改善糖尿病血管损伤过程。在本实验中,我们检测了大鼠的氧化应激状态,发现糖尿病大鼠氧化应激水平明显高于对照组大鼠,而给予丹酚酸B可显著改善糖尿病大鼠的氧化应激状态,提示丹酚酸B抑制NF-κB活化及炎症因子表达与其抗氧化作用有关。
综上所述,丹酚酸B可明显改善糖尿病大鼠血管舒张功能,其机制可能与其抗氧化作用,抑制NF-κB活化,减少炎症因子、趋化因子和黏附分子表达,从而减轻血管炎性病变有关。
[参考文献]
[1]李秀钧.2 型糖尿病防治策略的革命——从降糖治疗到全面防治心血管危险因素[J].中华内科杂志,2002,41(4):217-218.
[2]Ojima A,Ishibashi Y,Matsui T,et al.Glucagon-like peptide-1 receptor agonist inhibits asymmetric dimethylarginine generation in the kidney of streptozotocin-induced diabetic rats by blocking advanced glycation end product-induced protein arginine methyltrans ferase-1 expression[J].Am J Pathol,2013,182(1):132-141.
[3]Giacco F,Brownlee M.Oxidative stress and diabetic complications[J].Circ Res,2010,107(9):1058-1070.
[4]Joe Y,Zheng M,Kim HJ,et al.Salvianolic acid B exerts vasoprotective effects through the modulation of heme oxygenase-1 and arginase activities[J].J Pharmacol Exp Ther,2012,341(3):850-858.
[5]魏聪.糖尿病大血管病变的研究进展[J].上海交通大学学报:医学版,2010,30(10):1292-1295.
[6]Pradhan AD,Ridker PM.Do atherosclerosis and type 2 diabetes share a common inflammatory basis?[J].Eur Heart J,2002,23(11):831-834.
[7]Mohammad Shahi M,Zakerzadeh M,Zakerkish M,et al.Effect of sesamin supplementation on glycemic status,inflammatory markers,and adiponectin levels in patients with type 2 diabetes mellitus[J].J Dietary Supplements,2017,14(1):65-75.
[8]Kolseth IB,Reine TM,Parker K,et al.Increased levels of inflammatory mediators and proinflammatory monocytes in patients with type I diabetes mellitus and nephropathy[J].J Diabetes Complications,2017,31(1):245-252.
[9]张安邦,高杰,李令根,等.相关炎症因子与动脉粥样硬化的关系[J].中国中西医结合外科杂志,2014,20(5):563-566.
[10] 王晓晨,吉爱国.NF-κB 信号通路与炎症反应[J].生理科学进展,2014,45(1):68-71.
[11] 刘俊田.动脉粥样硬化发病的炎症机制的研究进展[J].西安交通大学学报:医学版,2015,36(2):141-152.
[12] 郭丽婷,高志红,葛焕琦.2 型糖尿病患者外周血microRNA-155、 细胞核因子-κB 和可溶性细胞间黏附分子-1 的表达及其与血管并发症的关系研究[J].中国糖尿病杂志,2017,25(3):213-217.
[13] 刘江月.降糖调脂灵抑制核因子κB核转位对 T2DM 血管内皮的损伤作用[J].时珍国医国药,2015,26(3):567-570.

