黄芩素抑制胃癌MGC-803细胞增殖和迁移*
孙沛林,朴日龙,王 莹,任香善,陈丽艳,林贞花,朴英实△
(1延边大学肿瘤研究中心,2吉林省妇科肿瘤生物信息学重点实验室,3延边大学医学院机能实验中心,吉林 延边 133000)
胃癌是全世界最常见的消化道肿瘤之一,在中国、日本和韩国等这些亚洲国家具有较高的发病率[1]。胃癌的发生发展是一个复杂的过程,其发病原因分为先天性因素和后天性因素,包括幽门螺杆菌感染、遗传和分子水平的变化等[1-2],这些因素促使正常胃黏膜上皮细胞逐渐转变为恶性细胞。目前手术切除是治疗胃癌的主要方法[3],但由于胃癌早期的症状不典型,多数患者确诊时已处于晚期,从而失去了手术治疗的机会。即使辅助化疗和放疗,胃癌患者的生活质量有所提高,但在我国五年生存率仍低于40%[3]。因此,胃癌急需寻找更为低毒、高效、多靶点的治疗方法。
黄芩素(baicalein,BAI)是黄芩根部提取的类黄酮,作为血小板型12-脂氧合酶(platelet-type 12-lipoxygenase,p12-LOX)选择性抑制剂被广泛应用于疾病研究,具有抗过敏、抗炎、改善脑血循环和抗肿瘤等作用[4]。BAI具有高效、低毒的优点。有研究发现,BAI可抑制乳腺癌、肝癌及胃癌等肿瘤细胞的增殖[5-8]。黄芩素不会导致染色体的异常和突变,在化疗时没有严重的副作用,是一种安全的潜在药物[5],但尚未见BAI对人胃癌MGC-803细胞影响的研究报道。
本研究旨在明确BAI对MGC-803细胞增殖和迁移的影响,探讨该作用的可能机制,为抗肿瘤药物黄芩素的开发应用提供理论和实验依据。
材 料 和 方 法
1 细胞株
人胃癌MGC-803细胞由延边大学肿瘤研究所提供,购自美国模式培养物保藏中心(American Type Culture Collection,ATCC)。
2 主要试剂
BAI购自Cayman Chemical;RPMI-1640细胞培养基、胎牛血清和胰蛋白酶-EDTA消化液均购自Gibco;MTT和DMSO购自Amrosco;ELISA试剂盒购自武汉伊莱瑞特生物科技有限公司;磷酸酶抑制剂购自Calbiochem;RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒、辣根过氧化物酶标记的山羊抗兔IgG (H+L)(1∶1 000)和辣根过氧化物酶标记的山羊抗鼠IgG (H+L)(1∶1 000)均购自上海碧云天生物技术有限公司;鼠抗人β-actin单克隆抗体(1∶1 000)和兔抗人p-ezrin单克隆抗体(1∶2 000)购自武汉伊莱瑞特生物科技有限公司;兔抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)单克隆抗体(1∶2 000)购自武汉三鹰生物技术有限公司;鼠抗人p12-LOX多克隆抗体(1 mg/L)和兔抗人vimentin单克隆抗体(1∶5 000)均购自Abcam;鼠抗人E-cadherin单克隆抗体(1∶1 000)和兔抗人Snail单克隆抗体(1∶1 000)均购自Cell Signaling。
3 主要方法
3.1药品配制BAI用DMSO溶解配制并-20 ℃避光保存。MTT溶液用PBS缓冲液稀释成5 g/L溶液,-20 ℃避光储存。
3.2细胞培养MGC-803细胞接种于RMPI-1640培养基(含10%胎牛血清和1%青-链霉素)中,在37 ℃、5% CO2培养箱中常规培养。当细胞融合至70%~80%时进行传代及后续实验。实验分为对照组(control)和药物组(即BAI组)。
3.3MTT比色法取对数生长期细胞常规消化并以每孔2×103个细胞接种于96孔培养板,每组设5个复孔,置37 ℃、5% CO2培养箱中孵育过夜,次日添加BAI至终浓度分别为5、10、15、25和50 μmol/L,对照组(BAI 0 μmol/L)加入与BAI同等体积的DMSO。培养12、24和48 h时每孔加入20 μL的MTT溶液继续培养4 h,离心弃上清后每孔加入100 μL的DMSO,用M200全自动酶标仪(Tecan)测定各孔吸光度(A)值,计算细胞存活率。
3.4平板集落形成实验取对数生长期细胞常规消化,梯度稀释并每孔接种100个细胞于6孔板,每组设3个复孔,不同浓度BAI连续处理1周。冷PBS缓冲液清洗3次,每孔加入2 mL无水甲醇固定5 min,伊红染色液摇床染色10 min,自来水清洗进行脱色,自然晾干,显微镜下观察、拍照并用ImageJ软件进行计数和统计分析。
3.5划痕实验取对数生长期细胞常规消化,并每孔接种2×105个细胞于6孔培养板中,每组设3个复孔,培养至形成单层细胞后换无血清培养液饥饿培养4 h,沿培养板底部正中间划“一”字型划痕,用PBS缓冲液冲洗脱落细胞。实验分为对照组和药物组,加药后培养0、24和48 h时用生物倒置显微镜(Olympus)观察并拍照,用ImageJ软件进行分析处理,计算横向迁移距离(μm)=0 h边缘距离-nh边缘距离。
3.6Transwell小室迁移实验取对数生长期细胞常规消化,按每孔3×105个细胞接种于Transwell小室,上、下室均加入含1% 胎牛血清的培养液孵育4 h,弃下室1% 胎牛血清的培养液,加入含10% 胎牛血清和BAI的新鲜培养液培养48 h,4%多聚甲醛4 ℃静置20 min固定细胞,0.1%苏木素染色8 min,自来水反蓝,无水乙醇浸泡3 min,中性树干胶封片,拍照并用IamgeJ软件进行统计结果分析。
3.7Western blot实验细胞蛋白提取后进行定量,配制SDS-PAGE凝胶,样本上样并电泳,转膜,封闭,I 抗孵育过夜,II抗孵育2 h,ChemiDoc成像系统(Bio-Rad)进行ECL曝光成像。
3.8酶联免疫吸附实验取对数生长期细胞常规消化,按每孔5×105个细胞接种于6孔细胞培养板,次日加入终浓度为5、15和25 μmol/L的BAI,对照组加入与BAI组同等浓度DMSO的等体积培养液,培养24 h,收集细胞储存于4 ℃。按12-羟基二十碳四烯酸(12-hydroxyeicosatetraenoic acid,12-HETE)ELISA试剂盒说明书操作,用M200全自动酶标仪(Tecan)在450 nm处测定各孔的吸光度(A)值。用Curve Expert 1.4软件制作标准曲线,并计算样品的12-HETE浓度。
4 统计学处理
本研究中所有实验均独立重复3次以上。实验数据应用Prism 5.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 BAI抑制胃癌MGC-803细胞的增殖
用不同浓度的BAI处理胃癌MGC-803细胞后进行MTT检测,结果显示,分别使用10 μmol/L、15 μmol/L、25 μmol/L和50 μmol/L的BAI处理MGC-803细胞24 h和48 h均可明显抑制细胞的存活率(P<0.01),见表1。分别使用5 μmol/L、15 μmol/L和25 μmol/L的BAI处理MGC-803细胞48 h,可显著下调p12-LOX和VEGF蛋白的表达(P<0.05或P<0.01),见图1A。用5 μmol/L、15 μmol/L和25 μmol/L的BAI处理MGC-803细胞24 h的ELISA实验结果显示,不同浓度的BAI均可显著下调细胞中12-HETE的浓度(P<0.05或P<0.01),见图1B。用5 μmol/L、15 μmol/L和25 μmol/L的BAI处理MGC-803细胞,也可显著抑制平板集落形成(P<0.01),见图2。
表1BAI对MGC-803胃癌细胞存活率的影响
Table 1.The effect of BAI on the viability of the gastric cancer MGC-803 cells (%.Mean±SD.n=5)
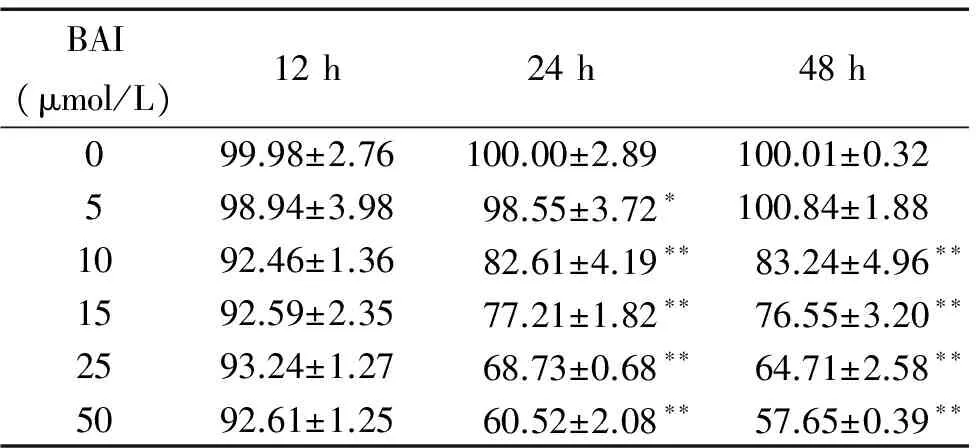
BAI(μmol/L)12h24h48h099.98±2.76100.00±2.89100.01±0.32598.94±3.9898.55±3.72∗100.84±1.881092.46±1.3682.61±4.19∗∗83.24±4.96∗∗1592.59±2.3577.21±1.82∗∗76.55±3.20∗∗2593.24±1.2768.73±0.68∗∗64.71±2.58∗∗5092.61±1.2560.52±2.08∗∗57.65±0.39∗∗
*P<0.05,**P<0.01vscontrol group.
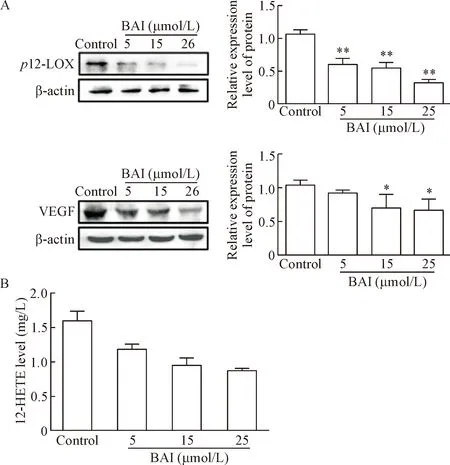
Figure 1.The effects of BAI on the protein expression ofp12-LOX and VEGF (A) and the concentration of 12-HETE (B) in the gastric cancer MGC-803 cells.Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图1BAI对MGC-803胃癌细胞p12-LOX、VEGF蛋白表达和12-HETE浓度的影响

Figure 2.The effect of BAI on colony formation ability of the MGC-803 cells.Mean±SD.n=3.**P<0.01vscontrol group.
图2BAI对MGC-803细胞集落形成能力的影响
2 BAI抑制胃癌MGC-803细胞的迁移
用5 μmol/L、15 μmol/L和25 μmol/L的BAI分别处理MGC-803细胞24 h和48 h,可显著抑制细胞的横向迁移(P<0.01),见图3A。25 μmol/L BAI还可显著抑制细胞的纵向迁移能力(P<0.01),见图3B。用5 μmol/L、15 μmol/L和25 μmol/L的BAI处理MGC-803细胞48 h,Western blot实验结果显示,p-ezrin、vimentin和Snail的蛋白水平显著降低(P<0.01),而E-cadherin的蛋白水平则显著升高(P<0.01),见图4。
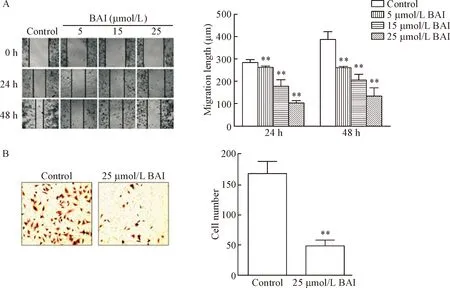
Figure 3.The effect of BAI on the migration ability of the MGC-803 cells.A:wound-healing assay (×100).B:Transwell assay (×200).Mean±SD.n=3.**P<0.01vscontrol group.
图3BAI对MGC-803细胞迁移能力的影响
讨 论
近年来胃癌的发病率和死亡率在我国乃至全世界都呈现增高的趋势,其发生与细胞的异常分化、增殖及迁移等密切相关。胃癌的发生发展与花生四烯酸(arachidonic acid,AA)的代谢途径有着密切关系。AA代谢包括环氧化酶途径、细胞色素P450氧酶途径和脂氧合酶(lipoxygenase,LOX)3条主要途径。12-LOX包括白细胞型、血小板型(p12-LOX)和表皮型3种主要类型,在正常组织中12-LOX不表达或者低表达,但在睾丸癌、前列腺癌和乳腺癌中高表达[9-11]。有研究发现,p12-LOX与黑色素瘤细胞有着紧密的联系[12]。而最近的研究也表明,p12-LOX以及其催化产物12-HETE在肿瘤的发生发展中起着重要作用,通过诱导血管内皮生成因子的表达而促进肿瘤细胞的增殖、迁移和血管生成等[13-14]。作为p12-LOX的选择性抑制剂BAI具有广泛的抗肿瘤作用而备受关注[13-16]。研究表明,10 μmol/L和25 μmol/L的BAI通过降低前列腺癌细胞的p12-LOX的表达抑制了细胞增殖[16];BAI还可抑制小鼠上皮JB6 P+(Cl 41-5a)细胞p12-LOX的mRNA和蛋白表达水平,并抑制其细胞增殖[13];p12-LOX高表达于胃癌MKN-28细胞,BAI处理MKN-28细胞可显著降低p12-LOX的mRNA表达,并显著抑制了细胞增殖[15]。

Figure 4.The effects of BAI on the protein levels of p-ezrin and EMT-related proteins in the MGC-803 cells.Mean±SD.n=3.**P<0.01vscontrol group.
图4BAI对MGC-803细胞p-Ezrin和EMT相关蛋白表达的影响
血管形成是肿瘤生长及转移的基础,其中VEGF是重要的血管内皮生长因子,在肿瘤组织中高表达[17]。研究表明,BAI可抑制人前列腺癌PC-3细胞中VEGF的表达[17]。张伟等[18]研究发现,BAI呈剂量依赖性抑制人胃癌SGC-7901中VEGF的表达。本研究结果也显示,BAI显著下调胃癌MGC-803细胞的p12-LOX、12-HETE和VEGF蛋白的表达水平,显著抑制了细胞增殖和集落形成。以上结果均提示,BAI可能通过下调p12-LOX的表达,使其催化产物12-HETE合成减少,抑制了VEGF的表达,从而抑制了胃癌细胞的增殖。
上皮-间充质转化(epithelial-mesenchymal transition,EMT)在胚胎发育、纤维化和肿瘤等的进展中起关键作用[19-21]。在EMT过程中,上皮标志物E-cadherin合成减少[22],具有上皮细胞表型的细胞角蛋白细丝被vimentin代替,使细胞的形态转变为梭形。锌指转录因子Snail的表达与E-cadherin的表达呈负相关,Snail过表达可使癌细胞失去黏附,从而促进肿瘤的浸润与迁移[23]。Liu等[24]研究发现,胃癌细胞中E-cadherin的下调增加了细胞的存活和转移。Fuyuhire等[25]的研究表明,vimentin的高表达与胃癌晚期临床分期有着直接关系。本研究结果也显示,BAI显著抑制MGC-803细胞的横向和纵向迁移能力,同时BAI处理可上调上皮标志物E-cadherin蛋白的表达,而下调间质标志物vimentin和Snail蛋白的表达。结果提示,BAI通过调控EMT相关蛋白表达有效地抑制MGC-803细胞的迁移能力。
Ezrin蛋白是细胞骨架与细胞膜之间的连接蛋白[26]。在正常组织中,ezrin蛋白广泛的分布在上皮细胞[27]。Ezrin活化时连接细胞膜与肌动蛋白丝,具有形成细胞形态、黏附、运动和细胞增殖等多种功能[28]。Ezrin过表达及磷酸化ezrin能将E-cadherin阻隔于细胞内,导致细胞之间连接松散,利于肿瘤细胞转移[26]。Jin等[29]研究表明,ezrin过表达于胃癌组织并与不良预后密切相关。本研究结果显示,BAI处理MGC-803细胞可显著下调p-ezrin蛋白表达水平,提示BAI通过下调p-ezrin蛋白的表达抑制MGC-803细胞的迁移。
综上所述,在本研究中我们证明了p12-LOX的选择性抑制剂BAI可有效抑制胃癌MGC-803细胞的增殖和迁移,其机制可能与调节p12-LOX、VEGF、p-ezrin以及EMT相关蛋白的表达变化有关。研究结果提示,中药有效成分BAI可能是治疗胃癌的有效抗肿瘤药物。
[参考文献]
[1]Sigel RL,Miller KD,Jemal A.Cancer statistics,2017 [J].CA Cancer J Clin,2017,67(1):7-30.
[2]王显艳,高峰,赵春明,等.miR-140在人胃癌组织中的表达及对SGC-7901胃癌细胞功能的影响[J].中国病理生理杂志,2016,32(4):651-657.
[3]田磊,肖秀英,叶明.胃癌分子靶向药物治疗的研究进展[J].世界华人消化杂志,2014,22(6):773-781.
[4]Guo Z,Hu X,Xing Z,et al.Baicalein inhibits prostate cancer cell growth and metastasis via the caveolin-1/AKT/mTOR pathway[J].Mol Cell Biochem,2015,406(1-2):111-119.
[5]Mu JS,Liu TR,Jiang L,et al.The traditional chinese medicine baicalein potently inhibits gastric cancer cells[J].J Cancer,2016,7(4):453-461.
[6]Singh AK,Singh R,Naz F,et al.Structure based design and synthesis of peptide inhibitor of human LOX-12:invitroandinvivoanalysis of a novel therapeutic agent for breast cancer[J].PLoS One,2012,7(2):e32521.
[7]向淼,徐细明,邓君健,等.黄芩素诱导人肝癌细胞株SMMC-7721凋亡作用的研究[J].现代肿瘤医学,2012,20(6):1908-1103.
[8]Chen FL,Wang XZ,Li JY,et al.12-Lipoxygenase induces apoptosis of human gastric cancer AGS cells via the ERK1/2 signal pathway[J].Dig Sci,2008,53(1):181-187.
[9]Yoshimura R,Matsuyama M,Mitsuhashi M,et al.Relationship between lipoxygenase and human testicular cancer[J].Int J Mol Med,2004,13(3):389-393.
[10] Matsuyama M,Yoshimura R,Mitsuhashi M,et al.Expression of lipoxygenase in human prostate cancer and growth reduction by its inhibitors[J].Int J Oncol,2004,24(4):821-827.
[11] Jiang WG,Douglas-Jones A,Mansel RE.Levels of expression of lipoxygenases and cyclooxygenase-2 in human breast cancer [J].Prostaglandins Leukot Essent Fatty Acids,2003,69(4):275-281.
[12] Raso E,Dome B,Somlai B,et al.Molecular identification,localization and function of platelet-type 12-lipoxygenase in human melanoma progression,under experimental and clinical conditions[J].Melanoma Res,2004,14(4):245-250.
[13] Piao YS,Du YC,Oshima H,et al.Platelet-type 12-lipoxygenase accelerates tumor promotion of mouse epidermal cells through enhancement of cloning efficiency[J].Carcinogenesis,2008,29(2):440-447.
[14] 刘宽浩,夏建国,丁永斌.p12-LOX抑制剂对人胃癌SGC-7901细胞的作用 [J].江苏医药,2007,33(5):497-499.
[15] 金京春,叶晶,蔡洙哲,等.血小板型12-LOX抑制剂黄芩素抑制胃癌MKN-28细胞增殖和迁移[J].肿瘤,2016,36(2):173-180.
[16] Pidgeon GP,Kandouz M,Meram A,et al.Mechanisms controlling cell cycle arrest and induction of apoptosis after 12-lipoxygenase inhibition in prostate cancer cells[J].Cancer Res,2002,62(9):2721-2727.
[17] Nie D,Krishnamoorthy S,Jin R,et al.Mechanisms regulating tumor angiogenesis by 12-lipoxygenase in prostate cancer cells[J].J Biol Chem,2006,281(27):18601-18609.
[18] 张伟,刘宽浩.黄芩素对胃癌细胞VEGF和HGF表达的影响[J].现代预防医学,2011,38(11):2135-2137.
[19] Hugo H,Ackland ML,Blick T,et al.Epithelial-mesenchymal and mesenchymal-epithelial transitions in carcinoma progression[J].J Cell Physiol,2007,213(2):374-383.
[20] Thiery JP,Sleeman JP.Complex networks orchestrate epithelial-mesenchymal transitions [J].Nat Rev Mol Cell Biol,2006,7(2):131-142.
[21] Yang J,Weinberg RA.Epithelial-mesenchymal transition:at the crossroads of development and tumor metastasis[J].Dev Cell,2008,14(6):818-829.
[22] Lamouille S,Xu J,Derynck R.Molecular mechanisms of epithelial-mesenchymal transition[J].Mol Cell Biol,2014,15(3):178-196.
[23] 赵俊卿,李云峰,杨之斌.肿瘤细胞发生细胞上皮-间质转变机制的研究[J].肿瘤,2010,30(10):890-893.
[24] Liu X,Chu KM.E-cadherin and gastric cancer:cause,consequence,and applications[J].Biomed Res Int,2014,2014:637308.
[25] Fuyuhiro Y,Yashiro M,Noda S,et al.Clinical significance of vimentin-positive gastric cancer cells [J].Anticancer Res,2010,30(12):5239-5243.
[26] Matysiak M,Kapka-Skrzypczak L,Jodowska-Jędrych B,et al.EMT promoting transcription factors as prognostic markers in human breast cancer [J].Arch Gynecol Obstet,2017,295(4):817-825.
[27] Martin TA,Harrison G,Mansel RE,et al.The role of the CD44/ezrin complex in cancer metastasis [J].Crit Rev Oncol Hematol,2003,46(2):165-186.
[28] 肖贤军,谌南武.Ezrin蛋白与肿瘤的关系[J].实用医学杂志,2009,25(6):1002-1004.
[29] Jin J,Jin T,Quan M,et al.Ezrin overexpression predicts the poor prognosis of gastric adenocarcinoma [J].Diagn Pathol,2012,7:135.

