棕榈酸通过上调脂肪酸转位酶诱导THP-1细胞的炎症反应*
张 畅,罗肖肖,晏 勇,钟 珊,赵 蕾
(重庆医科大学脂糖代谢性疾病重庆市重点实验室,脂质研究中心,重庆 400016)
动脉粥样硬化(atherosclerosis,AS)是引起冠心病和脑梗塞等心脑血管疾病的主要原因[1]。目前普遍公认AS是一种多因素引起的血管炎症性疾病,多种炎症细胞和炎症/趋化因子参与了AS的发生、发展和预后[2-3]。巨噬细胞大量吞噬胆固醇后形成泡沫细胞是AS早期的特征性病理表现,因此巨噬细胞在AS病理进程中发挥着重要的作用,可能成为治疗AS的重要靶点[4]。既往大量研究已经证实,高脂血症,尤其是高胆固醇血症与AS的形成密切相关[5]。然而,在我国高脂血症以高甘油三酯为主,甘油三酯水解后可以产生大量游离脂肪酸[6];游离脂肪酸可以刺激巨噬细胞和脂肪细胞等产生和分泌大量白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)等炎症/趋化因子,激活机体炎症反应,参与代谢综合征,如糖尿病和脂肪肝等的产生[7]。近期也有研究提示,游离脂肪酸在AS的发生发展中起着重要作用[8],但尚不清楚其具体的分子机制。
CD36,又称脂肪酸转位酶(fatty acid translocase,FAT),是一种广泛分布于单核细胞、巨噬细胞和脂肪细胞上的膜糖蛋白,其作为B类清道夫受体,可以结合多种配体,如长链游离脂肪酸和氧化性低密度脂蛋白等[9]。既往研究证实,巨噬细胞上CD36能与氧化低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)结合,促进了巨噬细胞中胆固醇的积聚,同时这种结合可以通过活化NF-κB信号通路触发炎症反应的发生,加剧AS的进展[10]。那么,游离脂肪酸能否通过上调巨噬细胞上CD36的表达,参与炎症反应的发生呢?棕榈酸(palmitate)是人体血液中含量最多的一种游离脂肪酸,广泛用于脂毒性和代谢综合征等体外研究[11]。因此本研究拟用棕榈酸处理人源单核巨噬细胞THP-1,检测其对CD36表达及炎症因子和趋化因子的影响,并构建低表达CD36的细胞模型,从而从正反两方面探讨CD36在棕榈酸诱导的巨噬细胞炎症反应中的作用。
材 料 和 方 法
1 细胞株
人源单核巨噬细胞THP-1购于美国模式培养物保存中心(American Type Culture Collection,ATCC)。
2 主要试剂
胎牛血清购于UTR;RPMI-1640培养基购于HyClone;棕榈酸和牛血清白蛋白(bovine serum albumin,BSA)购于Sigma;Trizol RNA抽提试剂盒、逆转录试剂盒及SYBR real-time PCR试剂盒购于TaKaRa;BCA蛋白含量检测试剂盒和抗β-actin兔抗人多克隆抗体购于北京鼎国公司;抗FAT/CD36兔抗人多克隆抗体购于Novus;辣根过氧化物酶标记的山羊抗兔或鼠IgG II抗购于北京中杉金桥公司;PVDF膜购于Millipore;ECL化学发光试剂购于Bio-Rad;ELISA(TNF-α和IL-6)检测试剂盒购于欣博盛公司;引物由北京华大基因公司合成。
3 主要方法
3.1细胞培养及传代方法从-80 ℃冰箱中取出THP-1细胞,37 ℃水浴锅中快速复苏,常规培养在含10%(体积分数)胎牛血清、1×105U/L青霉素G和100 mg/L链霉素的RPMI-1640完全培养基中,37 ℃、5% CO2恒温箱中培养。3~4 d传代 1 次,每2 d换液 1 次,每天将细胞吹散。
3.2细胞的诱导及处理方法给予160 nmol/L佛波酯诱导THP-1细胞分化为贴壁生长的巨噬细胞后,再用含0.2% BSA的无血清RPMI-1640培养基处理12 h后,根据既往研究[12],在本实验中给予不同浓度(0、0.1和0.2 mmol/L)的棕榈酸处理细胞,处理时间为24 h。
3.3干扰CD36表达的实验分组及处理CD36-siRNA (siCD36)由上海吉玛公司设计并合成,正义链为5’-GGCUGUGUUUGGAGGUAUUCUTT-3’,反义链为3’-TTCCGACACAAACCUCCAUAAGA-5’;阴性对照(scrambled RNA,scrRNA)亦由该公司提供。将THP-1接种于6孔板或Transwell小室,用scrRNA及siCD36分别转染THP1细胞:50 μL RPMI-1640培养基加入0.5 μg siRNA,短暂轻柔涡旋,加入1.5 μL X-TremeGENETMHP DNA Transfection Reagent,短暂轻柔涡旋,室温孵育15 min(15~25 ℃),将转染复合物逐滴加入到THP-1源性巨噬细胞中12 h,加入佛波酯诱导THP-1贴壁分化成巨噬细胞,再用无血清培养基饥饿细胞,并给予棕榈酸(0.2 mmol/L)负荷处理24 h,进行后续实验。
3.4Western blot实验取对数生长期的THP-1细胞常规诱导接种于6 cm皿中,饥饿处理12 h后,给予不同浓度的棕榈酸(0 mmol/L、0.1 mmol/L、0.2 mmol/L)处理24 h。收集细胞,PBS洗涤细胞3次,加RIPA(含蛋白酶抑制剂)400 μL,冰上裂解30 min。4 ℃、12 000×g离心15 min,吸取上清液,用BCA法进行蛋白定量。取50 μg蛋白经8% SDS-PAGE分离蛋白,PVDF膜转膜后,5% BSA室温封闭1 h后,加入抗CD36和β-actin抗体(1∶3 000稀释)4 ℃孵育过夜,TBST洗膜3次,每次10 min,II抗37 ℃摇床孵育1 h,TBST清洗2次,每次15 min,最后用TBS洗涤1次,利用化学发光剂ECL显色曝光,采用ImageJ软件进行分析。
3.5Real-time PCR检测mRNA的表达取对数生长期的细胞常规诱导接种于6孔板,待饥饿12 h后,给予棕榈酸处理24 h,按照Trizol试剂盒说明,提取细胞中总RNA并检测其含量和纯度,按照逆转录试剂盒说明书合成cDNA,反应条件为:42 ℃ 30 min、85 ℃ 5 min、4 ℃ 5 min后终止。反应产物置于-20 ℃保存。运用OneStep RT-PCR进行荧光定量PCR反应,反应条件为:94 ℃预变性1 min;94 ℃变性10 s、54 ℃退火10 s、72 ℃延伸10 s,进行39个循环。记录每个标本和内参的Ct值,以2-ΔΔCt法计算目的基因的相对表达量,引物序列见表1。

表1 Real-time PCR的上、下游引物序列Table 1.The sequences of the primers for real-time PCR
3.6Transwell小室迁移实验参照Ding等[13]用Transwell迁移实验检测THP-1细胞迁移的方法,调整THP-1细胞悬液浓度至4×108/L,取300 μL加入到Transwell迁移系统的上室小室中(Corning),再将上层小室放入培养孔中诱导贴壁后,换成含0.2% BSA的无血清DMEM培养基培养12 h,给予棕榈酸(0.1 mmol/L),37 ℃、5% CO2培养24 h后,PBS清洗细胞小室上层腔室3次,4%多聚甲醛溶液固定20 min,0.5%结晶紫染色,用棉棒仔细去除上层小室侧未迁移的细胞,用倒置显微镜随机选取6个视野进行拍片(×200倍),并统计迁移至下室的平均细胞数量。
3.7ELISA法检测THP-1细胞上清液中TNF-α和IL-6的水平取对数生长期的THP-1细胞,调整细胞悬液浓度为4×108/L,接种于6孔板,每孔2 mL,常规诱导贴壁24 h后,设空白组、棕榈酸(0.1 mmol/L)组、棕榈酸(0.2 mmol/L)组、scrRNA组和siCD36组,每组3个复孔,培养24 h后,用ELISA试剂盒检测细胞上清液中TNF-α和IL-6的水平,同时用BCA法检测蛋白浓度,对其含量进行标化。
4 统计学处理
采用SPSS 17.0统计软件进行统计学分析,数据用均数±标准差(mean±SD)表示,两组间均数比较采用独立样本t检验,多组间均数的比较采用单因素方差分析(one-way ANOVA),总体差异有统计学意义情况下,两两比较采用最小显著差异法(LSD检验)。以P<0.05为差异有统计学意义。
结 果
1 棕榈酸对THP-1细胞CD36表达的影响
给予不同浓度棕榈酸处理THP-1细胞24 h后,分别用real-time PCR和Western blot法检测THP-1细胞内CD36的mRNA及蛋白表达水平。结果发现,给予棕榈酸处理THP-1细胞后,CD36 mRNA和蛋白表达明显上调(P<0.05),见图1。
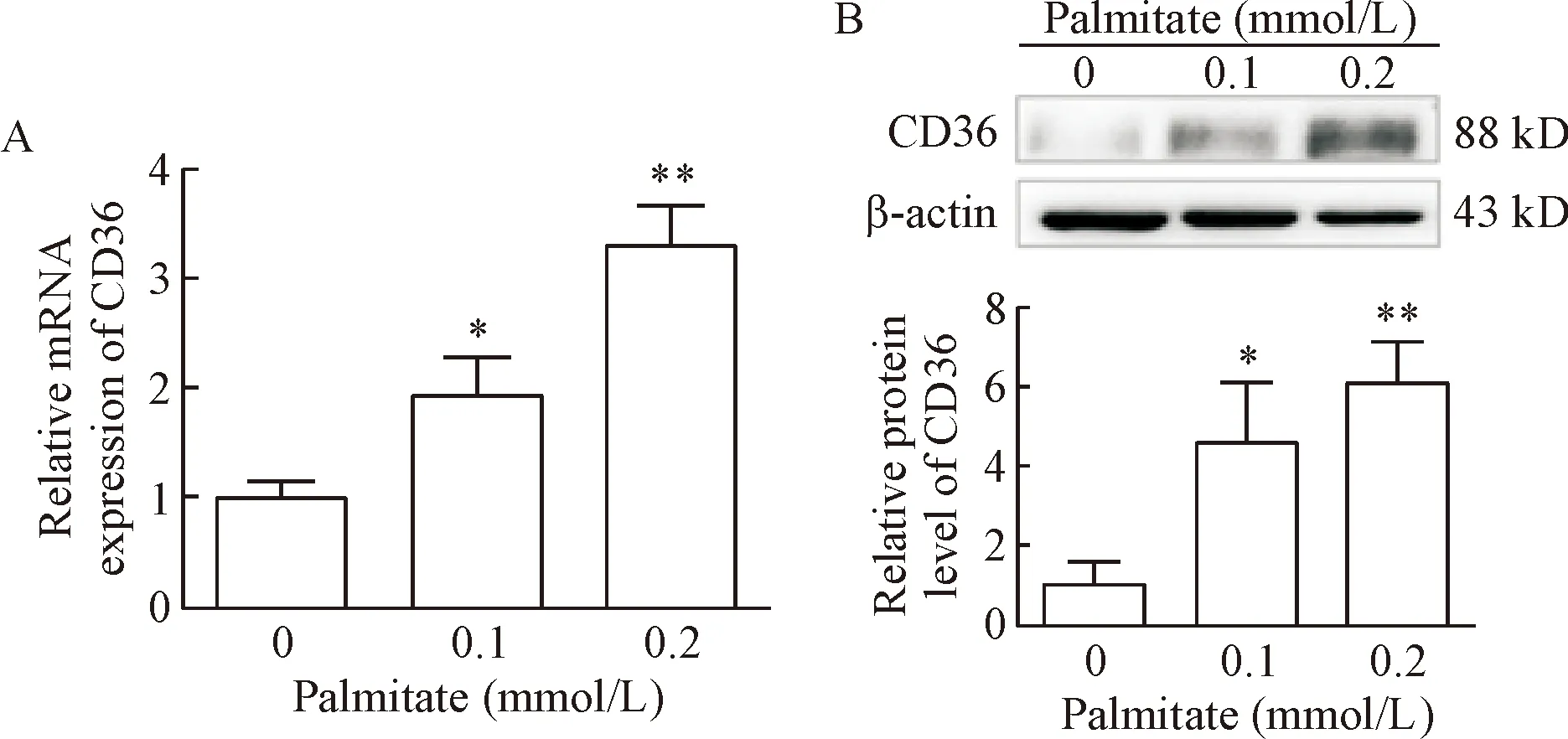
Figure 1.The effect of palmitate on the expression of CD36 in the THP-1 cells.A:the mRNA level of CD36 determined by real-time PCR; B:the protein expression of CD36 detected by Western blot.Mean±SD.n=6 or 3.*P<0.05,**P<0.01vs0 mmol/L group.
图1棕榈酸对THP-1细胞CD36表达的影响
2 棕榈酸对THP-1细胞炎症因子及趋化因子表达的影响
给于不同浓度棕榈酸处理THP-1细胞24 h后,利用real-time PCR检测炎症因子TNF-α和IL-6及趋化因子MCP-1的mRNA水平。结果发现,与对照组相比,棕榈酸处理THP-1细胞后,炎症因子和趋化因子表达均明显增加(P<0.05),见图2A。
收集以上细胞的上清液,用ELISA方法检测细胞上清液中炎症因子TNF-α和IL-6的水平,结果发现,与对照组相比,棕榈酸处理THP-1细胞后,炎症因子的蛋白表达水平明显增加(P<0.05),见图2B。

Figure 2.The effect of palmitate on the expression of inflammatory cytokines and chemokines in THP-1 cells.A:the mRNA levels of inflammatory cytokines and chemokine determined by real-time PCR; B:the protein levels of inflammatory cytokines in supernatant detected by ELISA.Mean±SD.n=6.*P<0.05,**P<0.01vs0 mmol/L group.
图2棕榈酸对THP-1细胞炎症因子及趋化因子表达的影响
3 棕榈酸对THP-1细胞迁移水平的影响
常规诱导THP-1细胞后,给予THP-1细胞棕榈酸(0.1 mmol/L)处理24 h后,Transwell实验检测细胞迁移情况。结果发现,与对照组相比,给予棕榈酸处理,THP-1细胞的迁移能力明显增加,差异有统计学意义(P<0.01),见图3。

Figure 3.The effect of palmitate on the migration ability of the THP-1 cells measured by Transwell assay (×200).Mean±SD.n=5.**P<0.01vs0 mmol/L group.
图3棕榈酸对THP-1细胞迁移cel能力的影响
4 低表达CD36的THP-1细胞模型的建立及对炎症因子表达的影响
将siCD36及scrRNA瞬时转入THP-1细胞,构建CD36基因沉默的THP-1细胞和阴性对照THP-1细胞。利用Western blot法检测CD36蛋白表达情况,结果显示,与scrRNA组比较,siCD36组蛋白表达显著降低(P<0.01),见图4A。这表明沉默CD36基因的THP-1细胞模型建立成功。
在scrRNA组和siCD36组的THP-1细胞给予棕榈酸(0.2 mmol/L)负荷处理24 h后,采用real-time PCR检测炎症因子TNF-α和IL-6的mRNA表达情况。结果表明,CD36被干扰后,THP-1细胞炎症因子表达明显降低,炎症反应减弱,差异有统计学意义(P<0.05),见图4B。
收集细胞上清液,运用ELISA方法检测细胞上清液中炎症因子TNF-α和IL-6的水平,与对照组相比,CD36被干扰后,THP-1细胞炎症因子蛋白表达水平明显降低,炎症反应减弱,差异有统计学意义(P<0.05),见图4C。
5 抑制CD36表达对THP-1细胞迁移的影响
给予scrRNA组和siCD36组细胞棕榈酸处理24 h,Transwell法检测2组细胞迁移能力,结果显示,相比于scrRNA组,siCD36组细胞迁移数量明显减少(P<0.05),表明该组细胞的迁移能力降低,见图5。

Figure 4.Knockdown ofCD36 expression by RNA interference (siCD36) in the THP-1 cells.A:the effect of siCD36 on CD36 protein expression in the THP-1 cells detected by Westem blot; B:the mRNA of inflammatory cytokines detected by real-time PCR; C:the protein levels of inflammatory cytokines in the cultured supernatant detected by ELISA.Mean±SD.n=3 or 6.*P<0.05,**P<0.01vsscrambled RNA (scrRNA) group.
图4干扰THP-1细胞CD36基因表达效果检测
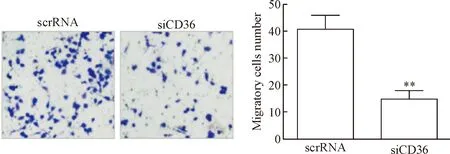
Figure 5.The effect ofCD36 expression knockdown (siCD36) on the THP-1 cell migration ability (×200).Mean±SD.n=5.**P<0.01vsscrambled RNA (scrRNA) group.
图5CD36基因沉默对THP-1细胞迁移能力的影响
讨 论
随着生活水平的提高,动脉粥样硬化的发病率逐年上升,已经成为威胁人类健康的一大杀手。目前已经公认,动脉粥样硬化是一种炎症性疾病,巨噬细胞是介导动脉粥样硬化病变炎症反应中的重要细胞来源。高脂肪酸血症与动脉粥样硬化的发生呈正相关[14],棕榈酸(C16:0)不仅是血清中含量最高的游离脂肪酸,也是人体游离脂肪酸致炎的主要成分[15]。因此探讨棕榈酸对巨噬细胞炎症反应的影响并探讨其发生机制,对防治AS及其相关心脑血管疾病具有非常重要的意义。
CD36作为B类清道夫受体,是多种细胞上表达的膜糖蛋白,可识别较多致炎的内源性代谢产物,如oxLDL、饱和脂肪酸及淀粉样蛋白等[16],可促进单核细胞聚集及促进炎症反应,在动脉粥样硬化发生发展中起关键作用[17]。CD36在动脉粥样硬化患者动脉斑块的表达明显高于正常人。流行病学调查结果也显示:高表达的血浆可溶性CD36(soluble CD36,sCD36)会增加患动脉粥样硬化、胰岛素抵抗及脂肪肝的风险[18]。
既往研究多关注CD36在介导oxLDL的摄取,导致泡沫细胞形成中的作用[19]。本研究发现棕榈酸可以显著上调THP-1细胞CD36的表达。推测其可能机制为棕榈酸及其代谢产物可直接激活转录因子过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-gamma,PPAR-γ),促进CD36的转录[20];而且棕榈酸可以明显促进CD36条带由寡核糖体部分向多聚核糖体发生偏移,增强CD36蛋白的翻译[21]。同时,我们还发现棕榈酸可以显著上调THP-1细胞中炎症因子及趋化因子,并且促进了THP-1细胞的迁移。进一步,我们构建了低表达CD36的THP-1细胞,发现抑制CD36表达可以明显改善棕榈酸诱导的THP-1巨噬细胞迁移、炎症因子及趋化因子表达的增加。既往研究提示,CD36的配体oxLDL和β-淀粉样蛋白可以促进巨噬细胞CD36募集Toll样受体4和6(Toll-like receptor 4/6,TLR4/6),形成CD36/TLRs共聚体,激活NF-κB通路,触发无菌性炎症的发生[22]。我们推测棕榈酸可能也通过类似的信号通路激活了巨噬细胞炎症反应,但具体机制尚有待后续实验验证。
综上所述,棕榈酸能够上调THP-1巨噬细胞CD36表达,促进THP-1细胞迁移并促进其产生大量炎症因子及趋化因子。抑制CD36可以明显抑制巨噬细胞迁移、降低THP-1细胞的炎症因子的表达,从而改善炎症反应。因此CD36在棕榈酸介导的THP-1细胞炎症反应中起到重要作用,这可能为临床治疗及预防动脉粥样硬化提供了新的思路。
[参考文献]
[1]Lusis AJ.Atherosclerosis[J].Nature,2000,407(6801):233-241.
[2]Ross R.Atherosclerosis is an inflammatory disease[J].Am Heart J,1999,138(5 Pt 2):S419-S420.
[3]McLaren JE,Michael DR,Ashlin TG,et al.Cytokines,macrophage lipid metabolism and foam cells:implications for cardiovascular disease therapy[J].Prog Lipid Res,2011,50(4):331-347.
[4]Rojas J,Salazar J,Martinez MS,et al.Macrophage heterogeneity and plasticity:impact of macrophage biomarkers on atherosclerosis[J].Scientifica (Cairo),2015,2015:851252.
[5]Steinberg D.Lewis A.Conner Memorial Lecture.Oxidative modification of LDL and atherogenesis[J].Circulation,1997,95(4):1062-1071.
[6]赵文华,张坚,由悦,等.中国18岁及以上人群血脂异常流行特点研究[J].中华预防医学杂志,2005,39(5):12-16.
[7]Mattace RG,Simeoli R,Russo R,et al.Effects of sodium butyrate and its synthetic amide derivative on liver inflammation and glucose tolerance in an animal model of steatosis induced by high fat diet[J].PLoS One,2013,8(7):e68626.
[8]Plonka-Poltorak E,Zagrodzki P,Kryczyk-Koziol J,et al.Does valproate therapy in epileptic patients contribute to changing atherosclerosis risk factors? The role of lipids and free fatty acids[J].Pharmacol Rep,2016,68(6):1339-1344.
[9]Hua W,Huang HZ,Tan LT,et al.CD36 mediated fatty acid-induced podocyte apoptosis via oxidative stress[J].PLoS One,2015,10(5):e127507.
[10] Janabi M,Yamashita S,Hirano K,et al.Oxidized LDL-induced NF-κB activation and subsequent expression of proinflammatory genes are defective in monocyte-derived macrophages from CD36-deficient patients[J].Arterioscler Thromb Vasc Biol,2000,20(8):1953-1960.
[11] Miura K,Yang L,van Rooijen N,et al.Toll-like receptor 2 and palmitic acid cooperatively contribute to the development of nonalcoholic steatohepatitis through inflammasome activation in mice[J].Hepatology,2013,57(2):577-589.
[12] Tian H,Liu C,Zou X,et al.MiRNA-194 regulates palmitic acid-induced Toll-like receptor 4 inflammatory responses in THP-1 cells[J].Nutrients,2015,7(5):3483-3496.
[13] Ding Y,Milosavljevic T,Alahari SK.Nischarin inhibits LIM kinase to regulate cofilin phosphorylation and cell invasion[J].Mol Cell Biol,2008,28(11):3742-3756.
[14] Pirro M,Mauriege P,Tchernof A,et al.Plasma free fatty acid levels and the risk of ischemic heart disease in men:prospective results from the Quebec Cardiovascular Study[J].Atherosclerosis,2002,160(2):377-384.
[15] Asrih M,Montessuit C,Philippe J,et al.Free fatty acids impair FGF21 action in hepG2 cells[J].Cell Physiol Biochem,2015,37(5):1767-1778.
[16] Zhou D,Samovski D,Okunade AL,et al.CD36 level and trafficking are determinants of lipolysis in adipocytes[J].FASEB J,2012,26(11):4733-4742.
[17] Park YM.CD36,a scavenger receptor implicated in athe-rosclerosis[J].Exp Mol Med,2014,46:e99.
[18] Handberg A,Hojlund K,Gastaldelli A,et al.Plasma sCD36 is associated with markers of atherosclerosis,insulin resistance and fatty liver in a nondiabetic healthy population[J].J Intern Med,2012,271(3):294-304.
[19] Sini S,Deepa D,Harikrishnan S,et al.High-density li-poprotein from subjects with coronary artery disease promotes macrophage foam cell formation:role of scavenger receptor CD36 and ERK/MAPK signaling[J].Mol Cell Biochem,2017,427(1-2):23-34.
[20] Madonna R,Salerni S,Schiavone D,et al.Omega-3 fatty acids attenuate constitutive and insulin-induced CD36 expression through a suppression of PPAR α/γ activity in microvascular endothelial cells[J].Thromb Haemost,2011,106(3):500-510.
[21] 谢云霞,赵蕾,张艳艳,等.棕榈酸上调FAT/CD36表达致HepG2细胞脂质积聚的机制研究[J].第三军医大学学报,2015,37(13):1308-1313.
[22] Stewart CR,Stuart LM,Wilkinson K,et al.CD36 ligands promote sterile inflammation through assembly of a Toll-like receptor 4 and 6 heterodimer[J].Nat Immunol,2010,11(2):155-161.

