溶酶体组织蛋白酶参与宰后牛肉AIF介导细胞凋亡研究
张佳莹 余群力 韩 玲 李 航 殷元虎 韩明山
(1.甘肃农业大学食品科学与工程学院, 兰州 730070; 2.重庆恒都农业开发有限公司, 丰都 408200;3.黑龙江畜牧兽医研究所, 齐齐哈尔 161000; 4.内蒙古科尔沁牛业股份有限公司, 通辽 028000)
0 引言
细胞凋亡已知有3条发生途径:第1条途径涉及细胞色素c (Cytochrome c, Cyt-c)的释放及半胱氨酸蛋白酶家族(Caspase)效应酶Caspase-3的激活,称为内源线粒体途径;第2条由Caspase-8和Caspase-10的激活所介导,称为外源死亡受体途径;第3条,即激活Caspase-12介导凋亡的发生,称为内质网应激途径[1]。宰后成熟过程中肉的嫩化是一个复杂的生化过程,而用细胞凋亡理论来解释肉类宰后嫩化机制是当前研究的热点[2]。动物屠宰后,切断了肌肉组织与外界环境的主要沟通,骨骼肌由于缺血缺氧而迅速发生细胞凋亡,这一凋亡过程依赖于内源线粒体途径。因此,线粒体途径的研究仍然是肉类科学领域的热点。ORRENIUS[3]表明线粒体对细胞凋亡的调控发挥至关重要的作用,指出位于线粒体内膜的不同促凋亡蛋白释放到胞浆中介导凋亡发生。
目前,线粒体途径比较明确的是Cyt-c介导的Caspase依赖性途径,即Cyt-c释放到胞浆后,在dATP存在的条件下与凋亡相关因子-1(Apaf-1)结合,使其形成多聚体,并促使Caspase-9与其结合形成凋亡小体。Caspase-9被激活后活化下游效应酶Caspase-3,诱导细胞凋亡的发生[4]。这条途径在宰后成熟过程及细胞培养中都已得到广泛的研究[5-6]。但是,在某些凋亡模型中,Caspase的广谱抑制剂并不能完全阻止细胞凋亡的发生,由此出现了另外一条独立于Caspase的线粒体凋亡途径,即凋亡诱导因子(AIF)途径[7]。AIF能够从线粒体中释放并进一步引发细胞核裂解。然而,在牛肉宰后成熟过程中,AIF是否发生了表达并介导细胞核发生凋亡,目前尚不清楚。
除线粒体外,研究表明溶酶体与凋亡信号密切相关[8]。在某些病理条件下或者细胞成熟老化过程中,溶酶体完整性受到破坏,造成溶酶体蛋白酶如组织蛋白酶的释放,这些蛋白酶直接或间接导致线粒体膜通透性发生改变,使线粒体促凋亡因子释放到胞质中,诱导细胞发生凋亡[9]。ZUZARTE-LUIS等[10]在研究胚胎细胞凋亡过程时发现,溶酶体组织蛋白酶有利于线粒体凋亡因子释放到胞浆中,而组织蛋白酶D被认为能够诱导AIF的释放。但是,溶酶体组织蛋白酶在宰后牛肉成熟期间是否被活化,其参与AIF激活的机制如何,国内外未见报道。因此,有必要研究组织蛋白酶参与牛肉宰后成熟过程中AIF介导的细胞凋亡过程,为全面阐明线粒体途径提供新机制。
因此,本文研究牛肉宰后成熟过程中活性氧(ROS)的生成、溶酶体膜完整性、组织蛋白酶活性、线粒体膜通透性、AIF的表达及细胞核形态的变化,从而确认AIF是否在牛肉宰后成熟期间发生表达并介导细胞凋亡发生,组织蛋白酶是否被活化,最终明确组织蛋白酶参与AIF激活机制,以期为牛肉宰后成熟过程中细胞凋亡线粒体途径提供更为全面的研究机制。
1 材料与方法
1.1 材料与试剂
试验材料:试验肉牛由甘肃康美现代农牧产业集团有限公司提供。选取发育正常、健康无病、体重均匀((450±50) kg)的2~3岁西门塔尔杂交牛6头,宰前禁食16 h,禁水2 h。
试验试剂:Tris、Hepes、Anti-AIF抗体、Triton X-100、Z-Phe-Arg-AMC、Z-Phe-Arg-AMC、DCFH-DA、CHAPS,均属色谱纯,购于Sigma公司;蔗糖、醋酸钠、半胱氨酸、NaCl、KCl、EDTA、甘露醇、血红蛋白、Tween 20、显影粉、定影粉、十二烷基磺酸钠、酒石酸钾钠、丙烯酰胺,均属分析纯,购于天津光复科技发展有限公司。
1.2 主要仪器设备
RF5301-PC型荧光分光光度计,日本岛津公司;H2050R型冷冻离心机,湘仪离心机仪器有限公司;Spectramax M2型酶标仪,日本岛津公司;YDS-10型恒温水浴锅,四川西亚化工有限公司;UV2550型紫外可见分光光度计,日本岛津公司;JJ-2型高速组织捣碎机,江苏金坛市亿通电子有限公司;170-8280型化学发光成像系统,上海天能科技有限公司。
1.3 试验方法
1.3.1样本采集和制备
肉牛宰后30 min内取其背最长肌为试验对象,随后从背最长肌取下约15 g样品,用锡箔纸包裹,立即放入液氮中,作为0 h的样品。其余90 g肉样真空包装置于冰袋中,45 min内运回实验室,于4℃条件下分别成熟6、12、24、72、120、168 h,作为常规成熟样品。在每个成熟时间点,与0 h作相同的处理。所有样本贮藏于-80℃待测。
1.3.2ROS含量
参照张玉林[11]的研究方法。0.5 g肌肉样本放入3 mL缓冲液(10 mmol/L Tris-HCl, 10 mmol/L 蔗糖, 0.1 mmol/L EDTA-2Na, 0.008 g/mL NaCl, pH值7.4)中破碎,12 000 r/min匀浆1 min,匀浆液于3 000g、4℃离心15 min,收集上清液,双缩脲法测定上清液蛋白浓度。随后,取上清液100 μL,与100 μL反应缓冲液(10 mmol/L Tris-HCl, 10 mmol/L 蔗糖, 0.1 mmol/L EDTA-2Na, 0.008 g/mL NaCl, 10 μmol/L DCFH-DA, pH值7.4)在酶标板内迅速混合,酶标仪测定其荧光值。上述混合液于37℃孵育30 min后,测定其荧光值,ROS相对含量计算公式为
CROS=W(F2-F1)/FT
式中CROS——ROS相对含量,mg/(L·min)
F2——孵育后的荧光值
F1——孵育前的荧光值
FT——孵育时间,min
W——蛋白质量浓度,mg/L
1.3.3溶酶体膜稳定性
采用差速离心法分离肌肉组织溶酶体。1 g肌肉样本置于预冷的0.25 mol/L蔗糖-Tris缓冲液中破碎,洗去残余血液,加入9 mL蔗糖-Tris溶液匀浆,匀浆液于1 000g、4℃离心15 min,取上清液再于10 000g、4℃离心20 min,收集上清液,用于游离组织蛋白酶D的测定(表示溶酶体外的酶活性)。用0.1%Triton X-100重新悬浮沉淀物,置37℃加热30 min,再于10 000g、4℃离心20 min,取上清液用于测定结合的组织蛋白酶D活性(表示存在于溶酶体内的酶活性),计算游离酶活性与结合活性两者之间的百分比,即溶酶体膜稳定性。
1.3.4组织蛋白酶活性
参照TIAN等[12]方法,并稍作修改。50 g肌肉样本切碎后置于2倍体积预冷匀浆液(50 mmol/L醋酸钠,pH值5.0,含7 mmol/L半胱氨酸,0.9 mmol/L苯甲基磺酰氟)中,匀浆后搅拌2 h并于12 000g、4℃离心30 min,收集上清液贮藏于-80℃用于组织蛋白酶活性测定。采用双缩脲法测定蛋白浓度。组织蛋白酶L、B活力测定方法如下:反应体系由298 μL反应混合液(16 μL 0.05 g/mL Brij-35, 6 μL 0.05 g/mL CHAPS, 1 μL 1.4 mol/L 2-巯基乙醇, 5 μL荧光底物,70 μL 0.4 mmol/L 乙酸,200 μL蛋白提取液)组成。40℃水浴2 min后加入荧光底物Z-Phe-Arg-AMC (L)和Z-Phe-Arg-AMC (B)。反应30 min后加入3.0 mL 0.1 mol/L的乙酸钠终止反应,在激发波长380 nm、发射波长460 nm条件下测定荧光强度。酶活力单位(U)定义为每分钟内催化1 μmol底物转化为产物所需的酶量。组织蛋白酶D活力测定方法如下:反应体系由1 000 μL反应混合液(250 μL 0.02 g/mL血红蛋白,250 μL 0.2 mmol/L 乙酸,500 μL蛋白提取液)组成。37℃反应30 min后加入125 μL 10%三氯乙酸终止反应,595 nm处测定吸光度。酶活力单位(U)用每分钟每克肉样的吸光度来表示。
1.3.5线粒体膜通透性
参照陈骋等[13]的方法。10 g肉样切碎后加入100 mL分离液(250 mmol/L蔗糖、10 mmol/L Tris-HCl、1 mmol/L EDTA,pH值7.4),12 000 r/min转速下匀浆2 min,于1 500g、4℃离心15 min,收集上清液再次在12 000g、4℃条件下离心20 min,所得沉淀即为线粒体。将线粒体沉淀与5 mL测试介质(230 mmol/L甘露醇、70 mmol/L蔗糖和3 mmol/L Hepes,pH值7.4)混合,使用前用测试介质稀释至3 mg/mL蛋白质量浓度。迅速将稀释好的线粒体溶液300 μL加入到2 700 μL测定介质中,25℃孵育3 min后,以3 mL测定介质作为对照,于540 nm波长下测定吸光度。
1.3.6AIF蛋白表达
采用12.5%的分离胶和4%的浓缩胶。取蛋白样品上样,每条泳道上样100 μg总蛋白,电泳分离后将凝胶中的蛋白转移到PVDF膜上,PVDF膜在含5%脱脂奶粉的TTBS (0.05% Tween 20, 50 mmol/L Tris-HCl, 150 mmol/L NaCl, 5 mmol/L KCl, pH值7.5)溶液中室温(20℃)下封闭1 h。加入适量一抗,于4℃下反应12 h。将膜取出放入TBST洗膜盒中,在室温条件下清洗3次,每次10 min,随后采用1∶3 000稀释的辣根过氧化物酶标记的羊抗兔免疫球蛋白抗体于室温条件下孵育1 h,再次清洗3次,将其放入化学发光成像系统成像。
1.3.7细胞核HE染色
不同成熟时间点的样本在10%的福尔马林溶液中固定24 h,脱水、石蜡包埋后切成10 μm的组织切片,固定于经APES包被的载玻片上,晾片5 min后苏木精染色3 min,二甲苯通透,中性树胶封片。制备好的玻片在显微镜下进行观察,并对细胞核形态进行拍照。
1.3.8统计分析
试验结果用SPSS 19.0软件进行方差分析(P<0.05),Origin 8.0软件制图。所有结果均采用平均值±标准差来表示,至少重复3次。
2 结果与分析
2.1 ROS相对含量
由图1可知,牛肉在宰后成熟过程中ROS相对含量呈现先降低后上升的趋势。宰后6 h,ROS相对含量显著降低(P<0.05),随着成熟时间的延长,ROS相对含量呈现升高的趋势(P<0.05),直至宰后120 h后无显著变化。

图1 牛肉宰后成熟过程中ROS相对含量变化Fig.1 Changes in ROS content of bovine muscle during postmortem aging
2.2 溶酶体膜稳定性
由图2可知,宰后牛肉成熟过程中溶酶体膜稳定性呈现逐渐降低的趋势。宰后0~6 h,溶酶体膜稳定性没有显著差异,随着宰后成熟时间的增加,溶酶体膜稳定性显著降低(P<0.05)。
2.3 组织蛋白酶活性
由图3可知,牛肉宰后成熟过程中组织蛋白酶B、D和L的活力呈上升的趋势。宰后0~6 h,组织蛋白酶活力均无显著性变化,随着成熟时间的延长,三者的活力均显著升高 (P<0.05)。组织蛋白酶B活力从宰后0 h的134.75 U上升至宰后168 h的219.28 U,组织蛋白酶D活力从宰后0 h的0.173 U上升至宰后168 h的0.829 U,组织蛋白酶L活力从宰后0 h的1 484.13 U上升至宰后168 h的1 923.39 U。

图2 牛肉宰后成熟过程中溶酶体膜稳定性变化Fig.2 Changes in lysosomal membrane stability of bovine muscle during postmortem aging

图3 牛肉宰后成熟过程中组织蛋白酶B、组织蛋白酶D和组织蛋白酶L活力变化Fig.3 Changes in cathepsins B, D and L activities of bovine muscle during postmortem aging
2.4 线粒体膜通透性
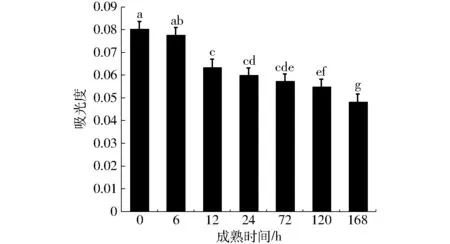
图4 牛肉宰后成熟过程中线粒体膜通透性变化Fig.4 Changes in mitochondrial membrane permeability of bovine muscle during postmortem aging
由图4可知,线粒体悬浮液在520 nm处的吸光度呈现降低的趋势,说明牛肉宰后成熟过程中线粒体膜通透性逐渐增大。宰后0~6 h,线粒体膜通透性变化不显著,6~12 h线粒体膜通透性显著升高 (P<0.05),之后随着成熟时间的延长,线粒体膜通透性呈增大的趋势,但变化并不显著。
2.5 凋亡诱导因子蛋白表达
由图5可知,宰后0~12 h牛肉中AIF(凋亡诱导因子)在线粒体中的表达量显著增加(P<0.05),而在宰后12~168 h的成熟时间中,AIF的表达量显著降低。宰后牛肉成熟过程中AIF在细胞核中的表达量呈上升的趋势。宰后6 h没有显著变化,6~12 h显著增加(P<0.05),在随后的成熟时间里基本没有显著变化。
2.6 细胞核形态
由图6可知,采用HE染色法对宰后成熟过程中的牛肉细胞核进行检测,DAPI染料将细胞核标记为蓝色荧光。宰后0~168 h成熟过程中,细胞核体积逐渐增大,部分核溶解,并伴随着细胞皱缩、细胞间隙变大的现象。
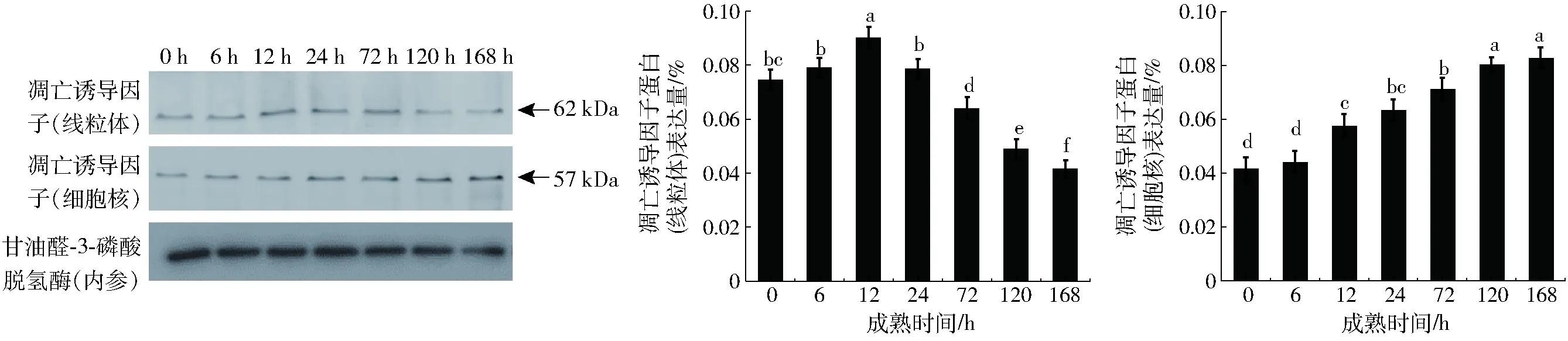
图5 牛肉宰后成熟过程中凋亡诱导因子表达分析Fig.5 Western blotting analysis of relative changes in expression of AIF of bovine muscle during postmortem aging

图6 牛肉宰后成熟过程中细胞核形态变化Fig.6 Changes in nuclear morphology of bovine muscle during postmortem aging
3 讨论
近年来,由于线粒体Caspase依赖性途径与宰后肉类嫩化密切相关,因此成为研究的热点。尽管之前有研究报道了宰后成熟过程中Cyt-c介导的Caspase依赖性线粒体途径[14-15],但是线粒体凋亡途径是极其复杂的,因此宰后成熟过程中牛肉骨骼肌的凋亡途径及机制仍存在争议。线粒体除释放Cyt-c外,还能释放其它蛋白(如AIF)诱导凋亡的发生。那么,牛肉在宰后成熟过程中,线粒体AIF蛋白是否被激活从而介导凋亡的发生,组织蛋白酶是否被活化,其参与AIF激活的机制如何,目前并不清楚。因此本文旨在研究牛肉宰后成熟过程中组织蛋白酶参与AIF释放及线粒体AIF激活并介导细胞凋亡发生的机制。
ROS的产生是不可避免的,宰后成熟过程引起细胞内ROS的增加,使细胞处于氧化应激状态。本试验中,宰后6 h ROS相对含量降低,可能与肌细胞中抗氧化酶的存在有关。宰后初期,细胞液中的谷胱甘肽还原系统及超氧化物歧化酶会清除部分ROS,而随着成熟时间的延长,细胞内环境逐渐恶化,抗氧化酶活性降低甚至完全失活,还原系统也遭到破坏,导致后期ROS在细胞的大量堆积[16]。此外,ROS在概念上类似于其他信号物质,如Ca2+。Ca2+能够作用于线粒体,影响其通透性的改变,从而引发细胞凋亡。同样,ROS的大量累积,造成组织器官失常,诱导凋亡发生[17]。WANG等[18]在研究线粒体凋亡因子对宰后成熟过程中牦牛肉嫩度影响时表明,宰后成熟过程中ROS的含量显著增加,改变了线粒体电子呼吸链,加速了细胞凋亡的发生。CAI等[19]指出在多种细胞凋亡因素的刺激下,细胞内ROS的增加导致溶酶体膜通透和细胞死亡。因此,宰后成熟过程中牛肉细胞ROS含量增加,可能刺激溶酶体膜稳定性发生变化。
研究发现,溶酶体在细胞凋亡中起着重要作用。在氧化应激条件下,溶酶体酶能够激活细胞凋亡酶,预示着溶酶体参与细胞凋亡的调控,至此,溶酶体在细胞凋亡过程中的重要作用才得到广泛的关注[20]。溶酶体诱导凋亡的关键步骤是溶酶体膜失稳,导致溶酶体蛋白酶释放到胞浆中启动凋亡的发生。本文研究结果表明,宰后牛肉成熟过程中,溶酶体膜的稳定性逐渐降低。REPNIK等[21]研究表明造成溶酶体膜稳定性失衡的因素有很多,其中研究最广泛的就是ROS。组织蛋白酶存在于溶酶体细胞器中,帮助维持细胞新陈代谢。当溶酶体膜失稳后,组织蛋白酶释放到胞浆中,启动溶酶体凋亡通路。本试验结果表明,组织蛋白酶B、D和L的活力随着宰后成熟时间的延长显著增大。这可能是由于组织蛋白酶是一种存在于溶酶体中的酶。宰后初期,因为其没有完全从溶酶体中释放出来,所以活性较低。随着成熟时间的延长,溶酶体膜稳定性被破坏,组织蛋白酶随之从溶酶体中释放出来,活性升高。这与田甲春[22]研究结果相一致。此外,溶酶体膜的损伤会选择性释放一些组织蛋白酶,进而导致细胞发生凋亡。因此,宰后成熟过程中牛肉溶酶体膜稳定性降低,导致组织蛋白酶从溶酶体释放出来从而被活化,进而诱导凋亡反应的发生。
溶酶体组织蛋白酶凋亡途径,被认为是通过线粒体进行的[23]。而线粒体膜通透性是线粒体释放相关蛋白的关键步骤。本文研究结果表明,随着宰后成熟时间的延长,线粒体膜通透性逐渐增大。这一结果与HOFER等[24]在研究动物宰后成熟时期线粒体膜通透性变化结果相一致。宰后6~12 h,线粒体膜通透性变化显著,可能与这一时间段是凋亡相关蛋白释放的主要时期有关。ZHANG等[25]在研究牛肉宰后成熟过程Cyt-c介导凋亡发生时也认为,线粒体膜通透性随着成熟时间的延长而增大,这与Cyt-c的释放密切相关。同时,SUN等[26]研究认为组织蛋白在细胞中诱导凋亡发生是通过线粒体膜的通透和AIF的核转位来实现的。
对于凋亡组织而言,线粒体膜发生通透,AIF从线粒体移位到细胞核中,诱导细胞核发生凋亡。AIF在多种死亡过程中作为一种重要的诱导因子[27]。与这一理论相一致,本文研究结果表明,宰后成熟过程中牛肉AIF从线粒体释放到细胞核中,活化的AIF诱导细胞核发生凋亡。宰后0~12 h,AIF在线粒体中的表达量增加,可能是线粒体AIF的生成速度大于释放速度。宰后12~168 h,AIF在线粒体中的表达量减少,这与其在细胞核中的表达量增加相一致。TERMAN等[28]研究表明溶酶体组织蛋白酶有利于线粒体AIF释放到胞浆中,继而进入核内,诱发细胞核发生变化,这一过程甚至发生在细胞凋亡酶未被激活的情况下。JOHANSSON等[29]研究也表明释放到胞质中的组织蛋白酶又能够促进线粒体中AIF及Cyt-c的释放,进而诱导凋亡。
4 结束语
牛肉宰后成熟过程中ROS相对含量先降低后升高,溶酶体膜稳定性降低,组织蛋白酶B、D和L的活力逐渐增大,线粒体膜通透性增大,AIF从线粒体释放到细胞核中,细胞核体积增大,部分核溶解,并伴随着细胞间隙变大的现象。说明牛肉在宰后成熟过程中生成ROS,ROS的累积导致溶酶体膜稳定性失衡,使组织蛋白酶被释放,作用于线粒体,随后线粒体膜通透性发生变化,释放AIF,活化的AIF进入细胞核内诱导凋亡发生。
1BECILA S, HERRERA-MENDEZ C, COULIS G, et al. Postmortem muscle cells die through apoptosis[J]. European Food Research and Technology, 2010, 231(3): 485-493.
2孙志昶, 冯晓琴, 韩玲, 等. 牦牛肉宰后成熟嫩化与细胞凋亡酶活力变化研究[J/OL]. 农业机械学报, 2014, 45(1): 191-196. http:∥www.jcsam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20140130&journal_id=jcsam. DOI: 10.6041/j.issn.1000-1298.2014.01.030.
SUN Zhichang, FENG Xiaoqin, HAN Ling, et al. Tenderness and apoptotic activity of yak meat during postmortem aging[J/OL].Transactions of the Chinese Society for Agricultural Machinery, 2014, 45(1): 191-196. (in Chinese)
3ORRENIUS S. Mitochondrial regulation of apoptotic cell death[J]. Toxicology Letters, 2004, 149(1-3): 19-23.
4HUANG F, HUANG M, ZHANG H, et al. Changes in apoptotic factors and caspase activation pathways during the postmortem aging of beef muscle[J]. Food Chemistry, 2016, 190: 110-114.
5CAO J X, SUN W Q, ZHOU G H, et al. Morphological and biochemical assessment of apoptosis in different skeletal muscles of bulls during conditioning[J]. Journal of Animal Science, 2010, 88(10): 3439-3444.
6王琳琳, 马君义, 余群力, 等. 宰后牦牛肉细胞凋亡对肌肉内环境与嫩度的影响[J/OL]. 农业机械学报, 2017, 48(7): 317-324.http:∥www.jcsam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20170740&journal_id=jcsam. DOI:10.6041/j.issn.1000-1298.2017.07.040.
WANG Linlin, MA Junyi, YU Qunli, et al. Effects of apoptosis on muscle internal environment and tenderness during yak meat postmortem aging[J/OL].Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(7): 317-324.(in Chinese)
7SUSIN S A, LORENZO H K, ZAMZAMI N, et al. Molecular characterization of mitochondrial apoptosis-inducing factor[J]. Nature, 1999, 397(6718): 441-446.
8BOYA P, KROEMER G. Lysosomal membrane permeabilization in cell death[J]. Oncogene, 2008, 27(50): 6434-6451.
9AITS S, JAATTELA M. Lysosomal cell death at a glance[J]. Cell Science, 2013, 126(9): 1905-1912.
10ZUZARTE-LUIS V, MONTERO J A, KAWAKAMI Y, et al. Lysosomal cathepsins in embryonic programmed cell death[J]. Developmental Biology, 2007, 301(1): 205-217.
11张玉林. 宰后活性氧簇(ROS)的形成对鹅肉品质影响机制的研究[D]. 宁波: 宁波大学, 2014.
ZHANG Yulin.The mechanism of the influence on meat quality of goose muscle caused by the generation of reactive oxygen species (ROS) after slaughter[D]. Ningbo: Ningbo University, 2014. (in Chinese)
12TIAN J C, HAN L, YU Q L, et al. Changes in tenderness and cathepsins activity during post mortem ageing of yak meat[J]. Canadian Journal of Animal Science, 2013, 93(3): 321-328.
13陈骋, 余群力, 韩玲, 等. 丙二醛对牛肉线粒体高铁肌红蛋白还原能力的影响[J/OL]. 农业机械学报, 2015, 46(12): 253-259.http:∥www.jcsam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20151234&journal_id=jcsam. DOI: 10.6041/j.issn.1000-1298.2015.12.034.
CHEN Cheng, YU Qunli, HAN Ling, et al. Effects of malondialdehyde on metmyoglobin reduction ability of bovine muscle mitochondria[J/OL].Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(12): 253-259. (in Chinese)
14PETROSILLO G, RUGGIERO F M, PISTOLESE M, et al. Reactive oxygen species generated from the mitochondrial electron transport chain induce cytochrome c dissociation from beef-heart submitochondrial particles via cardiolipin peroxidation. Possible role in the apoptosis[J]. FEBS Letters, 2001, 509(3): 435-438.
15CHEN L, FENG X C, LU F, et al. Effects of camptothecin, etoposide and Ca2+on Caspase-3 activity and myofibrillar disruption of chicken during postmortem ageing[J]. Meat Science, 2011, 87(3): 165-174.
16XUE D, LI Y N, JIANG Z J, et al. A ROS-dependent and Caspase-3-mediated apoptosis in sheep bronchial epithelial cells in response toMycoplasmaovipneumoniaeinfections[J]. Veterinary Immunology and Immunopathology, 2017, 187: 55-63.
17ZHANG R F, HUMPHREYS I, SAHU R P, et al. In vitro and in vivo induction of apoptosis by capsaicin in pancreatic cancer cells is mediated through ROS generation and mitochondrial death pathway[J]. Apoptosis, 2008, 13(12): 1465-1478.
18WANG L L, HAN L, MA X L, et al. Effect of mitochondrial apoptotic activation through the mitochondrial membrane permeability transition pore on yak meat tenderness during postmortem aging[J]. Food Chemistry, 2017, 234: 323-331.
19CAI J Y, YANG J, JONES D P. Mitochondrial control of apoptosis: the role of cytochrome c[J]. Biochimica et Biophysica Acta, 1998, 1366(1-2): 139-149.
20LUZIO J P, PRYOR P R, BRIGHT N A. Lysosomes: fusion and function[J]. Nature Reviews Molecular Cell Biology, 2007, 8(8): 622-632.
21REPNIK U, STOKA V, TURK V, et al. Lysosomes and lysosomalcathepsins in cell death[J]. Biochimica et Biophysica Acta, 2012, 1824(1): 22-33.
22田甲春. 牦牛肉宰后成熟过程中组织蛋白酶L、B、H对肉品质及微观结构的影响[D]. 兰州: 甘肃农业大学, 2013.
TIAN Jiachun. The effect of cathepsins L, B, H on yak meat quality and microstructure during postmortem aging[D]. Lanzhou: Gansu Agricultural University, 2013. (in Chinese)
23REPNIK U, TURK B. Lysosomal-mitochondrial cross-talk during cell death[J]. Mitochondrion, 2010, 10(6): 662-669.
24HOFER T, SERVAIS S, SEO A Y, et al. Bioenergetics and permeability transition pore opening in heart subsarcolemmal and interfibrillar mitochondria: effects of aging and lifelong calorie restriction[J]. Mechanisms of Ageing and Development, 2009, 130(5): 297-307.
25ZHANG J Y, YU Q L, HAN L, et al. Study on the apoptosis mediated by cytochrome c and factors that affect the activation of bovine longissimus muscle during postmortem aging[J]. Apoptosis, 2017, 22(6): 777-785.
26SUN H W, YANG S, LI J H, et al. Caspase-independent cell death mediated by apoptosis-inducing factor (AIF) nuclear translocation is involved in ionizing radiation induced HepG2 cell death[J]. Biochemical and Biophysical Research Communications, 2016, 472(1): 137-143.
27NORBERG E, ORRENIUS S, ZHIVOTOVSKY B. Mitochondrial regulation of cell death: processing of apoptosis-inducing factor (AIF)[J]. Biochemical and Biophysical Research Communications, 2010, 396(1): 95-100.
28TERMAN A, GUSTAFSSON B, BRUNK U T. The lysosomal-mitochondrial axis theory of postmitotic aging and cell death[J]. Chemico-Biological Interactions, 2006, 163(1-2): 29-37.
29JOHANSSON A C, APPELQVIST H, NILSSON C, et al. Regulation of apoptosis-associated lysosomal membrane permeabilization[J]. Apoptosis, 2010, 15: 527-540.

