低氧对滋养细胞HIF-1α、BNIP3表达及自噬和侵袭能力的影响
闫广伟,丁燕子,邢金芳,代延朋,杜红梅,袁恩武
郑州大学第三附属医院检验科 郑州 450052
滋养细胞由妊娠初期胚胎外胚层细胞衍生而来,可分为细胞滋养细胞、合体滋养细胞和中间型滋养细胞,其中细胞滋养细胞为滋养干细胞,随着妊娠的形成分化发育成绒毛滋养细胞和绒毛膜外滋养细胞两种类型[1]。绒毛膜外滋养细胞可以侵入子宫螺旋动脉和血管内皮,子宫螺旋动脉重铸能够保证足够的胎盘灌流维持正常妊娠。妊娠早期胎盘发育处于相对低氧(2%~5%氧浓度)环境,蜕膜组织氧浓度在8%左右[2],而此时氧浓度是影响滋养细胞侵袭性的关键因素。作为胎盘的主要成分,低氧条件下滋养细胞的增殖、分化、侵袭性等生理功能的变化受众多信号通路的调节,滋养细胞侵袭功能障碍可导致子痫前期、胎儿生长受限、流产等疾病[3-4]。自噬是一种存在于真核细胞中依赖溶酶体途径消化降解自身成分的过程,微管相关蛋白1轻链3(LC3)和Beclin 1是两个重要的自噬相关分子,检测二者的表达可以判断细胞自噬的活性[5]。研究[6-7]表明,胎盘细胞自噬在维持正常妊娠过程起重要作用,自噬过度或自噬不足与多种妊娠期疾病有关。滋养细胞自噬同样受到众多信号通路的调节,研究[8]显示缺氧条件下原代培养滋养细胞自噬水平增强,然而低氧诱导滋养细胞自噬的分子机制尚不完全明了。本研究以绒毛膜外滋养细胞HTR-8/SVneo为研究对象,采用缺氧和自噬抑制剂3-MA处理滋养细胞,对HIF-1α/BNIP3信号通路的关键因子进行检测,探讨低氧对滋养细胞自噬和侵袭性的影响及其机制,为妊娠期缺氧性相关疾病的研究提供理论依据和新的思路。
1 材料与方法
1.1主要试剂RPMI 1640培养基购自北京索莱宝公司,胎牛血清购自杭州四季青公司,胰蛋白酶购自美国HyClone公司,自噬抑制剂3-MA为美国Selleck公司产品,荧光定量试剂盒SYBI Green购自日本TOYOBO公司,Transwell小室购自Corning Costar公司,Matrigel基质胶购自美国BD公司,HIF-1α、BNIP3兔抗人一抗购自美国Abcam公司,LC3、Beclin 1兔抗人一抗购自美国CST公司。滋养细胞株HTR-8/SVneo购自美国ATCC公司。
1.2细胞培养及实验分组将HTR-8/SVneo细胞置于含体积分数10%胎牛血清的RPMI 1640培养基,37 ℃、体积分数5%二氧化碳培养箱中培养,每2~3 d传代1次,取对数生长期细胞进行后续实验。细胞以105mL-1的密度接种于6孔板,每孔2 mL,待细胞达70%融合时更换无血清培养基培养24 h后分为3组:常氧组在正常条件下培养细胞,缺氧组加入终浓度为200 μmol/L 的CoCl2,3-MA+缺氧组在缺氧组基础上加入终浓度为5 mmol/L 3-MA。继续培养24 h后进行1.3和1.4的检测。
1.3Real-timePCR检测HIF-1α、BNIP3mRNA的表达量Trizol一步法提取常氧组和缺氧组细胞总RNA,按照逆转录试剂盒说明合成cDNA,置于荧光定量PCR仪进行扩增,扩增体系为20 μL。扩增条件为95 ℃预变性60 s;95 ℃变性15 s,60 ℃退火15 s,共40个循环。PCR引物(表1)由上海生物工程有限公司设计合成。采用2-ΔΔCT法计算HIF-1α、BNIP3 mRNA的相对表达量。实验重复3次。

表1 Real-time PCR扩增引物序列及扩增片段长度
F:上游引物;R:下游引物
1.4Westernblot检测HIF-1α、BNIP3、Beclin1和LC3蛋白表达量收集常氧组和缺氧组细胞,用RIPA蛋白裂解液提取总蛋白,BCA法测定蛋白浓度,取30 μg蛋白样品进行SDS-PAGE凝胶电泳,之后经转膜、封闭后加入按比例稀释后HIF-1α、BNIP3一抗(按11 000稀释),4 ℃孵育过夜,第2天取出室温平衡后加入辣根过氧化物酶标记的二抗(按110 000稀释),室温避光孵育1 h,1×TBST洗膜3遍,ECL化学发光检测,最后采用Odyssey Clx红外荧光扫描成像系统分析目的条带。另取3组细胞,同上测Beclin 1、LC3蛋白表达量。实验重复3次。
1.5Transwell实验检测细胞侵袭力在Transwell小室内加入100 μL按照18稀释的Matrigel基质胶,将小室放入24孔板内置恒温培养箱孵育4 h,上室加入200 μL细胞悬液(细胞密度为5×105mL-1),下室加入600 μL含体积分数10% 胎牛血清的RPMI 1640培养基,放入恒温培养箱,待细胞贴壁后,上室按照分组加入CoCl2、3-MA或不处理,置37 ℃、体积分数5%二氧化碳培养箱继续培养24 h,取出24孔板,用棉签轻轻擦去上室培养基和未穿透细胞,PBS溶液轻轻冲洗3遍后,用体积分数4%甲醇固定30 min,在小室内加入苏木精染色15 min,置倒置显微镜(×400)下观察,拍照并计数,每个Transwell小室计数5个视野。
1.6统计学处理应用SPSS 17.0处理数据。采用两独立样本t检验比较常氧组和缺氧组HIF-1α、BNIP3 mRNA和蛋白表达水平的差异,采用单因素方差分析比较常氧组、缺氧组和3-MA+缺氧组Beclin 1和LC3蛋白的表达水平及侵袭细胞数的差异,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1缺氧对滋养细胞HIF-1α、BNIP3mRNA及蛋白表达的影响Real-time PCR结果显示:与常氧组相比,缺氧处理24 h后滋养细胞HTR-8/SVneo中HIF-1α mRNA表达水平无明显变化,BNIP3 mRNA表达水平升高,HIF-1α、BNIP3蛋白表达水平均上调,见图1、表2。

1:常氧组;2:缺氧组图1 缺氧后滋养细胞HIF-1α及BNIP3蛋白的表达
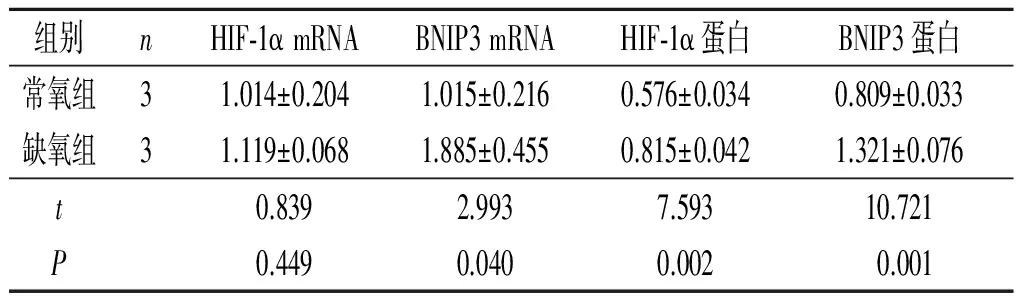
表2 缺氧条件下滋养细胞HIF-1α、BNIP3 mRNA和蛋白的表达
2.2缺氧和3-MA对滋养细胞LC3、Beclin1蛋白表达的影响与常氧组相比,经缺氧处理24 h后,滋养细胞中LC3Ⅱ/LC3Ⅰ、Beclin 1蛋白表达水平升高;与缺氧组相比,3-MA+缺氧组LC3Ⅱ/LC3Ⅰ蛋白表达水平降低,同时Beclin 1蛋白表达水平下降(图2、表3)。
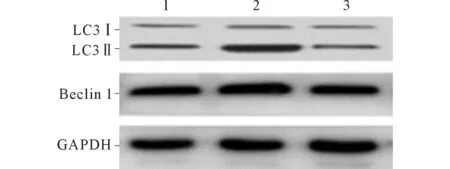
1:常氧组;2:缺氧组;3:3-MA+缺氧组图2 3组滋养细胞Beclin 1、LC3蛋白的表达
2.3缺氧和3-MA对滋养细胞侵袭力的影响缺氧组侵袭细胞数高于常氧组,但在缺氧条件下使用自噬抑制剂3-MA后侵袭细胞数减少(图3、表3)。

A:常氧组;B:缺氧组;C:3-MA+缺氧组图3 3组滋养细胞侵袭细胞数比较(×400)
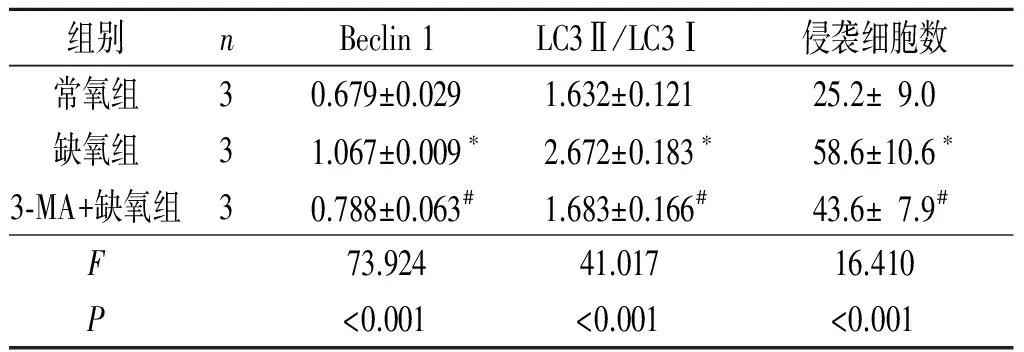
表3 3组滋养细胞Beclin 1、LC3蛋白的表达水平及侵袭细胞数的比较
*:与常氧组相比,P<0.05;#:与缺氧组相比,P<0.05
3 讨论
妊娠期胎盘是维持胎儿宫内生长发育的重要器官,胎盘是母体与胎儿进行氧交换和二氧化碳交换的主要场所。本课题组前期研究[9]显示稽留流产胎盘绒毛组织滋养层细胞自噬标志物LC3Ⅱ/Ⅰ蛋白表达比值下降,同时HIF-1α/BNIP3信号通路在这个过程中起重要作用 。Wu等[4]的研究表明滋养细胞侵袭力的改变可能是流产发生发展的重要机制。正常妊娠12周后,绒毛膜外滋养细胞可侵入子宫螺旋动脉取代其血管内皮细胞,参与平滑肌细胞的降解[10],在胚胎植入、胎儿发育、建立有效的母胎循环过程中发挥至关重要的作用。
HIF-1α是细胞内的一种转录因子,与HIF-1β构成异二聚体,可调控100多种靶基因的表达,在调节血管形成、胎盘和胚胎发育、糖代谢及细胞凋亡和自噬过程中扮演重要角色。Dubinsky等[11]研究发现HIF-1α在滋养层细胞中表达,参与控制了滋养层细胞的侵入和迁移。研究[12]已证实BNIP3参与细胞凋亡、自噬和细胞坏死等过程;BNIP3在机体缺氧条件下会急剧升高,其表达受HIF-1α的调控。本研究以绒毛膜外滋养细胞HTR-8/SVneo为研究对象,采用CoCl2处理模拟细胞缺氧模型[13],结果显示缺氧处理24 h后HIF-1α、BNIP3蛋白及BNIP3 mRNA的表达水平均升高,但HIF-1α mRNA的表达水平无明显改变。
LC3是自噬体膜上重要的标记蛋白,它在细胞内以LC3Ⅰ和LC3Ⅱ两种形式存在。在自噬发生过程中, LC3Ⅰ转化为LC3Ⅱ并定位于自噬体膜,因此LC3Ⅱ/Ⅰ可以反映自噬水平的高低[14]。Beclin 1是酵母ATG6/Vps30基因在哺乳动物中的同源物,位于人类染色体17q21,主要通过与ClassⅢ PI3K和Atg14L结合形成复合体调控自噬体的形成[15]。低氧条件下,活化的HIF-1α通过上调BNIP3将Beclin 1从Beclin 1/Bcl-2复合体解离释放,激活自噬[16]。本研究结果显示滋养细胞缺氧后,自噬标志蛋白Beclin 1及 LC3Ⅱ/Ⅰ表达均升高,而加用自噬抑制剂3-MA后滋养细胞Beclin 1和LC3Ⅱ/Ⅰ蛋白表达水平降低。这一发现表明缺氧可诱导滋养细胞自噬的发生,HIF-1α/BNIP3途径可能在此过程中起重要作用。
滋养细胞的侵袭、浸润是一个多因素参与调节、多步骤的复杂过程。有研究[17]显示缺氧条件下人绒毛膜外滋养细胞MMP-2表达升高并使细胞侵袭力增强,同时MMP-9和TIMP-1表达升高;缺氧可通过MMP-9/TIMP-1来调节细胞侵袭性。Maltepe等[18]研究发现,滋养细胞在低氧条件下可以通过激活HIF-1α影响其侵袭能力。研究[19-20]显示,肿瘤细胞自噬与其侵袭性存在复杂关系,然而自噬与滋养细胞侵袭性的相关研究国内外较少。本研究结果显示,HTR-8/SVneo细胞缺氧24 h后侵袭细胞数量比常氧组增多,此外,自噬抑制剂3-MA对缺氧后滋养细胞侵袭力有抑制作用,这表明自噬抑制剂可能通过抑制缺氧诱导的自噬从而影响滋养细胞的侵袭能力。结合前期研究,我们推测在低氧环境中,稽留流产患者绒毛滋养层细胞自噬减弱,滋养细胞处于低浸润能力状态,不足以应对缺氧环境带来的压力,无法正常促进胚泡植入和胎盘形成,从而导致胚胎停止发育,发生稽留流产[9]。
综上所述,低氧可能通过HIF-1α/BNIP3途径诱导滋养细胞自噬并影响其侵袭能力,自噬抑制剂3-MA通过抑制低氧条件下滋养细胞自噬的发生从而降低其侵袭性。缺氧环境中滋养细胞自噬、侵袭性和妊娠期相关疾病之间存在错综复杂的关系,仍需进一步深入研究。
[1] GENBACEV O,ZHOU Y,LUDLOW JW,et al.Regulation of human placental development by oxygen tension[J].Science,1997,277(5332):1669
[2] JAUNIAUX E,WATSON A,BURTON G.Evaluation of respiratory gases and acid-base gradients in human fetal fluids and uteroplacental tissue between 7 and 16 weeks' gestation[J].Am J Obstet Gynecol,2001,184(5):998
[3] LIAN IA,TOFT JH,OLSEN GD,et al.Matrix metalloproteinase 1 in pre-eclampsia and fetal growth restriction: reduced gene expression in decidual tissue and protein expression in extravillous trophoblasts[J].Placenta,2010,31(7):615
[4] WU Y,CHEN X,CHANG X,et al.Potential involvement of placental AhR in unexplained recurrent spontaneous abortion[J]. Reprod Toxicol,2016,59:45
[5] NAKASHIMA A,AOKI A,KUSABIRAKI T,et al.Role of autophagy in oocytogenesis, embryogenesis, implantation, and pathophysiology of pre-eclampsia[J].J Obstet Gynaecol Res,2017,43(4):633
[6] CHU A,THAMOTHARAN S,GANGULY A,et al.Gestational food restriction decreases placental interleukin-10 expression and markers of autophagy and endoplasmic reticulum stress in murine intrauterine growth restriction[J].Nutri Res,2016,36(10):1055
[7] SAITO S,NAKASHIMA A.A review of the mechanism for poor placentation in early-onset preeclampsia: the role of autophagy in trophoblast invasion and vascular remodeling[J].J Reprod Immunol,2014,101-102:80
[8] CHEN B,LONGTINE MS,NELSON DM.Hypoxia induces autophagy in primary human trophoblasts[J].Endocrinology,2012,153(10):4946
[9] 袁恩武,王银芳,邢金芳,等.妊娠早期稽留流产患者绒毛组织中HIF-1α、BNIP3、LC3的表达[J].郑州大学学报(医学版),2017,52(3):335
[10]STARZYK KA,SALAFIA CM,PEZZULLO JC,et al.Quantitative differences in arterial morphometry define the placental bed in preeclampsia[J].Human Pathol,1997,28(3):353
[11]DUBINSKY V,POEHLMANN TG,SUMAN P,et al.Role of regulatory and angiogenic cytokines in invasion of trophoblastic cells[J].Am J Reprod Immunol,2010,63(3):193
[12]FARRALL AL,WHITELAW ML.The HIF1alpha-inducible pro-cell death gene BNIP3 is a novel target of SIM2s repression through cross-talk on the hypoxia response element[J].Oncogene,2009,28(41):3671
[13]YUAN Y,HILLIARD G,FERGUSON T,et al.Cobalt inhibits the interaction between hypoxia-inducible factor-alpha and von Hippel-Lindau protein by direct binding to hypoxia-inducible factor-alpha[J].J Biol Chem,2003,278(18):15911
[14]MIZUSHIMA N,YOSHIMORI T,LEVINE B.Methods in mammalian autophagy research[J].Cell,2010,140(3):313
[15]KANG R,ZEH HJ,LOTZE MT,et al.The Beclin 1 network regulates autophagy and apoptosis[J].Cell Death Differ,2011,18(4):571
[16]LEVINE B,KROEMER G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27
[17]LI G,ZHANG Y,QIAN Y,et al.Interleukin-17A promotes rheumatoid arthritis synoviocytes migration and invasion under hypoxia by increasing MMP2 and MMP9 expression through NF-κB/HIF-1α pathway[J].Mol Immunol,2013,53(3):227
[18]MALTEPE E,KRAMPITZ GW,OKAZAKI KM,et al.Hypoxia-inducible factor-dependent histone deacetylase activity determines stem cell fate in the placenta[J].Development,2005,132(15):3393
[19]CATALANO M,D'ALESSANDRO G,LEPORE F,et al.Autophagy induction impairs migration and invasion by reversing EMT in glioblastoma cells[J].Mol Oncol,2015,9(8):1612
[20]GOU WF,SHEN DF,YANG XF,et al.ING5 suppresses proliferation, apoptosis, migration and invasion, and induces autophagy and differentiation of gastric cancer cells: a good marker for carcinogenesis and subsequent progression[J].Oncotarget,2015,6(23):19552