系统性红斑狼疮肺动脉高压相关危险因素分析
陈扬帆,徐建华,王 芬,徐胜前,史学功,刘 爽,连 莉,陈珊宇,邹延峰
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种累及全身器官的自身免疫性疾病,肺动脉高压(pulmonary artery hypertension, PAH)是SLE严重的并发症,重度PAH是导致患者死亡的重要原因,早期发现早期诊治对SLE-PAH预后具有重要意义[1-3]。本研究对收住院的358例SLE患者进行回顾性研究,以探讨其相关危险因素,提高对SLE合并PAH的早期认识和诊断。
1 材料与方法
1.1研究对象选择安徽医科大学第一附属医院风湿免疫科2007年4月~2016年1月明确诊断为SLE的患者,均符合1997年美国风湿病协会(ACR)制订的诊断标准,358例患者都通过超声心动图对肺动脉压进行测定。本研究经安徽医科大学第一附属医院伦理委员会查审批准,所有研究对象均签订知情同意书。
1.2分组标准用连续彩色多普勒超声测量肺动脉瓣及三尖瓣最大反流压差,加上右房压估测肺动脉压力值[4]。肺动脉压力>4 kPa定义为肺动脉高压[5],设为有PAH组;≤4 kPa为无PAH组;将有PAH组进一步分组:4 kPa <肺动脉压力≤5.33 kPa为轻度PAH组;5.33 kPa <肺动脉压力≤9.33 kPa为中度PAH组;肺动脉压力>5.33 kPa为重度PAH组[6],将中度及重度PAH组合并为中重度PAH组。并排除心肌梗死、心肌病、肺梗死、肺部疾病等其他疾病引起肺动脉高压患者。
1.3研究方法通过比较SLE合并与不合并PAH患者临床特征及实验室资料的差异,探讨SLE-PAH患者的临床特征及相关因素,包括性别、年龄、病程、是否合并胸膜炎、心包炎、皮疹、光过敏、肺间质病变、雷诺现象、狼疮活动度、D-二聚体、尿蛋白、肾功能、尿酸、部分活化的凝血酶原活动度(APTT)、抗核抗体(ANA)滴度、双链DNA(dsDNA)等。
2 结果
2.1一般情况及SLE活动性比较本研究收集了安徽医科大学第一附属医院风湿免疫科2007年4月~2016年1月明确诊断SLE的患者358例,根据心脏彩超结果,SLE合并PAH者216例(60.3%),轻度PAH 151例(42%),中度PAH 55例(15.4%),重度PAH有10例(2.8%)。358例SLE患者平均年龄(34.5±12.6)年,病程为3(0.76~7.00)年,平均SLE疾病活动度评分(SLEDAI)为0~36(10.48±6.14)。有无PAH组及PAH组间在年龄、病程、SLEDAI积分的差异无统计学意义。见表1、2。
2.2临床表现及实验室指标的比较有PAH组D-二聚体延长(χ2=8.730,P=0.003)及肾功能异常(χ2=4.418,P=0.036)的发生率高于无PAH组,皮疹(χ2=3.928,P=0.047)、光过敏(χ2=6.651,P=0.010)的发生率低于无PAH组。中重度PAH组(n=65)出现心包炎(χ2=7.549,P=0.006)、肺间质病(χ2=4.511,P=0.034)、雷诺现象(χ2=3.873,P=0.049)、高尿酸血症(χ2=4.560,P=0.033)及APTT延长(χ2=6.853,P=0.009)的发生率明显高于轻度PAH组(n=151)。见表3。
2.3Logistic回归分析Logistic回归分析提示,在无PAH组与有PAH组的比较中,出现D-二聚体延长及肾功能异常是发生PAH的危险因素,而出现皮疹及光过敏是发生PAH的保护性因素(P<0.05)。在轻度PAH组和中重度PAH组比较中,出现心包炎、肺间质病变、高尿酸血症、APTT延长可能是发展为中重度PAH的危险因素(P<0.05)。见表4。
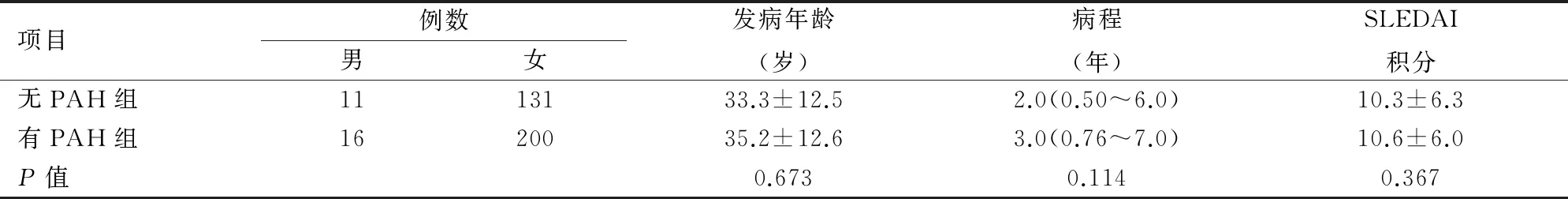
表1 无PAH组及有PAH组间一般情况及疾病活动性的比较
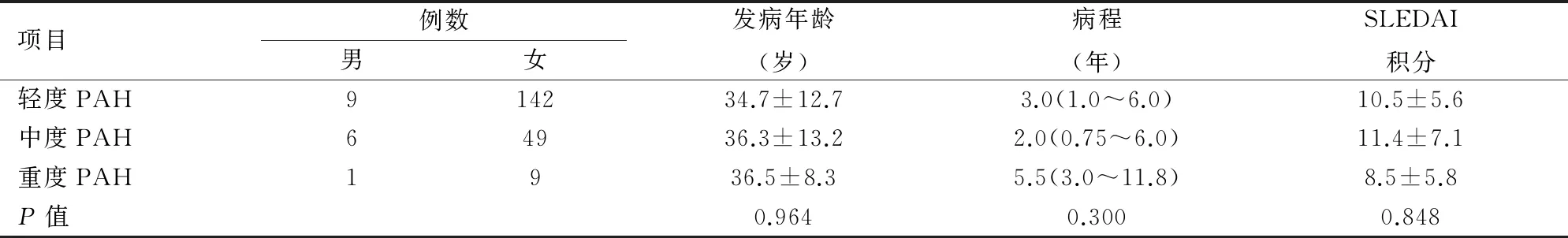
表2 PAH各组间一般情况及疾病活动性的比较

表3 无PAH组与有PAH组及轻度PAH组与中重度PAH组的临床表现及实验室指标的比较[n(%)]
与无PAH组比较:*P<0.05;与轻度PAH组比较:#P<0.05

表4 肺动脉压力与相关因素分析
3 讨论
SLE合并PAH是SLE死亡的重要原因,目前尚无有效的治疗办法,有国外研究[6-8]显示SLE-PAH患者的死亡率仅次于慢性血栓栓塞疾病和心肺并发症。在国内的研究中,北京协和医院的医师对住院的SLE患者近30年的死因分析发现[9],SLE-PAH是继神经精神性狼疮、狼疮性肾炎后,导致SLE患者死亡的第3位原因,在病程>3年的SLE 住院患者中,PAH高居死因首位。本研究对安徽医科大学第一附属医院SLE-PAH患者进行随访,有6例患者死亡,均为重度PAH患者,死亡率高达60%。
本研究显示,SLE-PAH发生率高达60.3%。然而,对其发病机制目前暂没有明确,可能与纤维母细胞及内皮细胞的功能减退导致损伤性血管舒张因子(包括NO及前列环素)产生以及血管收缩因子(如内皮素)产生使血管过度收缩等有关。这些细胞因子的紊乱影响了血管紧张度及导致了血管病理学重塑,最终导致了肺动脉收缩,原位血栓形成,偶尔会出现复杂丛状病灶[10]。随着疾病的进展,血管重塑及纤维化最终会导致右心肥大及右心衰。本研究中,有PAH组D-二聚体延长发生率高于无PAH组,中重度PAH组心包炎、肺间质病、雷诺现象、APTT延长的发生率明显高于轻度PAH组,可能与上述原因有关。另外,有研究[11]显示,一些相关自身抗体如抗心磷脂抗体、抗小核糖核蛋白抗体,可能与肺动脉高压的产生有关,而与SLE活动度相关的SLEDAI积分及ANA滴度升高与SLE-PAH的致死率无关[12],这与本研究的结果也是相符的。
本研究显示,有PAH组肾功能异常高于非PAH组,中重度PAH组高尿酸血症发生率高于轻度PAH组。这可能是因为在各种氧化代谢受损疾病如慢性心衰或各种导致肺动脉压升高的疾病中,黄嘌呤氧化酶浓度会升高,黄嘌呤氧化酶活性由肿瘤坏死因子-γ(TNF-γ)和白介素-6(IL-6)诱导,而TNF-γ和IL-6在SLE-PAH的发病机制中起重要作用,而黄嘌呤氧化酶的升高能导致尿酸在肾脏的分解代谢失衡引起尿酸水平升高。另外,血尿酸水平与细胞外超氧化物歧化酶活性的调解有关,这种酶主要针对氧自由基从而起到抗氧化作用。这都提示了高血尿酸水平与慢性氧化应激有关,从而支持了持续的高血尿酸水平可导致SLE-PAH的发生发展[13]。
总的来说,对于SLE-PAH患者,在疾病一开始进行针对性治疗的时机对预后起着决定性作用,治疗开始的时间越早,PAH对心功能的影响越小,患者远期预后也就更好。狼疮合并PAH的患者,由于其常常合并多系统受累,这对PAH的早期诊断提供了契机。从结果可以发现,SLE患者的疾病活动与PAH是没有关系的,肾功能不全集高尿酸血症虽然是PAH的危险因素,但是否出现蛋白尿并不是PAH的高危因素,这提示激素及免疫制剂的使用对PAH的治疗没有影响,但D-二聚体及APTT的延长提示抗凝药物的使用可能对PAH的预防有重要意义。
另外,在中国,若对所有SLE每年行PAH的筛查,不仅对患者造成经济上的负担,同时也会对国家的医疗资源产生负担,所以仅对有PAH危险因素的患者行常规筛查能够节约资源,加强医疗压力,所以对于出现心包炎、肺间质病变、雷诺现象、高尿酸血症、肾功能异常、D-二聚体及APTT延长等表现的SLE患者,应重视对其PAH的监测及筛查,尤其是合并心包炎、肺间质病、雷诺现象、高尿酸血症及APTT延长的患者,尽早进行病情评估与治疗,是提高狼疮患者的生存率与生活质量的保障[14]。
[1] 滕佳临, 张 巍. 系统性红斑狼疮合并肺动脉高压患者临床特点分析[J].中华医学杂志, 2014,94(13):969-72.
[3] Min H K, Lee J H, Jung S M, et al. Pulmonary hypertension in systemic lupus erythematosus: an independent predictor of patient survival[J]. Korean J Intern Med, 2015, 30(2):232-41.
[4] Rosenkranz S. Pulmonary hypertension: current diagnosis and treatment[J]. Clin Res Cardiol, 2007, 96(8):527-41.
[5] Galiè N, Hoeper M M, Humbert M, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension:the task force for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT)[J]. Eur Heart J, 2009,30(20):2493-537.
[6] Ruiz-Irastorza G, Egurbide M V, Olivares N, et al. Vitamin D deficiency in systemic lupus erythematosus: prevalence, predictors and clinical consequences[J]. Rheumatology (Oxford), 2008, 47(6):920-3.
[7] Thenappan T, Shah S J, Rich S, et al. A USA-based registry for pulmonary arterial hypertension:1982-2006[J]. Eur Respir J, 2007, 30(6):1103-10.
[8] Hassoun P M. Pulmonary arterial hypertension complicating connective tissue diseases[C]. Semin Respir Crit Care Med, 2009, 30(4): 429-39.
[9] Fei Y, Shi X, Gan F, et al. Death causes and pathogens analysis of systemic lupus erythematosus during the past 26 years[J]. Clin Rheumatol, 2014, 33(1): 57-63.
[10] Tuder R M, Archer S L, Dorfmüller P, et al. Relevant issues in the pathology and pathobiology of pulmonary hypertension[J]. J Am Coll Cardiol, 2013, 62(25 Suppl):D4-12.
[11] Xia Y K, Tu S H, Hu Y H, et al. Pulmonary hypertension in systemic lupus erythematosus: a systematic review and analysis of 642 cases in Chinese population[J]. Rheumatol Int,2013,33(5):1211-7.
[12] Chow S L, Chandran V, Fazelzad R, et al. Prognostic factors for survival in systemic lupus erythematosus associated pulmonary hypertension[J]. Lupus, 2012, 21(4): 353-64.
[13] Castillo-Martínez D, Marroquín-Fabián E, Lozada-Navarro A C, et al. Levels of uric acid may predict the future development of pulmonary hypertension in systemic lupus erythematosus: a seven-year follow-up study[J]. Lupus, 2016, 25(1): 61-6.
[14] Li M, Wang Q, Zhao J, et al. Chinese SLE treatment and research group (CSTAR) registry: II. prevalence and risk factors of pulmonary arterial hypertension in Chinese patients with systemic lupus erythematosus[J]. Lupus, 2014, 23(10):1085-91.

