超声弹性成像与磁共振对T1~2N1~2M0乳腺癌新辅助化疗疗效评估的对比研究*
黄泽君,杨正春,李 芳,罗小平,罗 丽,黄海萍
(1.重庆市肿瘤研究所/医院/癌症中心超声科 400030;2.重庆市妇幼保健院超声科 400021;3.重庆市肿瘤研究所/医院/癌症中心病理科 400030)
目前,局部进展期乳腺癌(locally advanced breast cancer,LABC)术前行新辅助化疗(neoadjuvant chemotherapy,NAC)已成为标准治疗方法,其治疗是一个综合、个性化的过程。NAC具有可缩小肿瘤并清除微小转移灶,使乳腺癌分期评级降低,从而增加保乳术治疗机会并提高远期生存率的作用[1-2]。因此,寻求一种评估肿瘤对化疗的敏感性及其疗效的方法成为了当前研究的热点。近年来,超声弹性成像和增强磁共振在乳腺癌良恶性鉴别诊断得到了广泛应用[3-5]。本文对超声弹性成像与增强磁共振成像进行对比性研究,拟探讨超声弹性成像在乳腺癌新辅助化疗疗效评估中的价值。
1 资料与方法
1.1一般资料 收集2015 年1 月至2016 年12月在重庆市肿瘤医院治疗的乳腺癌患者,入组条件:临床分期为T1~2N1~2M0并接受新辅助化疗后完成手术治疗的患者,在接受新辅助化疗前先行空芯针或麦默通活检,获得病理资料。同时所有患者均行乳腺癌改良根治术,并最终取得术后病理检查结果。患者每次化疗前均进行彩色多普勒超声检查评估疗效以选择手术时机。所有患者于第1次新辅助化疗前及手术前48 h内先后两次行乳腺超声弹性成像和增强磁共振检查。排除未按时接受超声及磁共振检查者、发生远处转移者。所有患者均为女性,年龄29~65岁,平均(47.65±9.99)岁。
1.2方法
1.2.1乳腺癌病灶超声弹性成像检查 采用日立HITACHI Vision Preirus数字化彩色超声诊断仪和日立ITACHI Hi Vision Avius数字化彩色超声诊断仪,探头频率为7~12 MHz。两款设备均配置实时弹性超声成像应用测量和分析软件。先行常规乳腺超声检查,详细记录病灶的最大直径,于最大直径切面将仪器切换为弹性成像模式并选择双幅对称实时显示。
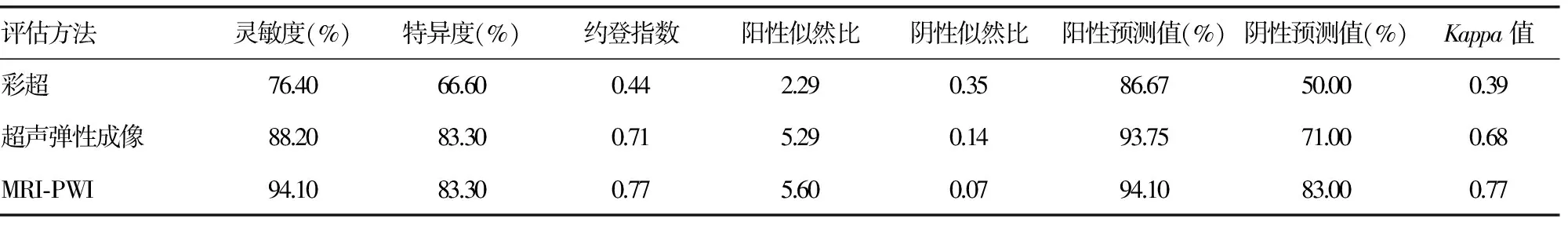
表1 常规彩超、超声弹性成像、MRI-PWI对乳腺癌NAC疗效评价表
弹性成像取样框大小约为病灶2倍,持探头手在操作时略微加压,获得满意压力曲线图像时方获取弹性图像。依据罗葆明[6]的改良5分法,参照组织统一为腺体前脂肪组织。监测病灶弹性评分(1~5 分),1~3分为良性,4、5分为恶性。最后确定弹性图像中病灶最大直径。检查时要求2名具有丰富经验的超声医生参与,所有病灶采用的超声检查条件相同,对同一感兴趣区需重复3次定位、测量获得3组数据,计算这3组数据的平均最大直径。
1.2.2增强磁共振检查 采用Achieva1.5T磁共振扫描仪,4通道双穴乳腺相控阵线。所有研究对象均进行双侧乳腺常规MRI 和动态增强成像,增强扫描采用高压注射器经静脉团注对比剂钆喷酸葡胺(Gd-DTPA)。影像图像由2名经验丰富的放射科医生采用双盲法对图像进行分析。选择动态增强第3个时相乳腺癌强化最明显的时间段,选择肿瘤病灶边界清楚的最大的平面测量[5]。
1.3疗效评估标准 以第1次治疗前所测得的癌肿最长径(或分裂病灶的长径之和)为基线数据,根据实体瘤治疗疗效评价标准RECIST 1.1(Response Evaluation Criteria in Solid Tumors)于手术前评估疗效[7]。肿瘤新辅助化疗后疗效按以下标准分类:(1)完全缓解(complete response,CR),目标病灶消失且并未出现新病灶;(2)部分缓解(partial response,PR),目标病灶最长径总和减少大于或等于30%;(3)无变化(stable disease,SD),目标病灶最长径总和缩小小于30%或增大小于20%;(4)进展(progress disease,PD),目标病灶最长径总和增大大于或等于20%或出现新病灶。常规超声未发现病灶,超声弹性成像未发现异常高分区,化疗后病灶强化低于或等于周围腺体组织,评价为未见残留病灶,直径记作0。总体缓解率=(CR+PR)/患者总例数×100%。将以上4类分为2组,其中CR和PR为组织学显著反应有效,SD和PD归为组织学非显著反应无效。
1.4手术获取病理反应评价标准 病理疗效评价标准采用Miller&Payne改良病理反应性分级标准[8],肿瘤细胞没有或仅个别发生少许变化,同时全部细胞构成没有减少为1级;肿瘤细胞减少少于30%为2级;肿瘤细胞减少30%~90%为3级;多于90%的瘤细胞消失为4级;瘤灶处无可识别的恶性细胞或仅有导管原位癌为5级。将l~2级归为无效,3~5级归为有效。
1.5统计学处理 数据统计分析采用SPSS 17.0 软件,计数资料采用卡方检验。对彩超、弹性超声及磁共振灌注成像评价NAC疗效的结果与术后病理反应评价标准的一致性进行Kappa检验。
2 结 果
2.1临床评价结果 23例患者原发肿块最大径平均值为(3.83±1.14)cm,治疗后平均值为(2.19±1.02)cm。总体缓解率为73.9%(17/23),病理完全缓解(pathologiccomplete respons,pCR)率达8.7%(2/23)。
2.2疗效评价 评价新辅助化疗疗效彩超的灵敏度为76.40%、特异度为66.60%、阳性预测值为86.67%、阴性预测值为50.00%,MRI-PWI灵敏度为94.10%、特异度为83.30%、阳性预测值为94.10%、阴性预测值为83.00%。但超声弹性成像评价NAC疗效的灵敏度为88.20%,特异度为83.30%,阳性预测值为93.75%,阴性预测值为71.00%,其特异度与MRI-PWI相等,灵敏度稍次于MRI-PWI。约登指数MRI-PWI和超声弹性成像高于彩超。利用Kappa检验,对3种检查方法评价结果与病理反应评价标准的一致性进行分析,MRI-PWI(Kappa值0.77)和弹性成像(Kappa值0.68)评价疗效与术后病理反应评价标准一致性较好,优于彩超(Kappa值0.39),见表1。
3 讨 论
实时组织应变弹性成像是近年来研究工作的焦点,它将组织受压前后回声信号移动幅度的变化转化为实时彩色图像,以色彩对不同组织进行弹性编码,并给予评分,从而反映组织硬度[9]。它已广泛应用于临床多个领域,尤其在乳腺疾病的诊断中发挥着重要作用。多数学者认为弹性成像能够有效地区分乳腺肿物的良恶性,并建立了弹性成像评估系统[10-11]。超声弹性成像与二维超声及彩色多普勒超声相比具有自身的特点[12]。但其所获得的图像和参数会受操作条件的影响。为减小随机误差,本研究选用了2名经过统一培训的同等资历医师进行检查及评判,检查时严格控制(熟练掌握)背景二维图像调节(增益、聚焦、对比度等)、加压频率、力度(以速度曲线框为参考)等,可以有效避免弹性评判的个体差异,使操作调节得到了较好的控制。
新辅助化疗总体有效率为60.0%~90.0%,pCR率为3.0%~30.0%[2]。本实验总体有效率为73.9%,pCR率达8.7%,与文献报道结果一致。
本研究结果显示MRI-PWI疗效评价的阳性预测值为94.10%、阴性预测值为83.00%、灵敏度为94.10%、特异度为83.3%,与其他文献研究结果一致[13]。癌灶的生长依赖血管的滋养,NAC后坏死、变性区域的血供不丰富。MRI-PWI通过造影剂透过血管壁到达组织间隙,聚集于病灶富血供区域,强化明显的富血供区域,可以认为是残留的癌灶,较其他影像学方法,它对残余灶的评估更准确[13]。
本研究通过常规彩超、超声弹性成像和MRI-PWI对病灶的最大径线进行评估,结果弹性成像和MRI-PWI对病灶的疗效评估特异性较高。分析其原因,弹性成像病灶化疗前直径平均值较常规彩超偏大,仔细查看图像发现有17例病灶形态不规则,边界不清,边缘有毛刺,其中13例有高回声晕导致其弹性测量范围较常规彩超范围偏大。高回声晕病理上为癌组织向正常组织的浸润区,除了表现为边界不清,有多少不等的毛刺结构外,在病灶周围的脂肪组织和腺体内可见散在脱离癌主体的大块癌组织、成团正常小叶和导管、纤维组织、炎性细胞浸润等[14]。基于上述原因,肿瘤周边组织硬度相应增加,化疗后高回声晕较化疗前缩小或消失,其疗效反映较常规彩超明显。超声弹性成像不仅能反映肿瘤内部硬度,同时反映了其周围组织变化,疗效评价灵敏度为88.20%,特异度为83.30%,阳性预测值为93.75%,阴性预测值为71.00%,较常规彩超有所提高,较彩超对癌肿大小的评估更准确,一些学者的研究也证实了这一点[15-16]。超声弹性成像与MRI-PWI特异度比较接近,能有效地提高常规彩超评估能力。
总之,通过临床研究,认为应用超声弹性成像技术对乳腺癌NAC疗效进行评估,结果优于彩超,略次于MRI-PWI。然而MRI-PWI的检查具有价格昂贵、检查时间长、不可重复等缺点。超声弹性成像扩展了超声诊断依据,能够更全面地显示病变的性质。因此,超声弹性成像仍不失为一种无创廉价的常用检查方法。
[1]PENNISI A,KIEBER-EMMONS T,MAKHOUL I,et al.Relevance of pathological complete response after neoadjuvant therapy for breast cancer[J].Breast Cancer(Auckl),2016,10:103-106.
[2]TESHOME M,HUNT K K.Neoadjuvant therapy in the treatment of breast cancer[J].Surg Oncol Clin N Am,2014,23(3):505-523.
[3]KAVITHA M,MACHIREDDY R R,SURESH S,et al.Development of a training phantom for compression breast elastography comparesion of various elastography systems and numerical simulations[J].J Med Imaging(Bellingham),2015,2(4):1-10.
[4]汪雪娇,李晶,郭嵩,等.超声弹性成像对乳腺BI-RADS 3类病灶的诊断和随访价值探索[J].中华超声影像学杂志,2015,24(4):320-323.
[5]张林,郝洁,王立平,等.乳腺超声造影、彩色多普勒超声及磁共振灌注成像在评估乳腺癌新辅助化疗疗效中的对比研究[J].华中科技大学学报(医学版),2014,43(4):449-452.
[6]罗葆明.超声弹性成像技术在乳腺疾病诊断中的应用[J].现代实用医学,2013,25(7):724-727.
[7]EISENHAUER E A,THERASSE P,BOGAERTS J,et al.New response evaluation criteria in solid tumours:Revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[8]OGSTON K N,MILLER I D,PAYNE S,et al.A new histological grading system to assess response of breast cancers to primary chemotherapy:prognostic significance and survival[J].Breast,2003,12(5):320-327.
[9]DENIS M,GREGORY A,BAYAT M,et al.Correlating tumor stiffness with immunohistochemical subtypes of breast cancers:prognostic value of Comb-Push ultrasound shear elastography for differentiating luminal subtypes[J].PLoS One,2016,11(10):e0165003.
[10]郝少云,欧冰,钟文景,等.弹性成像对新版BI-RADS-US评估乳腺肿物良恶性的价值[J].中国超声医学杂志,2015,31(4):292-295.
[11]李俊来,史宪全,曹晓林,等.乳腺病灶硬度不同的病理基础研究[J].中国超声医学杂志,2017,33(1):22-26.
[12]SLIMI T,MOUSSA I M,KRAIEM T,et al.Improvement of displacement estimation of breast tissue in ultrasound elastography using the monogenic signal[J].Biomed Eng Online,2017,16(1):19.
[13]PARK S,YOON J H,SOHN J,et al.Magnetic resonance imaging after completion of neoadjuvant chemotherapy can accurately discriminate between no residual carcinoma and residual ductal carcinoma in situ in patients with Triple-Negative breast cancer[J].PLoS One,2016,11(2):e0149347.
[14]李晶,姜罗,史铁梅.乳腺癌超声恶性晕病理基础[J].中华超声影像学杂志,2012,21(9):787-790.
[15]赵敏,张步林,何冰玲,等.超声弹性成像技术在乳腺癌新辅助化疗疗效评估中的应用[J].临床医学,2015,5(35):76-77.
[16]张紫杰,郭凤娟,张彦,等.超声评估乳腺癌新辅助化疗早期疗效的多因素分析[J].中国现代医学杂志,2016,7(26):40-43.

