褪黑素对羊精液低温保存效果的影响
李方舟,温 飞,杜烨青,张利坤,白秦生,胡建宏*
(1.西北农林科技大学 动物科技学院,陕西 杨凌 712100;2.杨凌职业技术学院,陕西 杨凌 712100;3.陕西省秦胜牧业有限责任公司,陕西 扶风 7222064)
人工授精技术(Artificial insemination, AI)可提高和保障羊的繁殖效率,促进良种羊的繁育,是一种已被大范围推广和应用的现代繁殖技术,为实现羊产业工业化、集约化奠定基础[1]。人工授精技术的关键则是精液的稀释保存。在实际生产中,养殖户和养殖企业多采用羊精液低温保存技术[2]。郑丕留等[3]研究发现,羊精液在3~5 ℃时精子活力最佳。孟娜娜等[4]在绵羊精液低温保存试验中,用大豆卵磷脂代替卵黄,发现当添加浓度为0.375%时保存效果最好。陈宗明等[5]在山羊精液低温保存试验中发现,稀释液中添加维生素C能有效提高精液品质。在低温条件下,由于精子代谢活动水平降低,营养物质消耗减少,会有效延长精子的生命周期[6]。但在精液的低温保存过程中,随着保存时间的延长,精液活性氧(Reactive oxygen species, ROS)含量偏高,氧化平衡遭到破坏,精子会发生脂质过氧化、DNA损伤、膜透性失效、蛋白质磷酸化等等一系列损害其生命的现象,进而影响精液低温保存效果[7-10]。因此,向低温稀释液中添加抗氧化物是必要的举措。褪黑素(Melatonin, MLT)是一种由松果腺合成和分泌的重要胺类激素,具有抗氧化能力,可保护细胞的细胞膜脂质、核酸、蛋白质等成分[11]。近年来已有许多研究中将褪黑素作为抗氧化剂运用到动物精液体外保存中,如猪精液低温保存[12]。但褪黑素在羊精液低温保存中的应用尚不多见,且其对羊精液的低温保存添加量以及影响效果尚不明确。本试验以不同浓度褪黑素添加到基础稀释液中,通过对精子活率、顶体完整性、质膜完整性、线粒体活性等指标的测定,进行精液品质分析,以期为羊精液低温保存稀释液配方的优化提供参考。
1 材料与方法
1.1 主要仪器与试剂
主要试验设备有显微镜(南宁松景天伦)、荧光显微镜(日本 Nikon)、恒温加热板、水浴箱、酶标仪(宝特Bio-Tek)、移液器(Sigma公司)、冰箱等。褪黑素、D-果糖、柠檬酸钠、PVA、EDTA、碳酸酸钠、葡萄糖、碘化丙啶(PI)、罗丹明123(Rh123)、二甲基亚砜(DMSO)等(均为sigma公司生产);磷酸盐缓冲液(PBS)购自上海佳和生物公司、HOST低渗膨胀试剂盒(GMS14017)购自Genmed 公司。
1.2 试验设计
本试验其分为五组,每组设三个重复。每组低温保存稀释液中分别加入褪黑色素0、10、20、40、80 mg/L。用各组低温保存稀释液稀释山羊精液,通过测定、分析各组5 d内的精子活率、顶体完整性、质膜完整性、线粒体活性评价不同褪黑色素添加量在山羊精液低温保存时的效果,并筛选出褪黑色素的最佳添加量。
1.3 精液样品的采集
试验所用精液为陕西大荔某牧业有限公司2~3岁的健康萨福克公羊,用假阴道法采集精液后,并立即进行活率检查,选择精子活率0.8以上精液放置于36~38 ℃保温杯中,1 h内带回实验室用于试验。
1.4 溶液的配制
羊精液低温保存基础稀释液:葡萄糖 1.15 g, D-果糖 1.45 g, 碳酸氢钠 0.125 g, 柠檬酸钠 1.17 g, PVA 0.25 g, EDTA 0.23 g, 青霉素 5 000 IU, 链霉素 0.1 g,融于100 mL超纯水中。
抗氧化剂添加:在各组稀释液中分别添加0、10、20、40、80 mg/L的褪黑素, 37 ℃下水浴静置30 min,待其冷却后,于4 ℃冰箱保存。
碘化丙啶(PI)贮存液:0.000 2 g PI 溶于10 mL PBS中,0.45 μm 滤膜过滤后,-20 ℃避光贮存。
罗丹明123(Rh123)贮存液:0.000 2 g 罗丹明123溶于1 mL DMSO,0.45 μm滤膜过滤后,避光贮存。
1.5 精液的稀释
精液采集前1 h,将稀释剂放置于37 ℃的水浴锅中。分别用5种含有不同浓度褪黑素的稀释液(0、10、20、40、80 mg/L),按照稀释液与精液 8:1 的比例分次将等温稀释液沿容器壁缓慢加入精液中,将精液进行稀释,并分别检测稀释后每组的精子活率。然后再将其裹上16层纱布放入4 ℃冰箱中(梯度降温),每12 h应翻动一次精液;每24 h检测其活率、质膜完整率、顶体完整率等。
1.6 指标检测
1.6.1 精子活率 精液摇匀后,取10 μL中层稀释精液制片,在37 ℃温度下,做显微镜(400×)检查,用估测法判定精子活率。
1.6.2 质膜完整率 用HOST试验法[13]进行精子质膜完整率测定。取20 μL 解冻孵育后的精液样品,在其中加入等温HOST 低渗溶液 200 μL 混匀,然后置于37 ℃恒温水浴锅中,30 min后,在显微镜下观察精子尾部的弯曲率(每组5个重复,每个重复不少于200枚精子)。
1.6.3 顶体完整率 采用姬姆萨染色法检测[14-15]测定顶体完整率。分别吸取30 μL试验组精液制片,自然干燥后用5%福尔马林溶液固定10 min,然后水洗,风干,再在姬姆萨液中染色1.5~2 h,洗去浮色,风干,在1000×显微镜下检查并计算顶体完整率(每次不少于200枚精子,重复5次)。
1.6.4 线粒体活性 取五个试管,在每个试管中分别加入PI贮存液1 μL、Rh123贮存液1 μL,避光培养10 min;取等温基础稀释液将各试验组精液稀释,调整精子密度至3×106~6×106。吸取50 μL稀释后的精液,加入上述避光培养的混合液中,37 ℃黑暗潮湿环境中培养30 min。然后取每组精液10 μL滴在载玻片上,在荧光显微镜(400×)下观察,每组5个重复,每个重复不少于200个精子,计算完整线粒体的精子的百分率。
1.7 统计分析
试验所得数据用 Excel 2013对试验数据进行初步整理,用SPSS22.0对结果进行方差分析,用Duncan法进行均值的多重比较,结果用“平均数±标准差”表示。
2 结果与分析
2.1 褪黑素对低温稀释保存后的羊精子活率的影响
由表1可知,精液低温保存0 d时,各试验组差异不显著(P> 0.05),表明精液刚稀释完时褪黑素对精液无明显影响。精液低温保存1 d时,加入不同浓度的褪黑素均能提高精子活率。而浓度为20 mg/L褪黑素试验组在各个时间段的精子活率均最高,且差异显著(P<0.05);而浓度80 mg/L褪黑素处理组效果最差,甚至低于没有加褪黑素的对照组。
2.2 褪黑素对低温保存后的羊精子质膜的影响
本研究中,精液刚稀释完时,五组的精子质膜完整率无差异(P>0.05);从保存的第3天开始,20 mg/L的褪黑素试验组,精子质膜完整率显著高于其他各试验组(P<0.05);在保存期间,10、20、40 mg/L褪黑素均能提高精子质膜完整率,而80 mg/L褪黑素小组在保存期间的处理效果均表现最差,显著低于其他各组(P<0.05)。
2.3 褪黑素对低温保存后的羊精子顶体的影响
本研究中,精液保存2 d后,浓度为10和20 mg/L褪黑素试验组的精子顶体完整率显著高于浓度为40和80 mg/L褪黑素试验组(P<0.05)。精液保存3 d后,浓度为20 mg/L褪黑素处理组的精子顶体完整率均显著高于其他各组(P<0.05);而在精液保存期间,浓度为80 mg/L褪黑素试验组的精子顶体完整率显著低于其他各组(P<0.05),甚至低于无褪黑素添加的对照组。
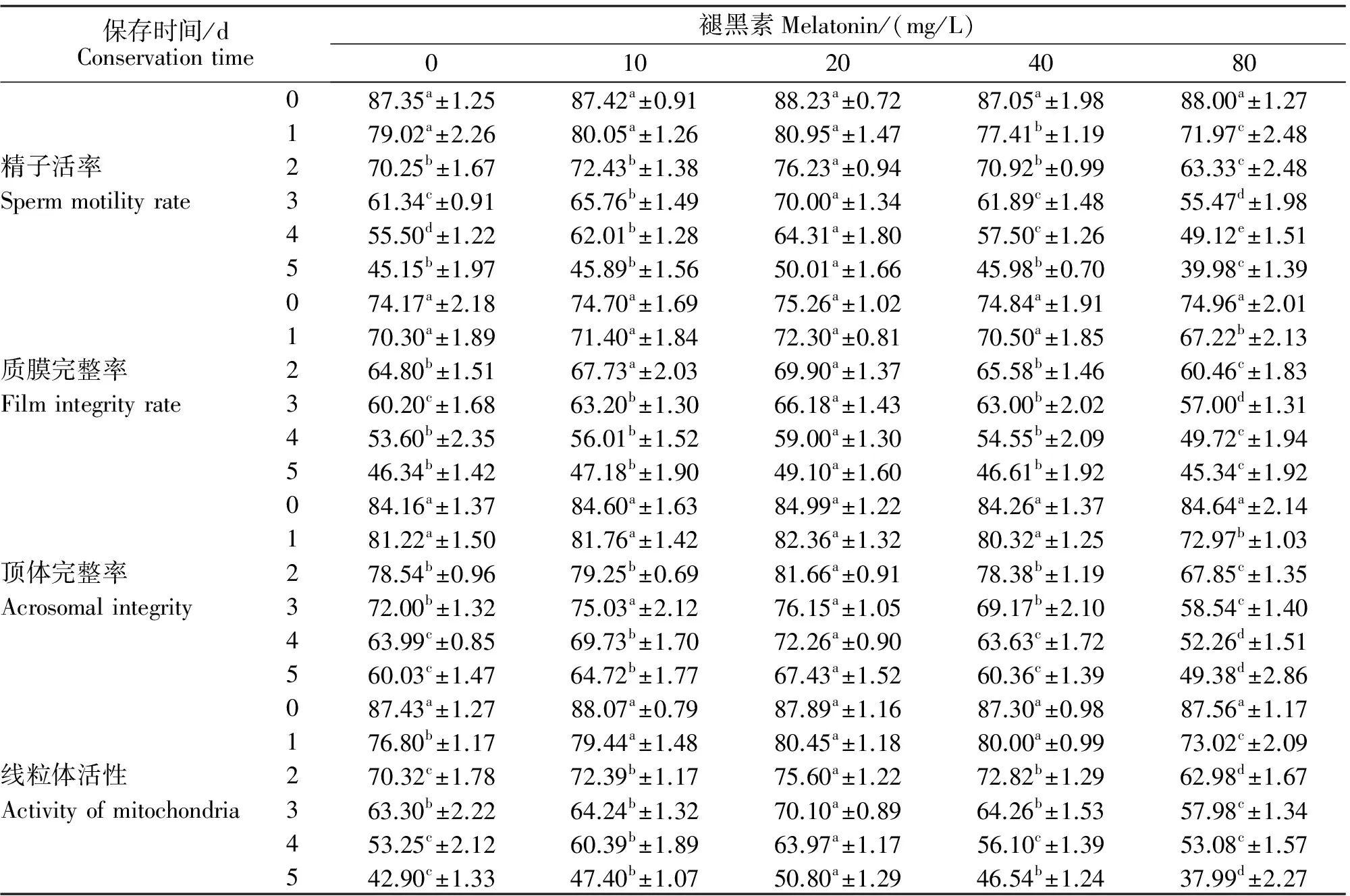
表1 不同浓度褪黑素对羊精液低温保存效果的影响Table 1 Effect of different concentrations of meletonin on conservation effect of sheep sperm at low temperture %
注:同行数据后的不同小写字母表示差异显著(P<0.05)。
Note:Different letter in the same row indicate significant difference(P<0.05),same letter indicate insignificant difference(P>0.05).
2.4 褪黑素对低温保存后的羊精子线粒体活性的影响
本研究中,精子线粒体活性随着褪黑素浓度的增加而呈现先升高后下降的趋势。精液保存1~4 d时,褪黑素浓度为20 mg/L组线粒体活性均高于其他各组;精液保存5 d时,褪黑素浓度为20 mg/L的处理组精子线粒体活性高于对照组,且差异显著(P<0.05);褪黑素浓度为80 mg/L的处理组精子线粒体活性显著低于对照组。
3 讨 论
在正常的生命活动中,许多生理功能需要依赖自由基/活性氧(ROS)来执行,因此自由基/活性氧(ROS)的存在必不可少。然而,Parrilla等[16]发现当含有过多ROS时,它会攻击一些重要的生物大分子,导致生物机体损伤。吕逸清等[17]研究发现,ROS与精子凋亡率呈正相关,这是因为在羊的精液低温保存中,ROS的含量会随着保存时间的延长而增加,致使精子发生脂质过氧化反应,影响精子的膜结构和功能,使精子线粒体和DNA受到损伤[18],这些损伤有可能会启动细胞凋亡程序,使精子发生凋亡,进而影响精液低温保存效果。本试验通过在羊的精液稀释液中加入不同浓度的抗氧化剂-褪黑素来研究对羊精液低温保存效果的影响,结果发现,在羊精液稀释液中添加适量浓度的褪黑素(20 mg/L),可维持精子活力,提高精子质膜完整性和顶体完整性以及线粒体活性,从而提高羊精液低温保存质量。提示褪黑素在精液的低温保存过程中能够减少ROS产生,起到保护精子,延长精液的低温保存时间的效果。
本研究发现,低浓度褪黑素有利于提高精子保存品质和保存时间,说明了添加抗氧化物的必要性。张天宝等[19]发现低浓度褪黑素能够促进抗凋亡蛋白Bcl2的表达,从而延长精子的保存时间。朱银莉等[20]在猪常温保存稀释剂中添加褪黑素,结果表明褪黑素能够延长精子的有效存活时间。在本试验中,低浓度的褪黑素能够提高山羊精液低温保存质量的试验结果和上述研究结果相一致。
4 结 论
本研究结果表明,添加一定浓度(10 mg/L、20 mg/L、40mg/L)的褪黑素有利于提高精子保存品质,能有效增加精子活率、顶体完整率、质膜完整率以及线粒体活性,其中褪黑素浓度为20 mg/L时效果最好。但随着添加褪黑素浓度的升高至80 mg/L,精子低温保存效果下降明显。
[1] PRADO V, ORIHUELA A, LOZANO S, et al. Management of the female stimulus during semen collection and its association with libido re-establishment and semen characteristics of goats[J]. Journal Of Animal Science, 2002,80(6):1 520-1 523.
[2] 刘铮铸, 李祥龙, 巩元芳, 等. 不同离心速率对波尔山羊精液低温保存效果的影响[J]. 草食家畜, 2002(4):37-39.
[3] 郑丕留, 王孝鑫, 秦志锐, 等. 在室温下保存猪、牛、羊精液的初步试验结果[J]. 畜牧兽医学报, 1962,5(2):131-142.
[4] 孟娜娜, 孙树春, 王寒阳, 等. 绵羊精液4 ℃液态保存的稀释液配方优化研究[J]. 中国畜牧杂志, 2015,51(5):34-38.
[5] 陈宗明, 密国辉, 许厚强, 等. 维生素C对贵州黑山羊低温保存精液品质的影响[J]. 贵州农业科学, 2012,40(6):146-147.
[6] BAILEY J L, BILODEAU J F, CORMIER N. Semen cryopreservation in domestic animals: a damaging and capacitating phenomenon[J]. J Androloly, 2000,21(1):1-7.
[7] HARRISON R A P, ASHWORTH P J C, MILLER N G A. Bicarbonate/CO2, and effector of capacitation, induces a rapid and reversible change in the lipid architecture of boar sperm plasma membranes[J]. Molecular Reproduction and Development, 1996,45(3):378-391.
[8] CURRY M R, KLEINHANS F W, WATSON P F. Measurement of the water permeability of the membranes of boar, ram, and rabbit spermatozoa using concentration-dependent self-quenching of an entrapped fluorophore[J]. Cryobiology, 2000,41(2):167-173.
[9] HENKEL R, KIERSPEL E, STALF T, et al. Effect of reactive oxygen species produced by spermatozoa and leukocytes on sperm functions in non-leukocytospermia patients[J]. Fertility and Sterility,2005,83(3):635-642.
[10] 许春荣, 陆媚, 刘德玉, 等. L-精氨酸对猪精液低温保存效果的影响[J]. 西北农业学报, 2014,23(11):12-16.
[11] 占今舜, 张彬. 浅谈褪黑素在动物生产中的应用[J]. 饲料博览, 2011(7):41-43.
[12] 杨宝卫, 李美珍, 黄明光, 等. 褪黑素与盐酸多巴胺在猪精液冷冻保存中的应用效果[J]. 贵州农业科学, 2012,40(8):154-155.
[13] 朱跃, 朱杰. 低渗肿胀精子类型对精子活动率及男性生育能力的影响[J]. 安徽医学, 2011(10):1 695-1 697.
[14] 王立铭, 曾培坚, 冯克明, 等. 绵羊精子姬姆萨染色生物显微镜顶体观察[J]. 新疆农业科学, 1981(4):43-45.
[15] 刘琦. 不同精子质膜保护剂对猪精液常温保存效果的影响[D]. 陕西杨凌:西北农林科技大学, 2015.
[16] PARRILLA I, VAZQUEZ J M, CABALLERO M, et al. Influence of storage time on functional capacity of flow cytometry cally sex-sorted boar spermatozoa[J]. Theriogenology,2005,64(1):86-98.
[17] 吕逸清, 陈斌, 胡凯, 等. 精子凋亡率与精子密度、活率、活力及活性氧关系探讨[J]. 中国男科学杂志, 2009(2):34-37.
[18] MARCHETTI C, OBERT G, DEFFOSEZ A, et al. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm[J]. Human Reproduction, 2002,17(5):1 257-1 265.
[19] 张天宝, 侯鹏高. 褪黑素生理活性及其作用机制的研究进展[J]. 齐齐哈尔医学院学报, 2015,36(11):1 671-1 673.
[20] 朱银莉. 抗凋亡试剂在猪精液液态保存中的应用研究[D]. 南宁:广西大学, 2012.

