肺炎患儿血清G-CSF、sTREM-1、sICAM-1水平的变化及意义
胡 晶,朱 敏,苏华平,闵 锋,谭心海
(湖北省天门市第一人民医院儿科 431700)
重症肺炎是儿科常见感染性危重疾病,是导致我国婴幼儿死亡的重要因素之一。与轻症肺炎主要累及呼吸系统不同,重症肺炎除累及呼吸系统外,还会累及其他器官,并引起呼吸功能衰竭[1]。重症肺炎早期缺乏明显的症状及体征,因此容易导致诊断延迟而影响患儿预后。目前研究指出,重症肺炎的发生与多种细胞因子共同作用及参与有关,这些细胞因子会导致内皮细胞功能损伤,激活凝血系统并引起凝血功能紊乱,加重患儿病情,并增加患儿死亡风险[2]。血清粒细胞集落刺激因子(G-CSF)是由单核细胞、内毒素活化巨噬细胞而生成的糖蛋白,是参与机体非特异性免疫反应及促进炎症作用的重要物质之一,在介导炎性反应中起到重要的作用[3]。可溶性髓系细胞触发受体-1(sTREM-1)具有促进白细胞迁移、调节白细胞及血管内皮细胞间黏附的作用,在炎症监测过程中起到重要的作用[4]。可溶性细胞间黏附分子-1(sICAM-1)是新近发现的一种可用于早期炎性疾病诊断的指标,与感染严重程度有密切的关系[5]。本研究应用酶联免疫吸附试验(ELISA)测定肺炎患儿与健康体检儿童血清G-CSF、sTREM-1、sICAM-1水平,并探讨3项指标在肺炎发生及预后诊断中的应用价值。现报道如下。
1 资料与方法
1.1一般资料 选择2015年6月至2016年6月本院收治的128例肺炎患儿,根据患儿临床症状及影像学诊断结果分为重症肺炎组(78例)及轻症肺炎组(50例)。重症肺炎组患儿符合中华医学会第十三届全国儿科危重症大会会议纪要制定的重症肺炎诊断标准[6],其中男42例,女36例;年龄1~12岁,平均(5.2±1.8)岁;支原体肺炎20例,细菌性肺炎32例,病毒性肺炎26例。轻症肺炎组患儿符合《实用儿科学》对小儿肺炎的诊断标准[7],其中男26例,女24例;年龄1~12岁,平均(5.9±2.2)岁。上述入选病例均排除以下患者:(1)肺部及其他部位感染者;(2)活动性肺结核者;(3)恶性肿瘤或器官移植者;(4)终末期肾功能及肝功能异常者;(5)近期应用过免疫抑制剂、抗凝药物、抗血小板药物者。另选取同期进行健康检查的50例健康体检儿童为对照组,男28例,女22例;年龄1~12岁,平均(5.7±0.8)岁。三组的性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。所有入选对象均在家属同意下参与研究,且研究经本院医学伦理委员会批准。
1.2方法
1.2.1标本采集 重症肺炎组每天抽取静脉血3 mL,进行血液标本检测。轻症肺炎组于入院后第1、3、7天抽取静脉血5 mL,而对照组于体检当天抽取静脉血5 mL。将血液标本置于肝素钠抗凝管中,以离心半径5 cm,2 500 r/min离心处理15 min,取上清液,于-20 ℃下保存待测。
1.2.2血清G-CSF、sTREM-1、sICAM-1水平测定 采用ELISA测定血清G-CSF、sTREM-1、sICAM-1水平。G-CSF试剂盒购于上海酶联生物科技有限公司,sTREM-1试剂盒购于北京艾然生物技术有限公司,sICAM-1试剂盒购于上海基免实业有限公司。操作过程如下:(1)在标本中加入特异性抗体形成固相抗体,并应用磷酸盐缓冲液洗涤及去除杂质。(2)加入受检标本,与固相抗体接触后进行反应,让固相载体与标本抗原结合并形成抗原复合物,并用洗涤剂去除杂质。(3)加入酶标抗体。标本中加入酶标抗体使其与固相免疫复合物结合,应用缓冲液将酶标抗体洗涤及去除,此时固相载体上带有的酶量与标本中受检物质的量呈正相关。(4)加入反应底物。加入酶催化底物,并根据颜色反应情况对抗原物质进行定性或定量测定。

2 结 果
2.1各组血清G-CSF、sTREM-1、sICAM-1水平比较 重症肺炎组、轻症肺炎组患儿入院第1天血清G-CSF、sTREM-1、sICAM-1水平显著高于对照组(P<0.05),且重症肺炎组血清G-CSF、sTREM-1、sICAM-1水平高于轻症肺炎组(P<0.05)。见表1。
2.2重症肺炎患儿死亡组与存活组血清G-CSF、sTREM-1、sICAM-1动态变化 重症肺炎组患儿存活56例(存活组),死亡22例(死亡组)。存活组患儿随着病情好转,血清G-CSF、sTREM-1、sICAM-1水平显著下降,至出院时恢复正常水平(P<0.05)。死亡组随着时间推移,血清G-CSF、sTREM-1、sICAM-1水平不断升高,并在死亡时达到最大值(P<0.05)。见表2。
2.3血清G-CSF、sTREM-1、sICAM-1水平变化在重症肺炎中的诊断价值 经ROC曲线分析可知,G-CSF诊断重症肺炎的ROC曲线下面积(AUC)为0.712;sTREM-1诊断重症肺炎的AUC为0.789;sICAM-1诊断重症肺炎的AUC为0.756。3项指标联合诊断的AUC为0.802,敏感度为85.8%,特异度为89.33%。见表3。

表1 各组血清G-CSF、sTREM-1、sICAM-1水平比较
注:与对照组比较,aP<0.05;与轻症肺炎组比较,bP<0.05

表2 重症肺炎患儿死亡组与存活组血清G-CSF、sTREM-1、sICAM-1动态变化
注:与第1天比较,aP<0.05;与第3天比较,bP<0.05;与第7天比较,cP<0.05
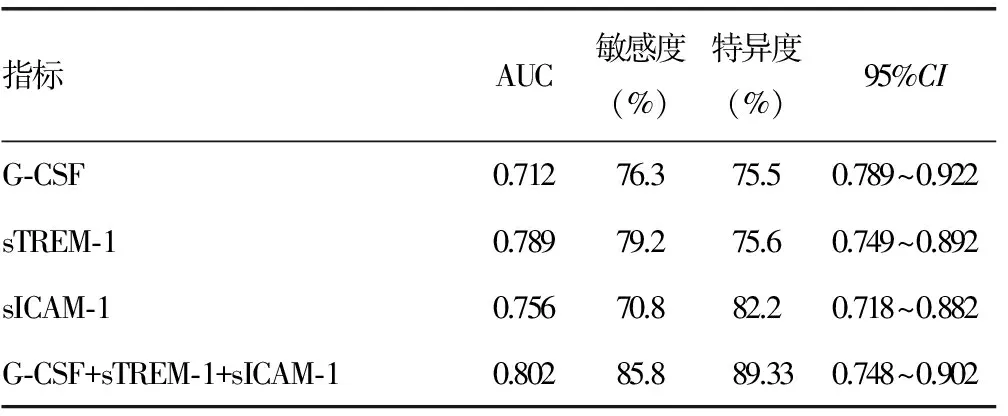
表3 血清G-CSF、sTREM-1、sICAM-1水平变化在重症肺炎中的诊断价值
2.4血清G-CSF水平与sTREM-1、sICAM-1的相关性 经Pearson相关分析,G-CSF水平与sTREM-1、sICAM-1呈正相关(r=0.356、0.337,P=0.000),而sTREM-1水平与sICAM-1呈正相关(r=0.322,P=0.000)。
3 讨 论
肺炎是儿科常见的感染性疾病,轻症肺炎患儿临床表现通常为咳嗽、发绀、酸性中毒、发热等,而重症肺炎患儿则表现为昏迷、酸中毒、气促、湿啰音等,且部分患儿表现为多器官功能衰竭及死亡。早期肺炎临床症状不典型,容易导致临床诊断延迟。目前对重症肺炎的诊断指标主要为实验室指标及影像学诊断。实验室指标主要采用C反应蛋白、降钙素原、白细胞计数及血小板计数等参数进行评价,但C反应蛋白、白细胞计数及血小板计数对感染性疾病缺乏特异性,而降钙素原仅能鉴别细菌感染性疾病[8]。X线及CT是目前常用的影像学诊断方法,CT对重症肺炎的诊断价值在于其可显示肺部病变程度、肺周围组织水肿及肺部阴影情况,但受限于X线或CT的检查时间,并不能反映肺炎患儿病情进展过程[9]。
血清G-CSF是一种糖蛋白,对调节机体内外粒细胞或单核细胞分化,促进粒细胞成熟具有作用,是机体抗炎过程中非特异性细胞免疫反应的重要标志物之一[10]。在正常状态下血清G-CSF水平较低,在发生炎性反应后,血清G-CSF水平将快速升高,当炎症得到有效控制后,血清G-CSF水平显著下降,且在肺炎患者中血清G-CSF水平升高较C反应蛋白、白细胞计数、血小板计数等参数早[11]。本研究中重症肺炎组、轻症肺炎组患儿血清G-CSF水平显著高于对照组,且重症肺炎组血清G-CSF水平高于轻症肺炎组;随着患儿病情预后及转归,血清G-CSF水平显著下降,而随着患儿病情恶化,血清G-CSF水平显著升高。因此,通过动态监测血清G-CSF水平将有助于评价重症肺炎患儿预后情况。
sTREM-1是髓系细胞触发受体-1分泌的亚型,当机体发生感染时被大量释放至血液中,是近年新发现的炎症指标[12]。相关研究指出,sTREM-1水平高低可反映机体感染程度,感染严重时sTREM-1水平明显升高,当机体炎症得到有效控制后,血清sTREM-1水平将下降[13]。VELSQUEZ等[14]认为,在巨噬细胞及中性粒细胞作用下,血清sTREM-1表达水平将显著升高,并在炎症级联反应中起到放大作用。本研究中重症肺炎组、轻症肺炎组患儿血清sTREM-1水平显著高于对照组,且重症肺炎组患儿血清sTREM-1水平高于轻症肺炎组;存活组患儿血清sTREM-1水平显著下降,而死亡组血清sTREM-1水平显著升高,说明sTREM-1属于促炎介质,通过动态监测sTREM-1水平变化趋势将能预测重症肺炎患儿预后情况。
sICAM-1属于细胞表面细胞间黏附分子(ICAM)-1水解产物,在细胞性肺炎中参与中性粒细胞炎性反应过程,在病毒性肺炎中上调上皮细胞ICAM并促进中性粒细胞与嗜酸性粒细胞黏附,可参与重症肺炎病理生理过程,是介导重症肺炎病情加重的重要因子之一[15]。本研究结果显示,重症肺炎组患儿血清sICAM-1水平显著高于轻症肺炎组及对照组,且随着患儿病情转归,血清sICAM-1水平显著下降。提示血清sICAM-1水平与肺炎严重程度有密切关系,通过动态监测血清sICAM-1水平将有助于评价患儿肺炎严重程度,可作为重症肺炎患儿预后的评价指标。
经ROC曲线分析可知,G-CSF、sTREM-1、sICAM-1在重症肺炎中AUC分别为0.712、0.789、0.756。3项指标的AUC均大于0.700,提示三者在重症肺炎诊断中均有一定的价值,而三者联合诊断的AUC为0.802,敏感度、特异度均高于单一指标诊断,从而提示临床工作者通过联合多项指标诊断可提高重症肺炎患儿诊断的敏感度及特异度。经Pearson相关分析可知,G-CSF水平与sTREM-1、sICAM-1呈正相关,而sTREM-1水平与sICAM-1呈正相关,提示3项指标间存在相关性,彼此相互作用、相互影响,共同参与重症肺炎的发生,但关于其内部机制还需要在今后工作中进一步研究。
综上所述,血清G-CSF、sTREM-1、sICAM-1可作为肺炎患儿有价值的诊断指标,通过监测3项指标的动态变化趋势能够反映肺炎患儿病情进展及预后。
[1]范新凤,潘家华.小儿重症肺炎临床特征分析[J].中国基层医药,2015,21(11):1661-1664.
[2]谢鹤,王朋朋,李贵才,等.儿童重症肺炎病原体检测与诊治分析[J].中国小儿急救医学,2014,21(5):281-284.
[3]周彦平.小儿肺炎血清粒细胞集落刺激因子、可溶性白细胞介素受体、C反应蛋白水平的变化及意义[J].实用临床医药杂志,2014,18(1):46-48.
[4]范春红,李时悦,范惠群,等.重症肺炎患者血浆可溶性髓样细胞触发受体1与可溶性血红蛋白清道夫受体的水平变化[J].重庆医学,2015,44(34):4780-4783.
[5]卫丽,白涛敏,穆志龙,等.早期小剂量糖皮质激素对儿童重症肺炎血清TNF-α、sICAM-1水平的影响[J].疑难病杂志,2016,15(7):729-732.
[6]周涛,钱素云.中华医学会第十三届全国儿科危重症大会会议纪要[J].中国小儿急救医学,2014,21(10):678-680.
[7]江载芳,申昆,沈颖,等.诸福棠实用儿科学[M].8版.北京:人民卫生出版社,2015:308-312.
[8]苑鑫,金欣,牛文凯,等.肺炎支原体肺炎快速评分法对社区获得性肺炎病原学的辅助诊断价值[J].中华结核和呼吸杂志,2015,38(7):497-500.
[9]李素荣,牟京辉,常丽,等.肺炎支原体感染所致儿童坏死性肺炎30例胸部CT表现及转归[J].中华儿科杂志,2013,51(3):211-215.
[10]SCHLINK S N,LAGER K M,BROCKMEIER S L,et al.Enhancement of innate immunity with granulocyte colony-stimulating factor did not mitigate disease in pigs infected with a highly pathogenic Chinese PRRSV strain[J].Vet Immunol Immunopathol,2016,179(5):70-76.
[11]RÖSLER B,HEROLD S.Lung epithelial GM-CSF improves host defense function and epithelial repair in influenza virus pneumonia-a new therapeutic strategy[J].Molecul Cellul Pediatr,2016,3(1):29-32.
[12]PALAZZO S J,SIMPSON T A,SIMMONS J M,et al.Soluble triggering receptor expressed on myeloid cells-1(sTREM-1) as a diagnostic marker of ventilator-associated pneumonia[J].Respir Care,2012,57(12):2052-2058.
[13]廖茜.TNF-α、sTREM-1、IL-6、PCT在慢性阻塞性肺疾病伴肺炎诊断中的应用[J].临床肺科杂志,2015,19(3):530-532,535.
[15]OKUDA R,MATSUSHIMA H,AOSHIBA K,et al.Soluble intercellular adhesion molecule-1 for stable and acute phases of idiopathic pulmonary fibrosis[J].Springerplus,2015,4(2):657-661.

