阿司匹林通过调节血管生成相关因子抑制非小细胞肺癌增殖及凋亡的机制
顾宪文,谷兰海,邢加强,李殿波,于海防
(山东省临沂市肿瘤医院胸外科 276000)
非小细胞肺癌是临床常见的恶性肿瘤,病死率居各类恶性肿瘤的首位,近年发病率呈上升趋势,患者预后差,5年存活率仅为13%[1]。目前临床上对非小细胞肺癌主要采用铂类化疗药物进行治疗,长期大剂量应用铂类化疗药物可增加患者耐药性,降低化疗敏感性[2]。因此,寻找有效的治疗方案对改善非小细胞肺癌患者预后,提高患者存活率有重要的意义。阿司匹林属于非甾体抗炎药物,可通过抑制环氧化酶活性而影响机体多种生理病理性活动[3]。文献[4]指出,阿司匹林可抑制多种肿瘤细胞增殖及生长,如肺癌、胃癌、食管癌、肝癌、乳腺癌及子宫内膜癌等。关云哲等[5]研究指出,长期服用阿司匹林等非甾体类抗炎药物能有效降低恶性肿瘤发生率。相关流行病学证实,非甾体类抗炎药物能有效降低结直肠癌发生率,可恢复机体抗肿瘤免疫功能[6]。本研究通过体外细胞培养探讨阿司匹林抑制非小细胞肺癌A549增殖及凋亡的作用机制,旨在为非小细胞肺癌临床预防及治疗提供指导。现报道如下。
1 材料与方法
1.1实验材料 非小细胞肺癌A549细胞(湖南丰晖生物科技有限公司);新生胎牛血清(上海恒远生物有限公司);RPMI1640培养基(上海博升生物科技有限公司);四甲基偶氮唑蓝(MTT,上海沪峰化工有限公司);二甲基亚砜(DMSO,上海伊卡生物技术有限公司)。
1.2仪器与试剂 光学显微镜(型号DMLP-MP30;上海光学仪器厂);微量移液器(20、200、1000 μL;DragonMed公司);台式微量离心机(型号H1650-W;北京大龙兴创实验仪器有限公司);高速冷冻离心机(型号A1330103;太仓市华美生化仪器厂);台式低温高速离心机(型号TD-35M/TD35;上海珂淮仪器有限公司);CO2培养箱(型号MCO-20AIC;上海旦鼎国际贸易有限公司);电子天平(BP211D型;Sartorius公司);酶联免疫检测仪(型号DNM-9602G型;北京普朗新技术有限公司);流式细胞仪(型号1401-X-20R;贝克曼库尔特有限公司)。血管内皮生长因子(VEGF)试剂盒(上海吉泰依科赛生物科技有限公司);表皮生长因子受体(EGFR)试剂盒(北京雅康博生物科技有限公司);成纤维细胞生长因子(FGF)试剂盒(上海纪宁实业有限公司);细胞凋亡检测试剂盒(北京索莱宝科技有限公司)。兔抗人VEGF克隆抗体、兔抗人EGFR克隆抗体、兔抗人FGF抗体均购于美国Santa Gruz生物公司,阿司匹林购于河南福森药业有限公司。
1.3方法
1.3.1非小细胞肺癌A549的培养 取非小细胞肺癌A549细胞,在无菌操作条件下置于含10%胎牛血清(100 U/mL青霉素+100 μg/mL链霉素)RPMI1640培养基中,恒温培养于37 ℃ CO2培养箱中,传代时依次加入0.01% Ⅱ型胶原酶、0.08%胰蛋白酶消化10 min,反复消化直至组织块消失。收集悬浮液,离心过滤后留取沉淀物,继续传代培养于37 ℃ CO2培养箱中,每次传代2~4 d,收集对数生长期细胞,每种实验重复3次。
1.3.2倒置显微镜下观察细胞形态 在6孔培养板中接种非小细胞肺癌A549细胞1×105个/孔,分别加入阿司匹林2.5、5.0、10.0、20.0 mmol/L,每组设3个复孔,将等体积生理盐水加入对照组,加入培养基,培养24 h,后应用倒置显微镜下细胞形态。
1.3.3噻唑蓝(MTT)法测定细胞生长抑制率 在96孔板中接种对数期非小细胞肺癌A549细胞1×104个/孔,将新生胎牛血清100 μL分别加入孔中,置于37 ℃ CO2培养箱中培养,24 h后加药,分别加入阿司匹林2.5、5.0、10.0、20.0 mmol/L,每组设3个复孔,将等体积生理盐水加入对照组,加入培养基,继续恒温培养于37 ℃ CO2培养箱中,分别加入5 g/L MTT溶液20 μL,待培养24、48、72 h后,继续恒温孵育4 h,将培养液去掉,依次加入经生物素标记山羊抗小鼠免疫球蛋白及辣根酶标记链霉卵白素工作液于室温孵育。应用酶标仪测量样品在570 nm处吸光度,并计算生长抑制率。细胞生长抑制率(%)=(1-药物组A值/对照组A值)×100%。
1.3.4非小细胞肺癌A549细胞凋亡率测定 应用0.25%胰酶消化细胞制备悬液,在6孔培养板中培养对数生长期非小细胞肺癌A549细胞1×105个/孔。分别加入阿司匹林2.5、5.0、10.0、20.0 mmol/L,每组设3个复孔,将等体积生理盐水加入对照组,加入培养基,收集细胞于作用24 h后。采用70%乙醇固定细胞,行 Annexin V/PI双染色,具体操作:取10万个细胞,离心5 min,弃去上清液,加入200 μL Annexin V-FITC结合液,轻轻重悬细胞,室温下避光孵育10 min,离心处理5 min后加入190 μL Annexin V-FITC结合液,轻轻重悬细胞,加入10 μL碘化丙啶染色液,轻轻混匀,冰浴下避光放置10 min后上机使用流式细胞仪测定细胞凋亡率,重复操作3次。
1.3.5Western blot法测定相关蛋白 分别在10 mmol/L阿司匹林作用A549细胞24、48 h后加入细胞裂解液,并于低温下高速离心30 min,收集上清液,加入考马斯亮蓝染色,酶标仪测定蛋白水平,并置于沸水中加热5 min破坏蛋白结构,加入10% SDS-聚丙烯酰胺凝胶垂直电泳分离蛋白,并转移至PVDF膜上,加入5%脱脂奶粉封闭过夜,分别加入兔抗人VEGF克隆抗体、兔抗人EGFR隆抗体、兔抗人FGF抗体,TBST洗涤2次,ECL显影压片。

2 结 果
2.1阿司匹林作用非小细胞肺癌A549细胞形态学观察 在倒置显微镜下观察10.0 mmol/L阿司匹林作用非小细胞肺癌A549 48 h后,细胞呈通透性增加,形态不规则,细胞脱落、破碎等改变。见图1。
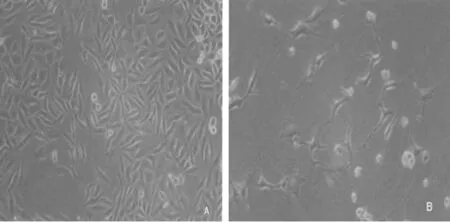
注:A为对照组非小细胞肺癌A549细胞形态学表现;B为10.0 mmol/L阿司匹林作用非小细胞肺癌A549 48 h后细胞形态学表现
图1阿司匹林作用非小细胞肺癌A549细胞形态学观察
2.2阿司匹林对非小细胞肺癌A549细胞增殖抑制作用 MTT结果显示,阿司匹林可抑制非小细胞肺癌A549细胞增殖,且呈剂量及时间依赖性。见表1。

表1 阿司匹林对非小细胞肺癌A549细胞的生长抑制率
注:与24 h相比,*P<0.05;与48 h相比,#P<0.05;-表示无数据
2.3阿司匹林诱导非小细胞肺癌A549细胞凋亡 未经处理的非小细胞肺癌A549细胞处于G0/G1期的高达60%,较少处于凋亡期。经阿司匹林处理后,A549细胞处于G0/G1期数量明显减少,而处于S期的细胞数明显增加。随着药物水平增加,细胞周期改变,大部分细胞在S期发生凋亡,凋亡率呈时间及剂量依赖性。见表2。

表2 阿司匹林作用非小细胞肺癌A549细胞48 h后各周期细胞凋亡率
注:与0.0 mmol/L阿司匹林比较,*P<0.05
2.4阿司匹林抑制肿瘤VEGF、EGFR、FGF蛋白表达 阿司匹林作用A549细胞后VEGF、EGFR、FGF蛋白表达水平明显下降,且呈剂量依赖性,提示阿司匹林抑制A549细胞凋亡的机制可能与其抑制血管相关生成因子表达,影响肿瘤新生血管生成有关。见图2。
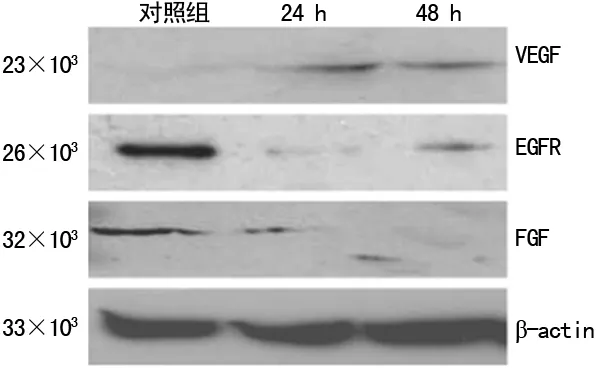
图2 阿司匹林抑制肿瘤VEGF、EGFR、FGF蛋白表达
3 讨 论
化疗是目前治疗非小细胞肺癌的重要手段,但大部分化疗药物会产生不良反应,影响患者化疗依从性[7]。此外,长期应用同一种化疗药物治疗容易导致机体产生耐药性,影响化疗效果。因此,寻找安全有效的抗肿瘤治疗方案对改善非小细胞肺癌患者预后,提高患者存活率具有积极的作用。阿司匹林属于非甾类药物,近年研究表明,阿司匹林在抗肿瘤治疗方面具有广阔的应用前景[8]。刘宇等[9]通过大样本对照研究发现,慢性胃溃疡患者中服用过阿司匹林的患者其胃癌发生率明显低于未服用过阿司匹林者,经年龄、性别及社会因素校正后,提示服用阿司匹林可将胃癌风险明显降低,且随着用药频率的增加,风险进一步降低。LICHTENBERGER等[10]研究指出,阿司匹林不仅能降低多种恶性肿瘤的发生率,而且还可通过抑制糖原合成酶激酶-3β及其下游基因产物活性,达到吉西他滨促进胰腺癌细胞凋亡的作用。本研究发现,阿司匹林能够对非小细胞肺癌A549细胞增殖产生明显的抑制作用,使细胞活性降低,将细胞阻滞在DNA合成的S期,从而有效诱导细胞凋亡,并呈时间及剂量依赖性。
肿瘤的生成、增殖及转移过程伴随着血管的生成,肿瘤血管生成过程包括内皮细胞迁移、增殖、管状结构形成及血流贯通等步骤,而在这个过程中血管生成相关因子起到重要的作用[11]。目前研究指出,VEGF、EGFR、FGF等多种因子在肿瘤血管生成中起到重要的调节作用[12]。VEGF是最强的促血管生成因子,可与血管内皮细胞表面受体结合,并增加血管通透性,介导血管内皮细胞迁移。同时VEGF可激活PI3K/Akt信号通路,促进血管内皮细胞增殖,并诱导血管生成,促进肿胀形成。阿司匹林能够抑制原癌基因ErbB2的表达,进而抑制其下游细胞VEGF信号通路表达,抑制此信号通路在阿司匹林诱导的血管新生中起重要作用。EGFR属于酪氨酸激酶型受体,可参与细胞增殖及血管生成[13]。HENRY等[14]研究指出,EGFR可介导多种信号转导并参与肿瘤进展,促进肿瘤细胞增殖、侵袭及转移。研究指出,阿司匹林的抗肿瘤作用机制主要与抑制EGFR的表达有关,阿司匹林对胃癌的抑制作用主要与其抑制EGFR的表达有关[15]。FGF由内皮细胞、平滑肌细胞、巨噬细胞分泌。它的作用是促进内皮细胞的游走和平滑肌细胞的增殖,能够修复损伤的内皮细胞及促进新血管形成。因此,通过下调非小细胞肺癌患者肿瘤细胞中VEGF、EGFR、FGF表达将有助于抑制肿瘤的生成。本研究结果显示,阿司匹林作用A549细胞后VEGF、EGFR、FGF表达水平显著下降,且呈剂量依赖性,提示阿司匹林抑制A549细胞凋亡的机制可能与其抑制血管相关生成因子表达,影响肿瘤新生血管生成有关。
综上所述,阿司匹林可抑制非小细胞肺癌A549细胞体外增殖,诱导细胞在S期凋亡,其凋亡机制可能与阿司匹林可抑制肿瘤血管生成相关因子表达有关。
[1]程光.不同化疗方案治疗老年Ⅲ期非小细胞肺癌的效果及预后[J].中国老年学杂志,2015,34(13):3636-3637.
[2]刘飞,贾鑑慧,孙丽萍,等.奥利沙铂、多西紫杉醇化疗方案联合同步三维适形放疗治疗晚期非小细胞癌的近期临床疗效观察[J].现代生物医学进展,2014,14(7):1315-1319.
[3]张根豪,刘俊文,苏利沙,等.阿司匹林对人卵巢癌组织和SKOV3细胞SOX7表达和Wnt/β-catenin信号通路的影响[J].郑州大学学报(医学版),2015,58(2):240-243.
[4]李涛,乔筱玲,王敏,等.阿司匹林促进干扰素-α诱导肝癌凋亡的作用机制[J].中华肝胆外科杂志,2014,20(9):670-674.
[5]关云哲,王振中.小剂量阿司匹林对前列腺癌细胞的增殖抑制作用研究[J].中国实验诊断学,2014,17(5):821-822.
[6]ZELL J A,MCLAREN C E,ALBERS C G,et al.A phase IIa clinical biomarker trial of aspirin and dietary arginine restriction in colorectal cancer patients[J].J Clin Oncol,2011,29(15):132-135.
[7]田伟,豆亚伟,戴云,等.不同化疗方案治疗晚期非小细胞肺癌的临床疗效及肿瘤标志物与疗效的相关性研究[J].河北医学,2016,22(8):1305-1307.
[8]王南雄,吕军,胡卫列,等.阿司匹林预防前列腺癌内分泌治疗后心血管疾病的效果及安全性[J].广东医学,2014,51(7):1105-1107.
[9]刘宇,高东,钟静静,等.阿司匹林与氟尿嘧啶协同抑制结肠癌细胞生长增殖的机制研究[J].中国病理生理杂志,2014,2(6):988-993.
[10]LICHTENBERGER L M,PHAN T,FANG D,et al.Bioavailability of aspirin in rats comparing the drug′s uptake into gastrointestinal tissue and vascular and lymphatic systems:implications on aspirin′s chemopreventive action[J].J Physiol Pharmacol,2016,67(5):635-642.
[11]SHIAO J,THOMAS K M,RAHIMI A S,et al.Aspirin/antiplatelet agent use improves disease-free survival and reduces the risk of distant metastases in Stage Ⅱand Ⅲ triple-negative breast cancer patients[J].Breast Cancer Res Treat,2017,161(3):463-471.
[12]ITALIAN A I.Aspirin use for the primary prevention of cardiovascular disease and cancer:reflections on the 2016 U.S.Preventive Services Task Force recommendation statement[J].G Ital Cardiol(Rome),2016,17(11):881-883.
[13]YANG L U,CHEN Y J,TANG Z,et al.Aspirin and levofloxacin for the prevention of the occurrence of prostate cancer or transformation to castration-resistant prostate cancer:a two-part,open-label,randomised,controlled study[J].Lancet,2016,388(1):85-90.
[14]HENRY W S,LASZEWSKI T,TSANG T,et al.Aspirin suppresses growth in PI3K-Mutant breast cancer by activating AMPK and inhibiting mTORC1 signaling[J].Cancer Res,2017,77(3):790-801.
[15]HUANG X Z,CHEN Y,WU J,et al.Aspirin and non-steroidal anti-inflammatory drugs use reduce gastric cancer risk:a dose-response meta-analysis[J].Oncotarget,2017,8(3):4781-4795.

