供磷水平对玉米丛枝菌根侵染及其对异质养分吸收的影响
金 鑫,曾新颖,齐昌国,尹黎燕,邓 燕
(海南省热带生物资源可持续利用重点实验室/海南大学热带农林学院,海南海口 570228)
磷是植物生长发育必需的重要养分之一,与其他营养元素相比,在土壤中极易被固定,较难移动,通常是植物最难获取的养分[1]。第二次全国土壤普查表明我国多数土壤缺磷,尤其是南方的酸性土壤[2]。当前,施用磷肥已成为农业生产中重要的增产措施,但过量施肥引起的环境问题日益突出,使农业增产承受着巨大的资源和环保压力[3]。发挥植物和微生物的生物学潜力高效获取磷,有助于提高磷肥利用效率,减轻环境压力[4]。
丛枝菌根真菌 (arbuscular mycorrhizal fungi,以下简称AM真菌) 是一类广泛存在于自然环境中的重要微生物,可与70%~80%的陆生植物形成丛枝菌根共生体系,其中包括绝大多数的作物 (除十字花科和藜科)[5]。丛枝菌根的形成对宿主植物生长有多种促进作用,其中以促进宿主植物磷素吸收的报道最为广泛[6-7]。研究表明,形成丛枝菌根的植物具有两种磷吸收途径,一种是根系本身通过根毛和表皮的直接吸收途径,另一种是菌根吸收途径,以根外菌丝为获取磷的主要部位[7]。丛枝菌根的根外菌丝直径比根毛还小,可以进入根系本身不能进入的土壤微小空间获取磷,还能延伸到由植物根系直接吸收土壤磷而形成的耗竭区域以外吸收磷,增加了磷营养的来源[8]。据报道,丛枝菌根的根外菌丝可以延伸至距离根系25 cm远的土壤空间获取养分[9]。此外,根外菌丝吸收的磷主要以聚磷酸盐颗粒的形式在菌丝内运输,到达与植物根系细胞接触的部位再降解成简单的无机磷转移给宿主植物,其运输速率明显高于根系直接吸收途径[7]。因此,丛枝菌根的形成及根外菌丝的分布对磷的获取有重要意义。研究表明可以通过分根装置或埋袋子、管子的形式对菌丝进行原位监测,也有通过32P和33P标记的方式来证明菌丝确实帮助植物吸收了磷[10-11]。AM真菌对根系的侵染以及土壤中菌丝的发育,不受土壤的物理扰动和植株残体的保留影响,不同种类的AM真菌对土壤养分吸收的贡献不一,有的敏感,有的不敏感,通过接种AM真菌也可以提高植株对养分的吸收,尤其是磷[12]。菌根在土壤中可以满足植物对磷的吸收,这种作用的好处是给根系更多的自由以满足生长所需的其他资源,并适应多变的土壤[13]。
土壤养分空间异质性普遍存在于自然生态系统中[14-15],磷在土壤中难移动、分布不均匀,具有明显的空间异质性[16]。南方酸性土壤养分易发生淋洗、固定等土壤经常表现出高度的异质性,而异质环境更利于植物养分的获得[17]。不同植物种根系对土壤养分空间异质性的反应不一致,结果可能造成植物生长的差异。当一定量养分以较高的异质性供应时,敏感度较高的植物种表现为总生物量的增加[18]。研究表明,植物根系生长对磷的空间异质性具有特殊的响应,即在养分富集区域大量增生,或以增加根系分泌物的释放和提高养分吸收速率等方式来促进对这部分磷的吸收[19-20]。对于丛枝菌根的根外菌丝来说,可以进入根系本身不能进入的空间获取磷,也可能受到这种养分空间异质性的影响。研究根外菌丝对局部磷养分的获取如何受AM真菌侵染和环境磷养分的影响,有助于深入理解AM真菌的功能。同时,异质养分可以使这类物种在集约化生态系统中保持多样性[21]。玉米是典型的菌根植物,即使在高磷供应的集约化生产条件下仍能保持较高的AM真菌侵染[22]。本研究以玉米为宿主植物,利用酸性土壤进行了不同供磷水平的盆栽试验,测定了玉米的生长与磷吸收、土著AM真菌的侵染和根外菌丝密度以及菌丝对局部磷养分的获取,以期更好地理解土壤磷素供应对丛枝菌根的调控。
1 材料与方法
1.1 试验材料
试验于2016年4月26日至5月31日在海南大学热带农林学院基地温室进行。供试土壤为采自海南省儋州市的砖红壤 (多年未种植的荒地,周边地块种有木薯),基础理化性质为pH 4.67 (土水比1∶2.5)、有机质18.00 g/kg、碱解氮54.23 mg/kg、有效磷14.14 mg/kg、速效钾151.99 mg/kg。土壤经风干后过2 mm筛,混匀后取一部分放入布袋中高压蒸汽灭菌 (121℃间歇灭菌2 h),放于干净牛皮纸上晾干,然后收入密封袋中,备用 (塑料管中的土为灭菌土,其余为正常土)。挑选大小一致且籽粒饱满的玉米种子,用10% H2O2进行表面消毒10 min,再用蒸馏水冲洗多次,然后置于放有湿润滤纸的培养皿中,于25℃恒温培养箱中催芽2 d,选萌芽程度一致的玉米种子播种,每盆播种4粒,出苗4 d后间苗至2株。种植容器为白色塑料花盆,规格为直径25 cm,高30 cm。
1.2 试验设计
本试验设置了3个供P水平:0、50、500 mg/kg,以P0、P50、P500表示。由磷酸二氢钾提供磷,每个处理设6次重复,共计18盆。在此基础上,每个处理再设置局部养分处理,方法是将白色塑料瓶去掉顶端瓶口,保留底部,形成直径5 cm、高5 cm的小管,管内装入120 g灭菌土,灭菌土中提前加入磷酸二氢钾使土壤含P 50 mg/kg,再分别用孔径为0.45 μm (-H处理,根系与菌丝都不能通过)和50 μm (+H处理,根系不能通过,菌丝能通过) 的尼龙膜封住管口。
每盆装土5 kg、椰糠1 kg (防止土壤板结),装盆前将根据对应处理加入的磷酸二氢钾、土和椰糠充分混匀,装盆时先铺一层5 cm左右深的土,再每盆分别垂直放入一个 -H管和一个 +H管,覆膜的一端朝上,对称放置,然后填满土,浇水。为了保证玉米生长期间不受其他养分缺乏的胁迫,以营养液的形式补充除磷以外的其他养分:N 60 mg/kg、K 67 mg/kg、Ca 20 mg/kg、Mg 7.5 mg/kg、Mn 0.5 mg/kg、Cu 0.35 mg/kg、Zn 0.9 mg/kg、Mo 0.02 mg/kg。整个试验过程中,每盆的浇水量及营养液保持一致。
1.3 样品采集与分析
分别从播种后7天和14天开始测量株高和叶片SPAD值,每隔7天测一次,直到收获。株高取土表到茎顶端分叉处两点的距离,SPAD值测定最新完全展开叶的末端,每盆数据取两株玉米的平均值。收获时,每盆中的两株玉米将地上部与根系分开收获。植株样品带回实验室洗净,其中小部分根系鲜样用于丛枝菌根侵染测定,即按照常规步骤,透明、酸化、染色、脱色,然后随机选取30条根段,制片,镜检。按照丛枝菌根侵染和丛枝丰度分级的标准,将镜检记录的等级参数输入“Mycocalc”软件,计算出F%、M%、A%和V%等参数,其中F%代表含有真菌结构的根系占整个根系的比例,M%代表整个根系中AM真菌结构形成的强度,A%代表在整个根系中丛枝结构形成的丰度,V%代表在整个根系中泡囊形成的丰度[23]。剩下的根样和地上部样品在80℃烘干至恒重,称重,磨样,然后用H2SO4-H2O2消煮、钒钼黄比色法测定磷浓度[24]。收获时,按土体土 (除塑料管之外的土)、-H土和+H土 (塑料管中的土) 分别取土样,带回实验室风干,过2 mm筛。一部分土样用于根外菌丝密度的测定,采用真空泵微孔滤膜抽滤的方法[25];一部分用于土壤速效磷的测定,采用0.03 mol/L NH4F-0.025 mol/L HCl浸提、钼锑抗比色法测定[24]。
1.4 统计分析
试验数据用Microsoft Office Excel 2007进行整理,用SPSS 13.0统计软件进行方差分析,用LSD法进行处理间多重比较,用Origin Pro 9.1软件作图。
2 结果与分析
2.1 不同供磷水平对玉米植株生长的影响
从图1可知,玉米株高随种植时间推移呈逐渐升高趋势,叶片SPAD值则表现为先升高后降低,两者都随供磷水平的增加而增加。前21天,P50和P500处理的株高和叶片SPAD值比较接近,明显高于P0处理;之后至收获时,P50与P500处理的株高差距逐渐变大,P50与P0处理的叶片SPAD值逐渐接近,表明供磷水平对玉米植株生长的影响受生育时期的调控。叶片生长初期,SPAD值随生育进程而逐渐增加,在叶片功能期内变化较小,叶片进入衰老后,SPAD值逐渐下降,受生育期调控。
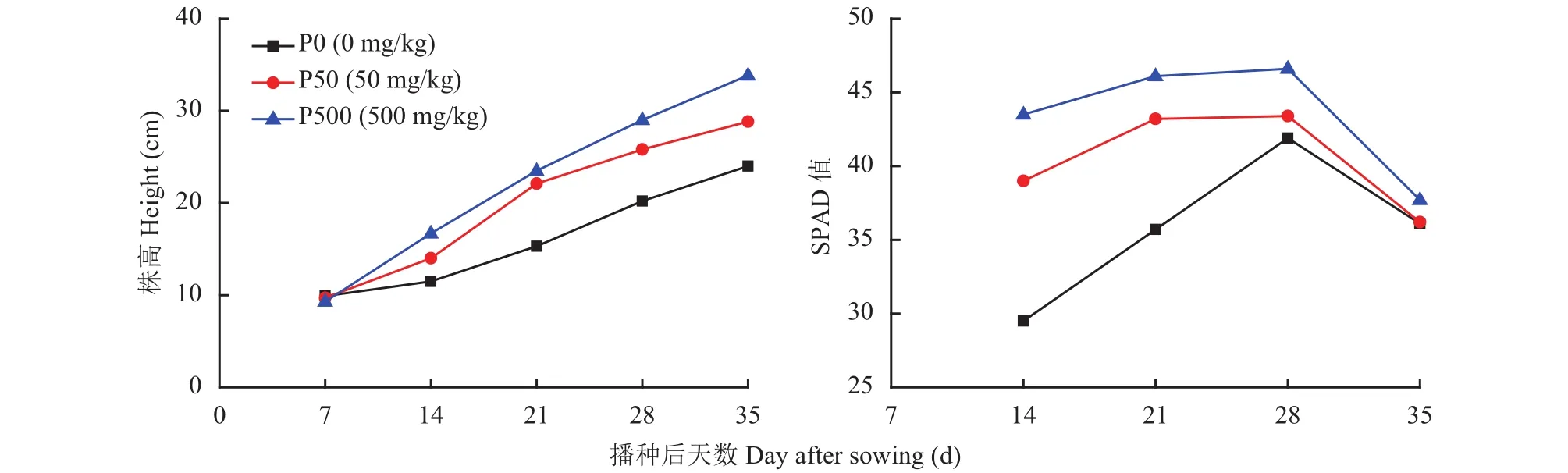
图1 不同供磷处理玉米株高和叶片SPAD值的变化Fig. 1 Dynamic of plant height and leaf SPAD values for maize under different P application treatments
由表1可知,随着供磷水平增加,玉米根系干重表现为先升后降,P50处理的根系干重显著高于P0和P500处理,表明中等供磷水平能够促进根系生长,而不施磷和过高供磷都会抑制根系生长。相应地,地上部干重表现为随供磷水平的增加而快速上升,高磷处理P500的地上部干重约是不施磷处理P0的2.5倍。与地上部干重趋势一致,全株干重也随供磷水平升高而快速增加,处理间差异显著。但植株的根冠比则随供磷水平的增加而迅速降低,说明在低磷条件下玉米植株会将更多的光合产物分配到根系。
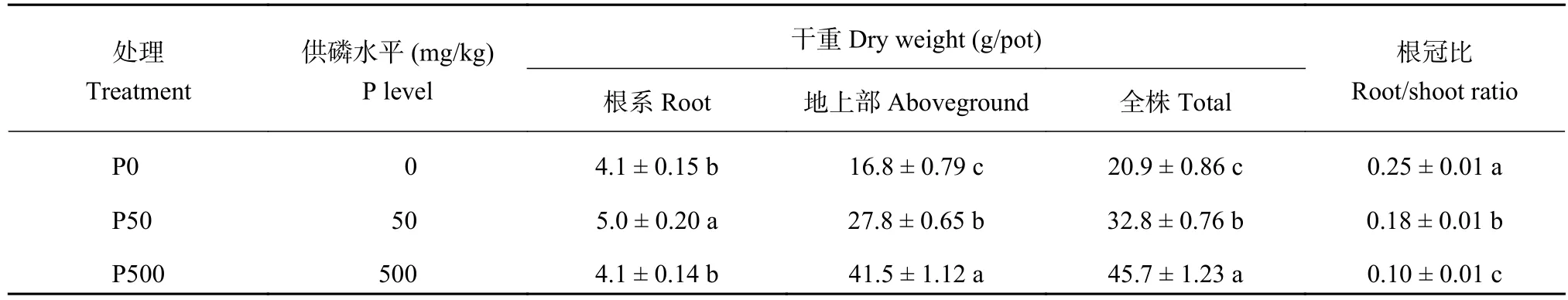
表1 不同供磷处理玉米植株干重与根冠比Table 1 Dry weight and root/shoot ratios for maize plants under different P application treatments
2.2 不同供磷水平对玉米磷吸收的影响
从表2可以看出,根系和地上部磷浓度都随供磷水平的升高而升高,P0和P50处理的磷浓度水平较低且接近,P500处理的磷浓度大幅度增加。同样,玉米植株总吸磷量随供磷水平增加而快速升高,P50和P500处理的吸磷量分别是P0处理的2.1倍、9.7倍。

表2 不同供磷处理玉米磷浓度与磷吸收量Table 2 P concentrations and uptakes for maize plants under different P application treatments
2.3 不同供磷水平对丛枝菌根侵染的影响
从表3可以看出,在三个供磷水平下玉米根系均有不同程度的AM真菌侵染。P50处理的F%达到100%,表明所有根系都有AM真菌侵染点的存在,形成的真菌结构在根系中的比例高达43.8%(M%),丛枝和泡囊结构也发育较好,在根系中的丰度分别为34.2%(A%)、71.7%(V%)。这些结果表明P50处理下AM真菌与玉米根系形成的菌根共生体系发育状况良好。P0处理与P50处理相比,F%、M%和A%没有显著差异,但泡囊丰度V%明显降低,表明不施磷条件下丛枝菌根的发育受到一定程度的抑制。在P500处理条件下,虽然87.2%的根系具有AM真菌侵染点,但整个根系形成的真菌结构、丛枝和泡囊的丰度都很低,远远低于P0和P50处理,表明丛枝菌根的发育受到严重抑制。

表3 不同供磷处理玉米丛枝菌根侵染Table 3 Arbuscular mycorrhizal colonization of maize plants under different P application treatments
2.4 不同供磷水平对根外菌丝密度的影响
由表4可知,随着供磷水平升高,土体土的菌丝密度总体呈下降趋势,但P50处理只比P0处理略有下降,没有显著差异,P500处理菌丝密度大幅度降低,表明高磷供应时根外菌丝发育受到较大抑制。-H处理管中的菌丝密度在三个供磷水平下都保持在极低水平,且没有显著差异,表明0.45 μm的尼龙膜有效阻止了菌丝的进入。+H处理管中的菌丝密度也随供磷水平升高而降低,在P50处理就下降明显,P50与P500处理没有显著差异,说明在中等和高供磷条件下进入管中的菌丝数量明显减少。在相同供磷水平下,土体土的菌丝密度最高,其次是+H处理,-H处理的菌丝密度最低,但值得注意的是P0处理下+H处理管中的菌丝密度只略低于土体土。
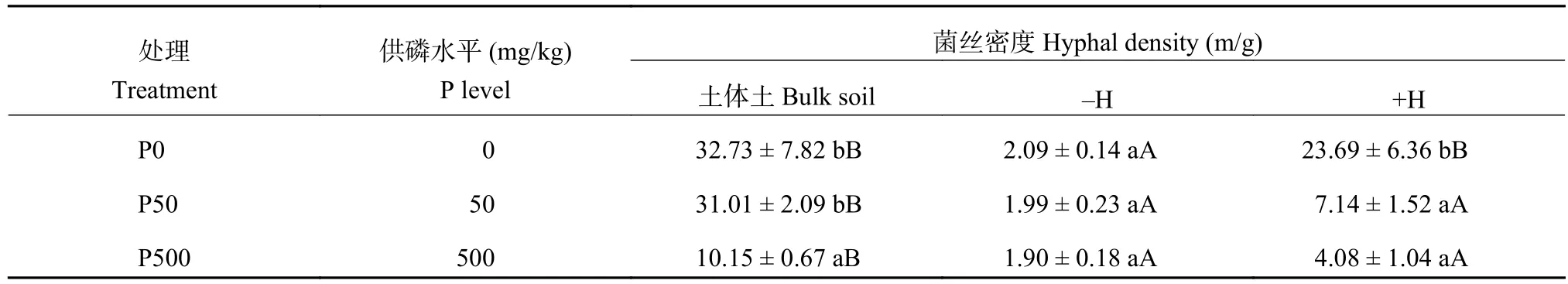
表4 不同供磷处理玉米根外菌丝密度Table 4 Hyphal density of maize plants under different P application treatments
2.5 不同供磷水平对土壤有效磷的影响
从表5可以看出,随着供磷水平升高,土体土有效磷含量快速上升,P500处理下达极高水平。在P0和P50处理下,-H处理的土壤有效磷含量没有差异,而+H处理的土壤有效磷含量在P50处理下高于P0处理,P500水平下-H和+H处理的土壤有效磷含量都显著升高,很可能是因为土体土中高浓度的磷通过浇水随水流进入塑料管中。在P0处理下,土体土有效磷含量明显低于-H和+H处理,菌丝能进入的+H处理比菌丝不能进入的对照处理-H有效磷含量下降了9.04 mg/kg,两者之间差异显著。在P50处理下,土体土有效磷含量已超过-H和+H处理,此时+H处理与-H处理相比有效磷含量下降幅度变小,为4.15 mg/kg。在P500处理下,土体土有效磷含量远高于-H和+H处理,+H处理与-H处理相比有效磷含量没有下降,两者差异不显著。P500处理磷浓度过高,这可能是因为处理管子是竖直放置的,浇水时可能使部分磷流入管子中,导致管子里磷浓度升高。

表5 不同施磷处理土壤有效磷含量Table 5 Soil available P contents under different P application treatments
3 讨论
酸性土壤对磷的固定作用强烈,即使土壤全磷含量不低,对植物的有效性也可能很低。本试验中,在中等供磷处理,尽管土壤有效磷含量已达42.66 mg/kg,处于较高水平,从玉米植株生长和体内磷浓度来看,仍与最高施磷处理有很大的差别,还处于养分胁迫状态。在P0处理下,玉米植株所受的缺磷胁迫更严重。在缺磷条件下,植物会将更多的光合产物用于根系生长,以增加根系对磷的吸收,植株根冠比会增加[26],本试验P0和P50处理的结果验证了这一点。尽管P0处理的根冠比最高,但根系干重并不是最高,在P50处理下根系生长最好,该结果与李晓林[27]和Deng等[22]的研究结果一致。在极低供磷条件下,根系生长受抑制是因为植株总光合产物有限,只能增加根系的相对生物量;在极高供磷条件下,植株以较小的根系就能获取足够的磷满足生长需要,降低根生物量能节约光合产物,更多地用于地上部生长,这反映了植物对环境养分变化的自我调节能力。
本试验中,P50处理与P0处理相比,丛枝菌根的侵染并没有下降,孢囊结构的比例还有明显增加,表明P50处理具有更好的菌根发育。李晓林认为,当供磷水平过低时,不仅宿主植物不能获取足够的磷而使生长严重受限,AM真菌也不能获得足够的磷以满足自身正常生长,侵染率会降低,适当的供磷可以满足AM真菌自身对磷的需求,促进其生长[27],本试验结果验证了这一点。当供磷超过一定水平,丛枝菌根侵染就会受到抑制,这很可能是因为植株体内磷含量增加,根细胞膜磷脂成分也增加,根细胞膜的透性随之下降,因而宿主植物向根外分泌的AM真菌赖以生存的光合产物数量降低,导致其侵染下降[28]。P500处理下,由于玉米植株磷浓度大幅度升高,丛枝菌根侵染明显下降,间接证明了这一点。
本试验设置的+H处理只允许菌丝进入,-H处理根系和菌丝都不能进入。P0和P50供磷水平下,-H处理的土壤有效磷含量没有变化,且菌丝密度很低,表明0.45 μm尼龙膜有效阻止了菌丝进入,而+H处理的土壤有效磷含量和菌丝密度都有明显变化,表明有菌丝进入其中。据此推测+H处理相比-H处理降低的土壤有效磷含量应主要是由根外菌丝进入+H处理的管中吸收了部分磷引起的。结果表明,在P0处理不施磷条件下,-H和+H处理的有效磷含量明显高于土体土时,菌丝进入+H处理管中的量最大,吸收的磷也最多。P50处理下,随着土体土有效磷含量高于管内,虽然土体土菌丝密度与P0处理相当,但进入+H处理管内的菌丝明显减少,吸收带走的磷也减少。在P500处理下,土体土有效磷水平远远高于管内,土体土内的菌丝密度已大幅度下降,只有少量菌丝进入+H处理管内,对其中的有效磷含量影响极小。这些结果表明根外菌丝对局部磷养分的获取受环境磷养分的调控,在局部磷养分高于环境磷养分时会增加根外菌丝对局部磷的吸收。这与根系对局部养分的响应一致[14]。
4 结论
适当地供磷可以促进玉米根系生长和AM真菌的侵染。根外菌丝对局部磷养分的获取受环境磷养分的调控,当环境磷养分含量较低而局部磷养分含量较高时,较多的菌丝会进入局部区域获取磷。
参 考 文 献:
[1]Hinsinger P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: a review[J]. Plant and Soil, 2001, 237(2): 173-195.
[2]鲁如坤. 土壤磷素水平和水体环境保护[J]. 磷肥与复肥, 2003,18(1): 4-6.Ru R K. The phosphorus level of soil and environmental protection of water body[J]. Phosphate & Compound Fertilizer, 2003, 18(1): 4-6.
[3]彭畅, 朱平, 牛红红, 等. 农田氮磷流失与农业非点源污染及其防治[J]. 土壤通报, 2010, 41(2): 508-512.Peng C, Zhu P, Niu H H, et al. Nitrogen and phosphorus loss of farmland agriculture non-point source pollution and its prevention[J].Chinese Journal of Soil Science, 2010, 41(2): 508-512.
[4]Richardson A E, Lynch J P, Ryan P R, et al. Plant and microbial strategies to improve the phosphorus efficiency of agriculture[J].Plant and soil, 2011, 349(1-2): 121-156.
[5]Smith S E, Read D J. Mycorrhizal symbiosis (Third edition) [M].New York: Academic Press, 2008.
[6]冯固, 张福锁, 李晓林, 等. 丛枝菌根真菌在农业生产中的作用与调控[J]. 土壤学报, 2010, 47(5): 995-1004.Feng G, Zhang F S, Li X L, et al. Functions of arbuscular mycorrhizal fungi in agriculture and their manipulation[J]. Acta Pedologica Sinica, 2010, 47(5): 995-1004.
[7]Smith S E, Smith F A. Roles of Arbuscular mycorrhizas in plant nutrition and growth: new paradigms from cellular to ecosystem scales[J]. Annual Review of Plant Biology, 2011, 62(1): 227-250.
[8]Bolan N S. A critical review on the role of mycorrhizal fungi in the uptake of phosphorus by plants[J]. Plant and Soil, 1991, 134(2):189-207.
[9]Jansa J, Mozafar A, Frossard E. Long-distance transport of P and Zn through the hyphae of an arbuscular mycorrhizal fungus in symbiosis with maize[J]. Agronomie, 2003, 23: 481-488.
[10]Smith S E, Manjarrez M, Stonor R, et al. Indigenous arbuscular mycorrhizal (AM) fungi contribute to wheat phosphate uptake in a semi-arid field environment, shown by tracking with radioactive phosphorus[J]. Applied Soil Ecology, 2015, 96: 68-74.
[11]Grigera M S, Drijber R A, Wienhold B J. Increased abundance of arbuscular mycorrhizal fungi in soil coincides with the reproductive stages of maize[J]. Soil Biology & Biochemistry, 2007, 39:1401-1409.
[12]Duan T Y, Facelli E, Smith S E, et al. Differential effects of soil disturbance and plant residue retention on function of arbuscular mycorrhizal (AM) symbiosis are not reflected in colonization of roots or hyphal development in soil[J]. Soil Biology & Biochemistry, 2011,43: 571-578.
[13]Felderer I, Jansa J, Schulin R. Interaction between root growth allocation and mycorrhizal fungi in soil with patchy P distribution[J].Plant and Soil, 2013, 373: 569-582.
[14]Cain M L, Subler S, Evans J P, et al. Sampling spatial and temporal variation in soil nitrogen availability[J]. Oecologia, 1999, 118:397-404.
[15]Farley R A, Fitter A H. Temporal and spatial variation in soil resources in a deciduous woodland[J]. Journal of Ecology, 1999, 87:688-696.
[16]Lynch J P, Brown K M. Topsoil foraging-an architectural adaptation of plants to low phosphorus availability[J]. Plant and Soil, 2001,237(2): 225-237.
[17]Yano K, Kume T. Root morphological plasticity for heterogeneous phosphorus supply in Zea mays L[J]. Plant Production Science, 2005,8(4): 427-432.
[18]Einsmann J C, Jones R H, Mou P, et al. Nutrient foraging traits in 10 co-occuring plant species of contrasting life forms[J]. Journal of Ecology, 1999, 87: 609-619.
[19]王昕, 唐宏亮, 申建波, 等. 玉米根系对土壤氮、磷空间异质性分布的响应[J]. 植物营养与肥料学报, 2013, 19(5): 1058-1064.Wang X, Tang H L, Shen J B, et al. Root responses of maize to spatial heterogenous nitrogen and phosphorus[J]. Journal of Plant Nutrition and Fertilizer, 2013, 19(5): 1058-1064.
[20]Jackson R B, Caldwell M M. Integrating resource heterogeneity and plant plasticity: Modelling nitrate and phosphate uptake in a patchy soil environment[J]. Journal of Ecology, 1996, 84(6): 891-903.
[21]Wang G Z, Xia L, Christie P. Response of arbuscular mycorrhizal fungi to soil phosphorus patches depends on context[J]. Crop and Pasture Science, 2016, 67: 1116-1125.
[22]Deng Y, Chen K, Teng W, et al. Is the inherent potential of maize roots efficient for soil phosphorus acquisition?[J]. PLoS ONE, 2014,9(3): e90287.
[23]冯海艳, 冯固, 王敬国, 李晓林. 植物磷营养状况对丛枝菌根真菌生长及代谢活性的调控[J]. 菌物系统, 2003, 22(4): 589-598.Feng H Y, Feng G, Wang J G, Li X L. Effects of plant phosphorus nutrition on the growth and metabolic activity of arbuscular mycorrhizal fungi[J]. Mycosystema, 2003, 22(4): 589-598.
[24]鲍士旦. 土壤农化分析(第3版) [M]. 北京: 中国农业出版社, 2000.Bao S D. Soil and agricultural chemistry analysis (Third edition) [M].Beijing: China Agriculture Press, 2000.
[25]Abbott L K, Robson A D, Boer G. The effects of phosphorus on the formation of hyphae in soil by the vesicular-arbuscular mycorrhizal fungus, Glomus fasiculatum[J]. New Phytologist, 1984, 97(3):437-446.
[26]Lynch J P. Root phenes for enhanced soil exploration and phosphorus acquisition: tools for future crops[J]. Plant Physiology, 2011, 156(3):1041-1049.
[27]李晓林. 施磷水平与VA菌根效应的关系[J]. 中国农业大学学报,1990, 5(2): 177-180.Li X L. Relationship between phosphorus level and VA mycorrhiza effect[J]. Journal of China Agricultural University, 1990, 5(2):177-180.
[28]Menge J A, Steirle D, Bagyaraj D J, et al. Phosphorus concentrations in plants responsible for inhibition of mycorrhizal infection[J]. New Phytologist, 1978, 80(3): 575-578.

