高分级动脉瘤性SAH患者术后1年内预后不良因素研究
黄怀忠,邹胜,刘俊
(1.重庆市黔江中心医院 神经外科,重庆 409000;2.陆军军医大学新桥医院神经外科,重庆 400037)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是各种病因引起脑与脊髓表面或脑底部血管破裂、血液直接流入蛛网膜下腔引起的急性临床综合征,约占所有急性脑卒中的1/10。其中,>50%的患者发生SAH是由颅内动脉瘤破裂引起,其病情较为危急,致死率和致残率高,主要原因是高分级动脉瘤性SAH患者的预后较差[1]。早期进行手术治疗可改善此类患者的预后,包括开颅动脉瘤夹闭术和经血管内动脉瘤栓塞术。探讨高分级动脉瘤性SAH患者术后转归的影响因素并进行早期干预对改善患者的生存状况有意义,但以往的因素研究结果不一[2-3],且多为单因素研究。本研究回顾性分析本院行早期手术治疗的高分级动脉瘤性SAH患者的临床资料和随访结果,通过多因素分析探讨患者术后1年内预后不良的影响因素,为临床提供参考依据。
1 资料与方法
1.1 研究资料
选取2011年1月-2015年12月本院和新桥医院行早期手术治疗的168例高分级动脉瘤性SAH患者作为研究对象。纳入标准:①根据临床表现、头颅CT血管造影、数字减影血管造影及MRI血管造影等影像学检查,蛛网膜下腔穿刺或手术确诊为动脉瘤性SAH,且术前世界神经外科联盟(world federation of neurosurgical society,WFNS)分级为Ⅳ或Ⅴ级;②出血后72 h内行开颅动脉瘤夹闭术或经血管内动脉瘤栓塞术;③年龄18~75岁;④临床资料完整可靠,随访至术后>1年。排除标准:①伴有与该动脉瘤无关的颅内血肿;②影像学检查发现的颅内动脉瘤不是导致SAH的责任动脉瘤;③术前WFNS分级≤Ⅲ级,术后转为Ⅳ或Ⅴ级;④孕妇或哺乳期妇女;⑤合并严重的心、肝、肾等脏器功能不全或恶性肿瘤,预计生存期<1年。本研究通过医院伦理委员会批准,所有患者或其家属均签署知情同意书。
1.2 方法
1.2.1 资料收集收集所有患者的临床资料,包括性别、年龄、吸烟史、饮酒史、有无高血压史、糖尿病史、高脂血症及颅内动脉瘤家族史等基线资料;动脉瘤的最大径、位置、数目、有无脑实质出血、脑室出血铸型、脑疝及WFNS分级等术前资料;手术方式、手术距离出血时间、术后有无脑血管痉挛(cerebralvasospasm,CVS)、再出血、切口感染及肺炎等并发症。
1.2.2 随访和预后分析对所有患者术后进行定期随访,根据术后1年格拉斯哥预后量表(glasgow outcome scale,GOS)评分来判断预后,该量表分为1~5分:5分为基本恢复到发病前的正常生活,尽管可能有轻度缺陷;4分为轻度残疾,但可独立生活,能在保护下工作;3分为清醒、重度残疾,日常生活需要照料;2分为植物生存,仅有最小反应(如随着睡眠/清醒周期,眼睛能睁开);1分为死亡。术后1年GOS评分为1~3分,即视为预后不良;评分为4~5分,即视为预后良好。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料若符合正态分布以均数±标准差(±s)表示,计数资料采用χ2检验;两组比较行t检验,采用多因素Logistic回归分析影响患者预后不良的独立因素。P<0.05为差异有统计学意义。
2 结果
2.1 不同基线资料预后不良率比较
根据随访结果的GOS评分,168例患者术后1年的随访结果为预后良好73例(43.5%),预后不良95例(56.5%),包括死亡66例(39.3%)。结果表明,合并高血压史、糖尿病史的患者术后1年预后不良发生率高于未合并患者,差异有统计学意义(P<0.05)。其他基线资料与预后不良无关系。见表1。
2.2 不同术前资料预后不良率比较
结果表明,前循环、多发动脉瘤、有脑实质出血、脑室出血铸型、脑疝及WFNS分级为Ⅴ级患者术后1年预后不良发生率升高,差异有统计学意义(P<0.05)。见表2。

表1 不同基线资料预后不良率比较
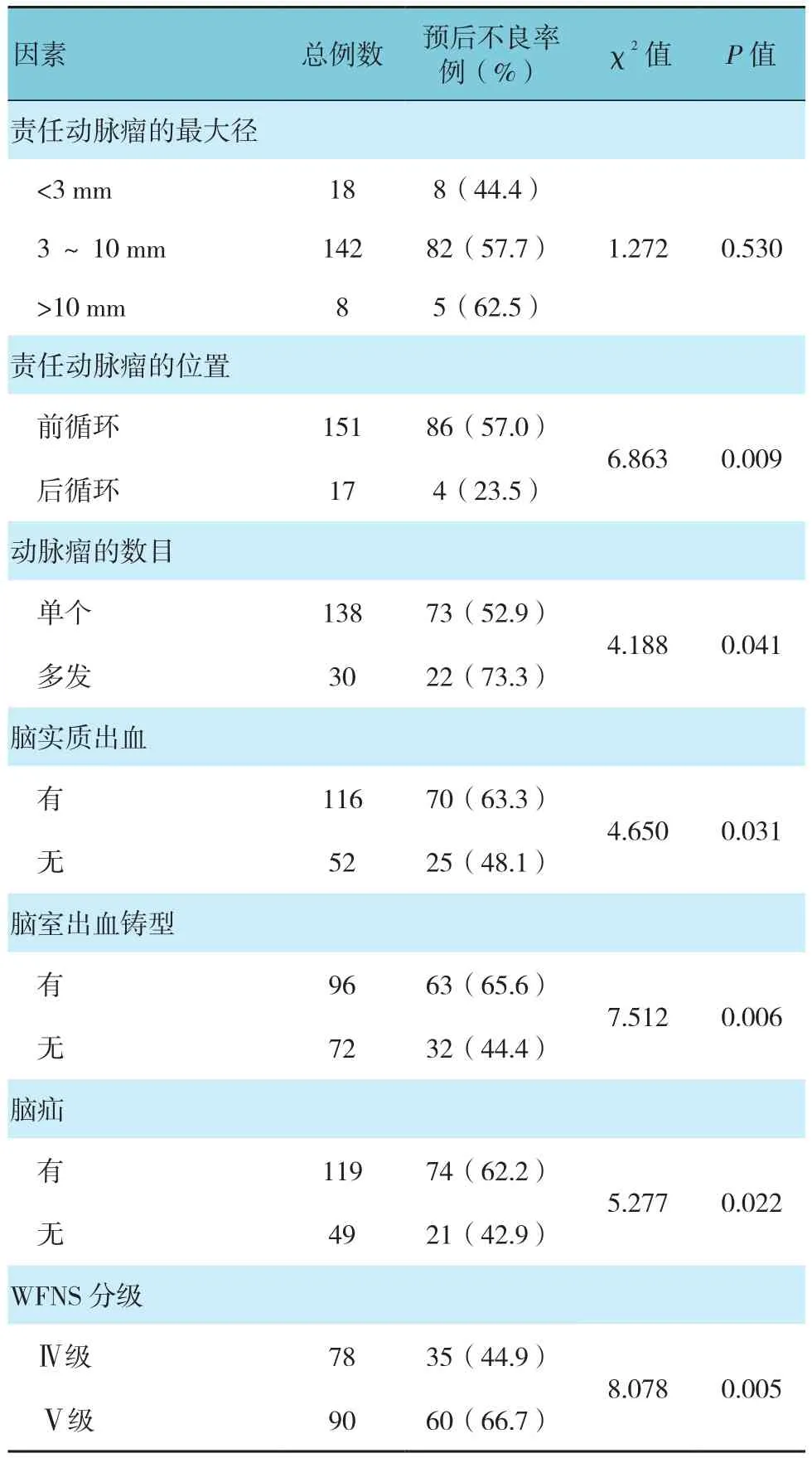
表2 不同术前资料的预后不良率比较
2.3 不同手术资料预后不良率比较
结果表明,术后CVS、再出血患者术后1年预后不良发生率高于未合并患者,差异有统计学意义(P<0.05)。见表3。
2.4 多因素Logistic回归分析结果
以是否发生预后不良为因变量,以表1~3中各个临床特征为自变量进行多因素Logistics回归分析。结果表明,高血压史、责任动脉瘤的位置为前循环、脑室出血铸型及术后CVS是患者术后1年预后不良的独立危险因素(P<0.05),其最后模型的决定系数值为0.89。见表4。

表3 不同手术资料预后不良率比较
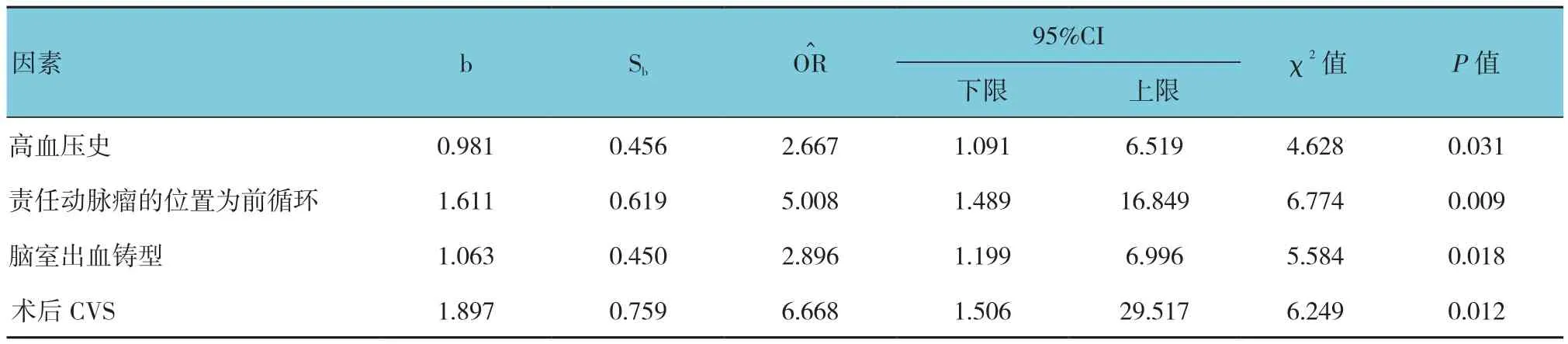
表4 多因素Logistic回归分析结果
3 讨论
随着脑外科手术技术与影像学检查的进展,有学者认为,临床上应对高分级动脉瘤患者的治疗充满信心,积极抢救患者[4]。目前,临床上多认为早期(出血72 h内)行手术治疗能改善患者预后,其恢复情况常超出预想,但对手术时机仍有一定争议。以往临床上对高分级动脉瘤性SAH不应直接行超早期(出血24 h内)手术治疗,因此时患者生命体征不稳,多合并脑水肿、颅内高压,手术带来的2次创伤不利其预后,故多在重症监护室保守治疗一段时候后再行手术治疗。但也有研究表明,动脉瘤破裂出血后24 h内绝大部分患者可再次出现破裂出血,发生率高达87%[5],且高分级动脉瘤再破裂风险高于低分级者,若等到2次破裂出血后再行手术治疗则转归更差。本研究未发现超早期和早期治疗的患者术后预后不良发生率之间有差异,笔者认为尽早进行手术治疗只是1个更积极的态度,尽量避免2次破裂出血带来的不良结局。此外,本研究也未发现手术方式对患者的预后有影响,关于栓塞术和夹闭术的疗效比较仍有争议,国际蛛网膜下腔出血动脉瘤试验结果表明,术后1年栓塞术的无残疾生存率要高于夹闭术,但在随访5年时差异已不存在[6],然而该研究中仅有10%的患者为高分级动脉瘤。国内丁璇等[7]认为,对Ⅳ级患者而言,栓塞术和夹闭术均可选择,Ⅴ级患者则首选栓塞术,但如果高分级动脉瘤患者合并较大的颅内血肿时应首选夹闭术。
高血压、吸烟及雌激素被认为是导致颅内动脉瘤发生的3个主要影响因素。其中,高血压与颅内动脉瘤的发生相关性最高[8]。高血压能通过血流动力学的压力升高来增加颅内动脉分叉处的血管壁剪切力,血管壁张力的升高也促进动脉瘤的发生、发展,且高血压能通过促进炎症反应、影响血管活性物质平衡紊乱等导致颅内血管壁的结构和功能障碍,从而促进颅内动脉瘤的发生及破裂[8-9]。许真等[10]的多元Logistics回归分析表明,高血压、年龄、吸烟史与女性绝经史是诱发颅内动脉瘤破裂的危险因素。本研究表明,合并高血压史的高分级动脉瘤性SHA患者术后1年发生预后不良风险是未合并患者的2.667倍,可能是由于高血压可降低颅内血管的自动调节能力,从而增加SAH发生后动脉狭窄或痉挛的风险,导致脑部灌注不足,且除中枢神经系统,高血压能损害心、肺、肝或肾等其他重要脏器功能,故合并高血压患者的转归更差。此外,不少有长期高血压病史的患者颅内血管壁附着有粥样斑块,其在进行开颅动脉瘤夹闭术中容易出现斑块脱落,然后发生脑栓塞,导致预后不良。王帅等[11]认为,重症前循环动脉瘤破裂患者应进行积极的探查手术治疗,以改善其预后,科学正确的手术策略与精巧细致的分离暴露方法对手术疗效显得尤为重要。
早前研究表明,脑室出血量是影响动脉瘤破裂患者预后的重要因素[12]。本研究同样发现,合并脑室出血铸型的高分级动脉瘤性SAH患者发生预后不良的风险是未合并者的2.90倍,脑室出血铸型是动脉瘤破裂的常见并发症,发生率近3成,该患者的预后较差[13],主要与脑室出血后形成的血凝块有关,血凝块不仅能压迫脑干或丘脑,导致其功能障碍,还能阻碍脑脊液的流动,促进脑积水的形成,且血凝块中的血红蛋白释放出血红素、铁离子、炎症因子可诱导自由基的产生,也促进脑水肿的形成。对于合并脑室出血铸型的颅内动脉瘤破裂患者,以往临床上多主张保守治疗,近年来越来越多的学者提倡进行早期手术治疗。在手术方式上,王鹏等人[14]推荐早期行介入栓塞术+脑室引流术,其有助于脑室内血块引流,之后再进行亚低温等综合治疗,其预后较好。CVS是SAH术后常见并发症,总发生率约为30%~70%,其多发生在术后3~5 d,可导致颅内动脉的远端出现脑灌注不足,类似于缺血性脑病,严重者可继发脑梗死,甚至引起死亡。据报道,SAH术后死亡的患者中,接近50%的死因是CVS。通常情况下,SAH患者术后常规给予尼莫地平等药物进行CVS预防,视情况给予液体复苏与维持脑灌注,但应注意患者的心脏和肾脏功能能否承受,临床上应注意观察患者的临床症状体征变化,若术后出现新的脑功能损害症状体征,且难以用脑水肿或脑出血解释,或者出现难以解释的血压升高,则考虑是否发生CVS,必要时首选经颅多普勒超声这个无创检查进行排查,其对CVS的灵敏性和特异性均较高,若仍然无法确定则考虑采用颅内血管造影、磁共振血管成像及CT血管造影等检查来评价脑灌注情况,但视病情谨慎采用[15]。
综上所述,>50%的高分级动脉瘤性SAH患者术后出现预后不良,高血压史、责任动脉瘤的位置为前循环、脑室出血铸型、术后CVS是患者术后1年预后不良的独立危险因素。
[1] STEINER T, JUVELA S, UNTERBERG A, et al. European stroke organization guidelines for the management of intracranialaneurysms and subarachnoid haemorrhage[J].Cerebrovasc Dis, 2013, 35(2): 93-112.
[2] PEGOLI M, MANDREKAR J, RABINSTEIN A A, et al. Predictors of excellent functional outcome in aneurysmal subarachnoid hemorrhage[J]. J Neurosurg, 2015, 122(2): 414-418.
[3] SCHUSS P, HADJIATHANASIOU A, BORGER V, et al. Poorgrade aneurysmal subarachnoid hemorrhage: factors influencing functional outcome-a single center series[J]. WorId Neurosurg,2016, 85: 125-129.
[4] KOMOTAR R J, SCHMIDT J M, STARKE R M, et al.Resuscitation and critical care of poor-grade subarachnoid hemorrhage[J]. Neurosurgery, 2009, 64(3): 397-410.
[5] PHILLIPS T J, DOWLING R J, YAN B, et al. Does treatment of ruptured intracranialaneurysms within 24 hours improve clinical outcome[J]. Stroke, 2011, 42(7): 1936-1945.
[6] BAKKER N A, METZEMAEKERS J D, GROEN R J, et al.International subarachnoid aneurysm trial 2009: endovascular coiling of rupturedintracranial aneurysms has no significant advantage over neurosurgical clipping[J]. Neurosurgery, 2010,66(5): 961-962.
[7] 丁璇, 王志刚, 王成伟, 等. 不同治疗方式对高分级动脉瘤性蛛网膜下腔出血患者预后的影响[J]. 中华医学杂志, 2012, 92(43):3054-3057.
[8] INAGAWA T. Risk factors for the formation and rupture of intracranial saccularaneurysms in shimane, japan[J]. World Neurosurg, 2010, 73(3): 155-164.
[9] GREVING J P, WERMER M J, BROWN RD J R, et al.Development of the PHASES score for prediction of risk of rupture of intracranial aneurysms: a pooled analysis of six prospective cohort studies[J]. Laneet Neurol, 2014, 13(1): 59-66.
[10] 许真, 王志刚, 丁璇, 等. 诱发颅内动脉瘤破裂的危险因素分析[J]. 中华老年心脑血管病杂志, 2010, 12(7): 627-629.
[11] 王帅, 卢圣奎, 宋剑, 等. 重症前循环动脉瘤破裂患者115例疗效分析[J]. 中国现代医学杂志, 2014, 24(28): 76-81.
[12] FLINT A C, ROEBKEN A, SINGH V. Primary intraventricular hemorrhage: yield of diagnostic angiography and clinical outcome[J]. Neurocrit Care, 2008, 8(3): 330-336.
[13] KRAMER A H, HEHIR M, NATHAN B, et al. A comparison of 3 radiographic scales for the prediction of delayed ischemia andprognosis following subarachnoid hemorrhage[J]. J Neurosurg,2008, 109(2): 199-207.
[14] 王鹏, 薛德友, 张赛, 等. 颅内动脉瘤破裂伴脑室出血铸型的治疗[J]. 新乡医学院学报, 2012, 29(11): 853-855.
[15] 呼铁民, 韩凤伟, 王维兴, 等. 颅内动脉瘤破裂致蛛网膜下腔出血预后不良的危险因素研究[J]. 中国全科医学, 2011, 14(2):151-155.

