早期胃癌检出情况及其内镜下特征分析(附43例报道)*
蔡升,周建波,桑建忠,宋奇峰,杨倩倩,黄戬,周琴
[宁波大学医学院附属阳明医院(浙江省余姚市人民医院) 消化内科,浙江 余姚 315400]
胃癌是起源于胃黏膜上皮的恶性肿瘤,是我国常见的恶性肿瘤之一,其年发病率约36/10万,年病死率约26/10万,位列恶性肿瘤病死率的第3位[1]。早期胃癌(early gastric cancer,EGC)术后5年生存率高于90.00%[2-3],而进展期胃癌的5年生存率仅为30.00%[4]。胃镜检查是诊断EGC最准确的方法,提高胃镜下EGC的检出率对降低我国胃癌病死率具有重要意义。目前,日本及韩国胃镜下EGC的检出率均高于50.00%[5],而我国尚不足10.00%,大部分胃癌患者确诊时已至中晚期[6],可见EGC在胃镜检查中存在大量的漏诊,尤其是对于条件有限的基层医院,然而在我国就诊于基层医院的患者占相当一大部分,对于基层医院的内镜医师而言,充分认识EGC在胃镜下的表现,对减少漏诊意义重大。本研究通过对本院2016年确诊的EGC病例数进行统计,调查分析浙江省余姚地区的EGC检出率,并对其内镜下的表现进行回顾性分析。现报道如下:
1 资料与方法
1.1 一般资料
收集2016年1月-2016年12月在本院消化内镜中心行胃镜检查患者的病例资料,根据内镜下切除或外科手术切除后的病理结果,筛选出EGC和进展期胃癌病例数,得出EGC病例共43例。其中,男31例,女12例,年龄43~78岁,平均(63.4±13.6)岁,43例EGC患者中,1例存在3处病灶,2例存在2处病灶。进展期胃癌病例131例,其中男99例,女32例,年龄45~79,平均(64.3±13.0)岁。
1.2 方法
1.2.1 诊断标准EGC为癌组织仅局限于胃黏膜层或黏膜下层,不论有无淋巴结转移;进展期胃癌为癌组织浸润至固有肌层或超过固有肌层。
1.2.2 内镜下特征分析依据巴黎分类标准[7],将EGC的内镜下形态分为0-Ⅰ型(0-Ⅰp、0-Ⅰs),0-Ⅱ型(0-Ⅱa、0-Ⅱb、0-Ⅱc),0-Ⅲ型。将病灶按大小分为微小胃癌(最大径≤0.5 cm),小胃癌(0.5 cm<最大径≤1.0 cm),以及其他EGC(最大径>1.0 cm)。统计分析EGC的发生部位,以及普通白光内镜下EGC病灶的色调改变、是否边界清晰、边缘是否规则(如呈毛刺状)、病灶表面是否规则(包括形态和颜色)、周边黏膜有无肠上皮化生和(或)萎缩、是否可以观察到自发性出血、表面有无溃疡及表面有无白色不透明物质(white opaque substance,WOS)等特征。并分析窄带成像(narrow band imaging,NBI)放大内镜在EGC诊断中的价值,包括病灶边界是否清晰,黏膜下微血管不规则或消失情况,上皮微细结构和腺管开口不规则或消失情况[8-9]。
1.3 病理分型
依据病理结果,将EGC按NAKAMURA分类分为分化型(中-高分化的管状腺癌、乳头状腺癌)和未分化型(低分化腺癌、黏液腺癌、印戒细胞癌)[10]。
2 结果
2.1 内镜下胃癌发现情况
本院消化内镜中心2016年1月-2016年12月总共行胃镜检查数18 534例次,发现并经病理确诊的EGC 43例(47处病灶)、进展期胃癌131例(131处病灶),2016年胃癌的总体检出率为0.94%(174/18 534),EGC的总体检出率0.23%(43/18 534),EGC检出例数占胃癌总检出例数的24.71%(43/174)。
2.2 EGC普通白光内镜下特征
2.2.1 病灶分布部位EGC发生在胃窦部的比例最高(17/47,36.17%),其余依次为胃底贲门部(11/47,23.40%)、胃角部(10/47,21.28%)及胃体部(9/47,19.15%)。
2.2.2 病灶大小病灶>1.0 cm的EGC最常见,比例占(32/47,68.09%),微小胃癌比例最低(4/47,8.51%),而小胃癌占(11/47,23.40%)。
2.2.3 内镜下形态EGC中以0-Ⅱ型比较常见,共40处病灶,其中又以0-Ⅱc型最常见,占(26/47,55.32%),0-Ⅱa型及0-Ⅱb型比例分别占(10/47,21.28%)及(4/47,8.51%),0-Ⅰp型为(1/47,2.13%)、0-Ⅰs型为(5/47,10.64%)及0-Ⅲ型为(1/47,2.13%)。
2.2.4 白光下具体特征EGC白光内镜下表面颜色发红最常见,比例占(35/47,74.47%),其余表现为发白(8/47,17.02%)及红白相间(4/47,8.51%);47处病灶边界清晰者为43处,比例为91.49%,另有4处病灶无法分清边界;42处病灶表面不规则(89.36%);39处病灶(82.98%)有黏膜萎缩和(或)肠上皮化生,8处无明显黏膜变化;17处病灶(36.17%)边缘呈毛刺状改变;8处病灶(17.02%)表面可见WOS;13处病灶(27.66%)伴发表面溃疡;另可见21处病灶(44.68%)有自发性出血。
2.3 NBI放大内镜下特征及病理学特征
30处病灶行NBI放大内镜检查,其中26处(86.67%)内镜下病灶边界清晰,29处(96.67%)可见黏膜下微血管不规则或消失,27处(90.00%)上皮微细结构和腺管开口不规则或消失。47处EGC病灶中,分化型42处(89.36%),未分化型5处(10.64%)。见图1~4。
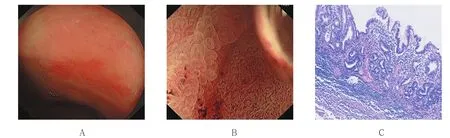
图1 胃窦小弯侧0-Ⅱc型EGCFig.1 0-Ⅱc early gastric cancer in the lesser curvature of the antrum
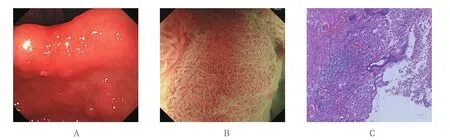
图2 胃角中部0-Ⅱc型EGCFig.2 0-Ⅱc early gastric cancer in the middle of gastric angle
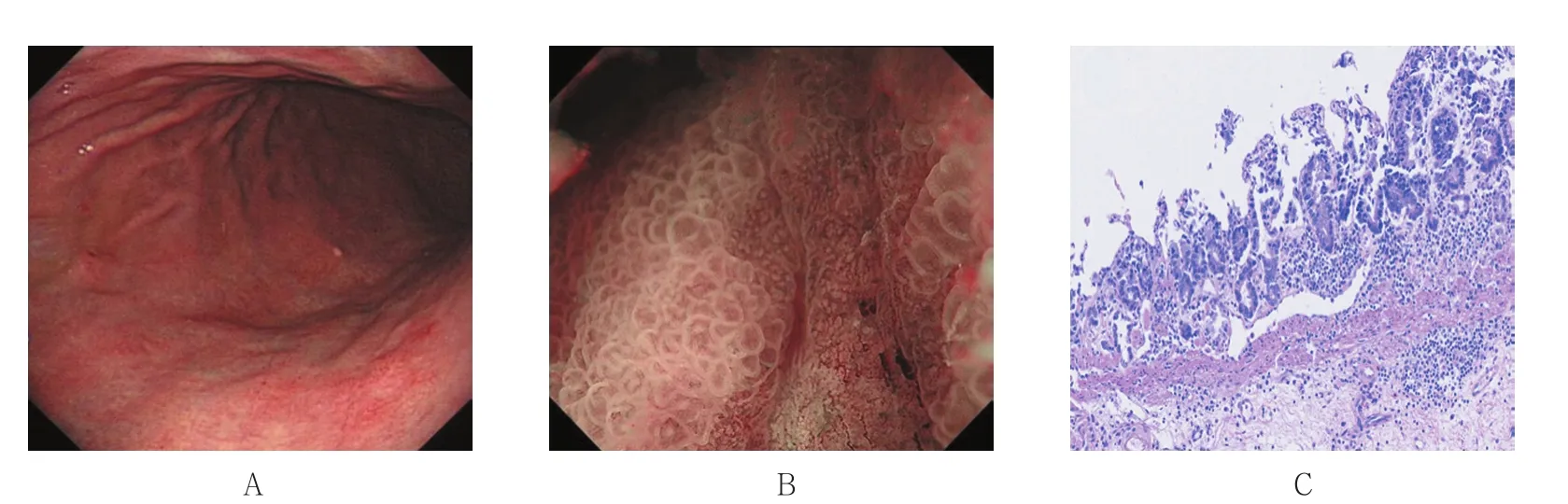
图3 胃体上部后壁0-Ⅱc型EGCFig.3 0-Ⅱc type of early gastric cancer in the upper rear wall of stomach

图4 胃底贲门部0-Ⅱb型EGCFig.4 Gastric cardia department 0-Ⅱb type of early gastric cancer
3 讨论
胃癌是临床上常见的恶性肿瘤之一,其病理分型、浸润情况、淋巴结转移程度直接关系到患者的预后[11]。因此,胃癌的早期诊断对于提高患者的生存率至关重要。胃镜检查是诊断EGC最准确的方法,提高胃镜下EGC的检出率对降低我国胃癌病死率具有重要意义[12]。近年来随着超声内镜、荧光光谱内镜、放大内镜及NBI等新的设备和技术的应用,使EGC及癌前病变的检出率有了明显提高[13]。但是,目前我国EGC的检出水平和日本韩国等仍存在较大差距。本院作为浙江省余姚地区规模最大的医疗机构,每年完成了大量的胃镜检查,并自2015年引进全新进口Olympus 260及290电子胃镜系统,为提高EGC的检出率提供了有力的保障。
笔者回顾性收集了2016年度行胃镜检查患者的临床资料,全年共完成18 534例次胃镜检查,发现EGC 43例、进展期胃癌131例,结果显示本年度胃癌的总体检出率0.94%,EGC的总体检出率0.23%,初步得出浙江省余姚地区的EGC检出率在24.71%左右,这比前期国内多个大型医院调查研究得出的数据要高[6],这首先与内镜医生对EGC的重视及认识增加有关,另外也与内镜技术和设备的不断改进有关。
笔者在分析EGC的分布部位时,发现其发生部位主要以胃窦部为主,比例达到36.17%,发生于胃体部相对少些(19.15%)。本研究也发现其病灶大小以>1.0 cm最常见(68.09%),微小胃癌及小胃癌较少,这可能与EGC本身的发病因素有关,但也不排除内镜医师的技术水平及条件设备因素。在统计分析EGC形态特征中,0-Ⅱ型最多(55.32%),0-Ⅰp型(2.13%)及0-Ⅲ型(2.13%)最少,这与TAKIZAWA等[14]报道的形态学分布基本一致。YAO[15]报道,在普通白光内镜下,见到具有清晰的边界及不规则的颜色或表面结构是诊断EGC的重要指征。笔者也发现清晰的边界(91.49%)和表面不规则(89.36%)是EGC最常见的特征,这再一次提示这两点是诊断EGC最重要的依据。萎缩性胃炎伴肠化是胃癌的重要癌前疾病,笔者发现82.98%的EGC患者癌灶周围黏膜具有萎缩和(或)肠化的表现,所以在胃镜检查时遇到萎缩性胃炎伴肠化的患者应提高警惕并加强随访。异常的血管生成是肿瘤的常见特征[16],富含血管的区域易造成肿瘤病变发红,而未分化型癌或浸润较深的癌可表现为色调发白[17]。本研究74.47%的EGC病灶表现为色调发红,17.02%表现为色调发白,其余表现为红白相间的比例占8.51%,提示色调的变化可为发现和诊断EGC提供依据。新生的肿瘤血管由于血管壁不完整,常出现自发性出血,笔者发现EGC的自发性出血比例为44.68%。不规则浸润性的边界(边缘毛刺状)是肿瘤细胞浸润性生长的表现之一,本研究发现EGC出现边缘毛刺状的比例为36.17%。毛刺征、自发性出血等表现也为EGC的诊断提供了一定依据。HIROTA等[18]报道EGC中15.80%~64.50%并发溃疡,不同文献差异较大,本研究中27.66%的EGC并发溃疡。然而EGC合并溃疡时,往往提示其发生深层浸润的风险较大[12]。NBI放大内镜可以清晰地观察病变微血管、微细结构和腺管开口的变化,还可以通过表面形态来判定肿瘤的边界[9]。据报道,NBI放大内镜对EGC的诊断准确率、敏感度及特异度分别为98.10%、85.70%及99.40%[19]。本研究中,共有30处EGC病灶行NBI放大内镜检查,其中26处(86.67%)内镜下病灶边界清晰,29处(96.67%)可见黏膜下微血管不规则或消失,27处(90.00%)上皮微细结构和腺管开口不规则或消失,这些改变与EGC的NBI放大内镜下检查结果相近[9,20]。此外,本研究中绝大部分EGC为分化型癌(89.36%),这与GOTODA等[21]报道一致。
综上所述,笔者回顾性分析了2016年度本院内镜中心行胃镜检查患者的病例资料,初步得出浙江省余姚地区的EGC检出率,通过本研究的结果提示该地区的胃癌发病率处在比较高的水平。笔者再通过对43例EGC患者的病灶回顾性分析发现,EGC常见于胃窦部,形态以0-Ⅱc型为主,在白光内镜下注意观察胃黏膜局部色调的改变及特征,以及NBI放大内镜下病灶边界、黏膜下微血管及上皮微细结构和腺管开口的变化,有助于提高EGC的诊断率。本研究也存在一些不足之处,其数据来源于单一中心且EGC的样本量相对较小,研究结果还需要今后多中心大样本的研究数据进一步证实。
[1]赫捷, 陈万青.2012中国肿瘤登记年报[M].北京: 军事医学科学出版社, 2012: 28-297.
[1]HE J, CHEN W Q.Chinese cancer registry annual report[M].Beijing: Military Medical Science Press, 2012: 28-297.Chinese
[2]ONO H, KONDO H, GOTODA T, et al.Endoscopic mucosal resection for treatment of early gastric cancer[J].Gut, 2001, 48(2):225-229.
[3]OLIVEI RA F J, FERRÃO H, FURTADO E, et al.Early gastric cancer: report of 58 cases[J].Gastric Cancer, 1998, 1(1): 51-56.
[4]SOROUSH A.Surgical outcome in patients with gastrointestinal malignancies; a report from a large referral hospital, 2008-2010[J].Middle East J Dig Dis, 2013, 5(4): 201-208.
[5]NOGUCHI Y, YOSHIKAWA T, TSUBURAYA A, et al.Is gastric carcinoma different between Japan and the United States[J].Cancer, 2000, 89(11): 2237-2246.
[6]上海市早期胃癌临床协作组.上海不同等级10个医疗机构早期胃癌的筛选结果比较[J].中华消化内镜杂志, 2007, 24(1):19-22.
[6]Shanghai Early Gastric Cancer Clinical Cooperation.Comparison on early-stage gastric cancer screening in different level of medical facilities in Shanghai[J].Chin J Dig Endosc, 2007, 24(1): 19-22.Chinese
[7]The Paris Endoscopic Classification of Superficial Neoplastic Lesions: esophagus, stomach, and colon: November 30 to December 1, 2002[J].Gastrointest Endosc, 2003, 58(6 Suppl):S3-S43.
[8]YAO K, ANAGNOSTOPOULOS G K, RAGUNATH K.Magnifying endoscopy for diagnosing and delineating early gastric cancer[J].Endoscopy, 2009, 41(5): 462-467.
[9]YAO K, TAKAKI Y, MASTUI T, et al.Clinical application of magnification endoscopy and narrow-band imaging in the upper gastrointestinal tract: new imaging techniques for detecting and characterizing gastrointestinal neoplasia[J].Gastrointest Endosc Clin N Am, 2008, 18(3): 415-433.
[10]NAKAMURA T, YAO T, KAKEJI Y, et al.Depressed type of intramucosal differentiated-type gastric cancer has high cell proliferation and reduced apoptosis compared with the elevated type[J].Gastric Cancer, 2013, 16(1): 94-99.
[11]吴晖, 姚宝国, 何裕隆, 等.不同时期胃癌浸润邻近器官情况及其外科治疗与预后分析[J].中华消化外科杂志, 2013, 12(7):490-495.
[11]WU H, YAO B G, HE Y L, et al.Surgical management and prognosis of gastric cancer with adjacent organ invasion in different phases[J].Chinese Journal of Digestive Surgery, 2013,12(7): 490-495.Chinese
[12]ANG T L, KHOR C J, GOTODA T.Diagnosis and endoscopic resection of early gastric cancer[J].Singapore Med J, 2010, 51(2):93-100.
[13]孙克文, 陈建平, 陈炳芳, 等.放大染色内镜联合微探头超声在内镜治疗早期胃癌及癌前病变术前诊断中的作用[J].中华消化内镜杂志, 2011, 28(12): 697-698.
[13]SUN K W, CHEN J P, CHEN B F, et al.The role of enlarged staining endoscopy combined with microprobe ultrasound in the treatment of early gastric cancer and preoperative diagnosis of precancerous lesions[J].Chinese Journal of Digestive Endoscopy,2011, 28(12): 697-698.Chinese
[14]TAKIZAWA T.Macro-and microscopic features of gastric cancers[J].Stomach & Intestine, 1991, 26(10): 1135-1148.
[15]YAO K.The endoscopic diagnosis of early gastric cancer[J].Ann Gastroenterol, 2013, 26(1): 11-22.
[16]HANAHAN D, WEINBERG R A.Hallmarks of cancer: the next generation[J].Cell, 2011, 144(5): 646-674.
[17]YAO K, NAGAHAMA T, MATSUI T, et al.Detection and characterization of early gastric cancer for curative endoscopic submucosal dissection[J].Dig Endosc, 2013, 25(Suppl 1): 44-54.
[18]HIROTA T, MING S C, HABASHI M.Pathology of early gastric cancer[J].Gastric Cancer, 1993: 66-87.
[19]YADA T, YOKOI C, UEMURA N.The current state of diagnosis and treatment for early gastric cancer[J].Diagn Ther Endosc,2013, 2013: 241320.
[20]LI H Y, DAI J, XUE H B, et al.Application of magnifying endoscopy with narrow band imaging in diagnosing gastric lesions: a prospective study[J].Gastrointest Endosc, 2012, 76(6):1124-1132.
[21]GOTODA T, YANAGISAWA A, SASAKO M, et al.Incidence of lymphnode metastasis from early gastric cancer: estimation with a large number of cases at two large centers[J].Gastric Cancer,2000, 3(4): 219-225.

