低温胁迫对紫萼玉簪根系3种生理指标的影响1)
庄倩倩 陈少鹏 刘洪章
(吉林农业大学,长春,130118)
紫萼玉簪(Hostaventricosa)又称紫花玉簪、紫玉簪、白背三七、玉棠花,为百合科玉簪属多年生宿根草本植物,是玉簪属植物中中国原产的4个种之一,在我国主要分布于东北、华东、西南、广西[1]等地,自然生长于林下、溪边。紫萼玉簪叶基生,叶片卵形至卵圆形,基部心形,总状花序,花紫色或淡紫色,花、果期8—9月份。其花、叶均有较高的观赏价值,且品种丰富,叶色较多,具有耐寒、阴生及宿根等特性,作为重要的观赏植物被广泛应用于园林地被、花境以及盆栽观赏,在世界各地广为栽培[2],此外,紫萼玉簪的根、叶、花均可入药,还具有一定的药用价值[3]。
紫萼玉簪抗寒性极强,是唯数不多的能够在东北地区自然越冬的玉簪属植物之一。目前,对玉簪的抗旱、抗涝、光合特性等生理研究较多[4-8],但对于其抗寒性相关的研究较少,玉簪冬季以地下根系越冬,故认为其根系的抗寒能力是全株中最强的部位,然而现有文献中对其根系的抗寒性研究更少,许怡玲等[10]对哈尔滨地区从北京、荷兰等地引种的11个玉簪品种进行了低温胁迫试验,并对其根系的可溶性糖质量分数、丙二醛质量摩尔浓度、可溶性蛋白质量分数等生理指标进行了测定,并依此将11个玉簪品种进行了抗寒性分类。高志慧[11]以哈尔滨地区引种的‘金标’玉簪、‘金冠’玉簪、‘山中脊’玉簪,白花玉簪和东北玉簪为试验材料,分析研究了冬季自然低温与人工模拟低温两个处理下玉簪根系膜透性等5项生理指标的变化规律,并结合低温胁迫后的生长恢复观测对5种玉簪的抗寒性进行综合评价。在现有可查阅的抗寒性研究文献中,多数仅进行了人工低温胁迫,而人工低温胁迫降温速度快、持续时间短,考察的是植物应对突然降温的能力和机制,无法探究自然入冬循序渐进的低温环境中的生理变化规律,而园林植物能否在东北地区自然越冬,其能够适应缓慢长期的低温环境是首要因素。本试验以抗寒能力较强的紫萼玉簪为试验材料,进行了人工低温胁迫以及自然降温下的3种生理指标变化规律比较,为摸清其抗寒机制及下一步对紫萼玉簪抗寒基因的挖掘和玉簪属植物抗寒新品种的培育提供理论基础。
1 材料与方法
1.1 人工低温胁迫处理
2015年4月下旬,将吉林农业大学图书馆西侧种植的紫萼玉簪小苗移栽入盆,置于温室内,遮阴缓苗栽培30 d后,将盆栽紫萼玉簪植株置于人工气候培养箱中进行人工低温胁迫处理。
设置降温速度为1 ℃·h-1,以室温(22 ℃)为降温起点,温度分别降至4 ℃和0 ℃时开始计时,分别在胁迫0、4、8、12、16、20、24、48 h时,采集植株根系,清洗干净泥土,测定SOD活性、MDA质量摩尔浓度及可溶性糖质量分数,并进行3次重复试验。
1.2 自然低温采样处理
从2015年9月中旬至11月末,随着长春地区由秋季转入冬季,气温及地温逐渐降低,每隔7 d采样1次,采样于当日07:00进行。每次采样对校园内同地点(图书馆西侧)种植的紫萼玉簪根系进行采集,同时测量距离地表约10cm深度处的地温,记录当天气温的最高值及最低值进行制表(表1)。将采集的紫萼玉簪根系泥土用清水冲洗干净,吸干表面的水分,用于测定SOD活性、MDA质量摩尔浓度及可溶性糖质量分数,进行3次重复试验。从9月15日至11月24日共计11次采样,每次采样依次用字母A~K进行编号,具体采样的气候条件见表1。
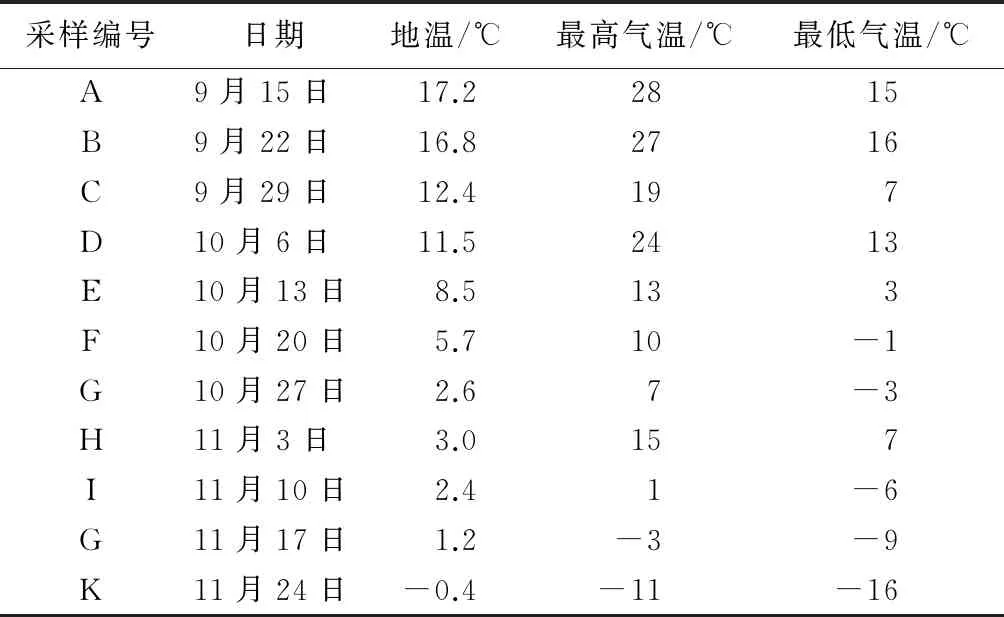
表1 紫萼玉簪自然降温试验采样气候条件
1.3 生理指标测定方法
SOD(超氧化物歧化酶)活性测定采用氮蓝四唑法;MDA(丙二醛)质量摩尔浓度测定采用硫代巴比妥酸法;可溶性糖质量分数测定采用苯酚法[12]。
2 结果与分析
2.1 低温条件对紫萼玉簪SOD活性的影响
紫萼玉簪人工低温胁迫中,随胁迫时间增加,SOD活性呈现先略有上升,后持续下降的变化趋势,且0 ℃低温下SOD活性变化幅度大于4 ℃的处理,但二者之间的差异仅在胁迫处理16h时达到差异极显著水平,4、20、48 h处理达到差异显著水平,其他处理时间差异不显著(表2);自然降温环境下,随地温的降低,SOD活性呈现降低的趋势,但当地温降至2~3 ℃时,SOD活性开始升高(表3)。

表2 人工低温处理对紫萼玉簪根系3种生理指标的影响
注:表中数据为平均值±标准差;数字后字母表示同指标同处理时间下4 ℃处理与0 ℃处理的差异显著性分析;同行不同大写字母表示差异极显著(P<0.01),同行不同小写字母表示差异显著(P<0.05)。
2.2 低温条件对紫萼玉簪MDA质量摩尔浓度的影响
紫萼玉簪人工低温胁迫下,随低温胁迫时间增加,MDA质量摩尔浓度均呈先下降后上升的趋势,但上升幅度不大,胁迫后期MDA质量摩尔浓度变化趋于平缓,0 ℃低温下MDA质量摩尔浓度变化幅度大于4 ℃的处理,但二者之间只有在12 h和16 h处理时达差异显著水平,其他处理时间的均未达到差异显著水平(表2)。自然降温过程中,MDA质量摩尔浓度随地温降低而升高,当地温降至2~3 ℃时,MDA质量摩尔浓度略有下降,并基本保持稳定(表3)。
2.3 低温条件对紫萼玉簪可溶性糖质量分数的影响
随人工低温胁迫时间的增加,可溶性糖质量分数均呈现上升趋势,至16 h后略有下降趋势;相同胁迫时间内,0 ℃的可溶性糖质量分数基本均高于4 ℃的处理(12 h的处理情况相反),但二者之间的差异未达显著水平(表2);自然降温过程中,随地温阶段性降低,可溶性糖质量分数也表现出阶段性上升趋势,当地温降至2~3 ℃时,可溶性糖质量分数略有下降,后期走势趋于平缓(表3)。

表3 自然低温对紫萼玉簪根系3种生理指标影响
注:表中数据为平均值±标准差。
3 结论与讨论
SOD是植物体内重要的保护酶[13],当植物受到低温胁迫时,体内SOD活性上升,能将有毒的自由基活性氧还原成水和氧分子,来维持细胞内活性氧代谢平衡,防止膜脂过氧化反应[14],从而对细胞的膜结构起保护作用。受到低温胁迫时,抗寒能力强的植物酶活性变化不大,而抗寒能力弱的植物表现明显的酶活性下降,酶活性下降后其细胞组织活力也随着明显降低,并最终导致膜结构受损伤。本试验人工低温胁迫中,SOD活性在低温胁迫初期明显增加,以清除由于低温产生的较多的自由基活性氧,继续遭受低温胁迫时,发现SOD活性不再升高反而开始下降,说明SOD活性已经无法平衡由于低温造成的越来越多的自由基活性氧,这与杨克彬等[15]对切花红掌进行低温胁迫研究结果相一致。自然降温过程中,随地温的逐渐降低,紫萼玉簪根系SOD活性呈现降低的趋势,但当地温降至2~3 ℃时,SOD活性值升高,并趋于稳定。
当植物受到低温胁迫时,细胞原生质体的流动减慢,膜与酶类结合活性降低,活性氧类物质积累造成细胞膜发生膜脂过氧化反应[16-17]。MDA是膜脂过氧化反应主要产物,抗寒性越强的植物,受低温时丙二醛质量摩尔浓度越低[18-19],故MDA质量摩尔浓度是反映膜质过氧化程度和膜系统受害程度的重要指标之一[20-21]。本试验中在人工低温胁迫初期,MDA质量摩尔浓度降低,说明此期间低温并未对植物质膜产生损伤[22],继续遭受低温时,MDA质量摩尔浓度逐渐升高,说明植物过氧化反应逐渐增强,表现出受低温伤害迹象,这与李文明等[23]对5种酢浆草属植物进行低温胁迫试验得到的结果相一致。在自然降温过程中,随地温的逐渐降低,紫萼玉簪根系MDA质量摩尔浓度升高,当地温降至2~3 ℃时,MDA质量摩尔浓度略有下降,并基本保持稳定。
可溶性糖属于渗透调节物质,在植物受到低温时,可溶性糖可以增加细胞的保水能力,调节细胞水势,降低细胞质结冰点,从而保护膜系统组分使细胞免受损伤[24-25]。本研究中紫萼玉簪可溶性糖质量分数随人工低温胁迫时间增加,表现出缓慢上升趋势,这可能是紫萼玉簪在低温胁迫下,对逆境产生了应激反应,细胞通过增强渗透调节物质浓度的途径来抵御低温引起的膜伤害。在自然降温试验中,可溶性糖质量分数也随地温降低而逐渐升高,当地温降至2~3 ℃时,可溶性糖质量分数达到最大值,上升不明显,走势开始趋于平缓,这与冉卓[26]在进行低温胁迫对紫花苜蓿生理生化特性研究得出的结果具有相似性。
通过对比紫萼玉簪人工低温胁迫和入冬时期自然降温过程中SOD活性、MDA质量摩尔浓度及可溶性糖质量分数的变化趋势,发现在两种不同的降温过程中,3种反映植物抗寒性状的指标变化趋势具有很多相似之处。但由于人工低温胁迫降温速度较快(1 ℃·h-1),低温持续时间较短(48 h),其主要体现的是紫萼玉簪在遭受突然降温时的机体抗寒反映;而自然降温速度较缓慢,持续时间较长(试验中采样持续时间约75d),其体现的是紫萼玉簪在自然状态下,从生长期转入休眠期的机体抗寒机制启动过程。试验中发现,在人工低温胁迫中0 ℃各项指标的变化幅度均大于4 ℃,说明降温程度越大,生理指标的变化幅度也越大,但本试验中二者之间差异未达显著水平。综合三项指标变化趋势发现,在地温自然降温到2~3 ℃时,三项指标变化趋势均趋于稳定,由此可知,紫萼玉簪的抗寒机制启动是多项生理活动、多个数量基因共同决定的,其启动过程也是一个复杂的有机协调过程,当抗寒机制启动后,各项指标基本趋于稳定;也由此推测,紫萼玉簪根系基本进入越冬休眠的温度为2~3 ℃。
紫萼玉簪根系的SOD活性随着低温胁迫时间的延长呈现先升高后降低的趋势,MDA质量摩尔浓度呈现先下降后上升的趋势,二者呈负相关关系,可溶性糖质量分数呈现逐渐升高的趋势,各项指标在0 ℃胁迫的变化幅度均大于4 ℃。自然降温中随地温降低,SOD活性呈现逐渐下降的趋势,MDA质量摩尔浓度呈现上升趋势,可溶性糖质量分数呈现上升趋势。地温自然降温到2~3 ℃时,三项指标变化趋势均趋于稳定,由此认为地温2~3 ℃是紫萼玉簪根系进入越冬休眠的临界温度。
[1] 盘波,丁涛,宁世江.广西元宝山自然保护区珍稀野生花卉资源[J].中国野生植物资源,2009,28(6):21-25.
[2] 张金政.栽培条件对玉簪属植物生长和光合作用的影响研究[D].长春:吉林农业大学,2013.
[3] 南京中医药大学.中药大辞典[M].上海:上海科学技术出版社,2006:187.
[4] 张起源.水分胁迫对2种玉簪生长及光合特性的影响[D].长春:吉林农业大学,2011.
[5] 李滨胜,周玉迁,潘杰,等.不同光照条件下8种地被植物生长状况分析[J].林业科技,2010,35(4):69-71.
[6] 王巍,董然,李晓东,等.控释氮肥对紫萼玉簪(Hostaventricosa)生长和光合特性的影响[J].植物研究,2009,29(5):544-548.
[7] 张军民,刘兰英,李春玲.8种阴生地被植物的耐阴性研究[J].中国园林,2009,25(6):100-103.
[8] DESJARDIN V, BAYARD R, HUCK N, et al. Effect of microbial activity on the mobility of chromium in soils[J]. Waste Management,2002,22(2):195-200.
[9] 张金政,张起源,孙国峰,等.干旱胁迫及复水对玉簪生长和光合作用的影响[J].草业学报,2014,23(1):167-176.
[10] 许怡玲,遇文婧,周玉迁,等.低温胁迫对玉簪根系活力的影响[J].林业科技,2010,35(3):55-58.
[11] 高志慧.引种玉簪(Hosta)抗寒性及组培快繁研究[D].哈尔滨:东北林业大学,2008.
[12] 张治安,陈展宇.植物生理学实验技术[M].长春:吉林大学出版社,2008.
[13] ARALDI C G, COELHO C M M, GAZIOLA S A, et al. Storage elicits a fast antioxidant enzyme activity inAraucariaangustifolia, embryos[J]. Acta Physiologiae Plantarum,2016,38(8):201.
[14] 张燕红,吴永波,刘璇,等.高温和干旱胁迫对杨树幼苗光合性能和抗氧化酶系统的影响[J].东北林业大学学报,2017,45(11):32-38.
[15] 杨克彬,孟凡志,郭先锋.七个切花红掌品种对低温胁迫的生理响应及耐低温能力评价[J].植物生理学报,2017,53(9):1609-1618.
[16] VELIKOVA V, YORDANOV I, EDREVA A. Oxidative stress and some antioxidant systems in acid rain-treated bean plants. Protective role of exogenous polyamines[J]. Plant Science,2000,151(1):59-66.
[17] 杜有新,何春林,张乐华,等.庐山若干常绿树种对冬季低温的生理生化响应[J].生态环境学报,2014,23(6):945-949.
[18] ASADI-SANAM S, PIRDASHTI H, HASHEMPOUR A, et al. The physiological and biochemical responses of eastern purple coneflower to freezing stress[J]. Russian Journal of Plant Physiology,2015,62(4):515-523.
[19] SIN’KEVICH M S, SELIVANOV A A, ANTIPINA O V, et al. Activities of antioxidant enzymes ofArabidopsisthaliana, plants during cold hardening to hypothermia[J]. Russian Journal of Plant Physiology,2016,63(6):749-753.
[20] 柴弋霞,曾雯,金晓玲,等.铁冬青雌雄株在低温胁迫下的响应及抗寒性差异[J].中南林业科技大学学报,2017,37(9):93-98.
[21] XI Z, WANG Z, FANG Y, et al. Effects of 2,4-epibrassinolide on antioxidation defense and osmoregulation systems of young grapevines (VitisviniferaL.) under chilling stress[J]. Plant Growth Regulation,2013,71(1):57-65.
[22] PENG J, WAN Z, WANG Z, et al. Dynamic QTL analysis for activity of antioxidant enzymes and malondialdehyde content in wheat seed during germination[J]. Euphytica,2013,190(1):75-85.
[23] 李文明,魏一粟,钱燕萍,等.5种酢浆草属植物对低温胁迫的生理响应及抗寒性评价[J].东北林业大学学报,2017,45(7):28-33.
[24] 项延军,李新芝,王小德.5种藤本植物的抗寒性研究初探[J].浙江大学学报(农业与生命科学版),2011,37(4):421-424.
[25] PATTON A J, CUNNINGHAM S M, VOLENEC J J, et al. Diff erences in freeze tolerance of zoysiagrasses: ii. carbohydrate and proline accumulation[J]. Crop Science,2007,47(5):2170-2181.
[26] 冉卓.低温胁迫紫花苜蓿生理生化特性和解剖结构的研究[D].沈阳:沈阳农业大学,2017.

