HPLC-ELSD测定灵芝及其孢子粉中胆碱质量分数
王亚涛 , 刘艳芳 , 张芝华 ,3, 张 忠 ,张劲松, 王晨光, 周 帅, 唐庆九*
(1.上海海洋大学 食品学院,上海201306;2.国家食用菌工程技术研究中心/农业部南方食用菌资源利用重点实验室/上海市农业科学院食用菌研究所,上海201403;3.上海应用技术大学 香料香精技术与工程学院,上海201418;4.上海百信生物科技有限公司,上海 201403)
灵芝(Ganoderma lucidum)是一种名贵中药材,具有抗肿瘤、增强免疫功能、降血糖和保肝等多种药理作用[1-5]。灵芝孢子粉是在灵芝生长成熟期从灵芝菌褶中弹射出来的极其微小的卵形生殖细胞,文献报道与子实体有类似的功效[6],目前被广泛用于保健食品中。灵芝及其孢子粉中含有多种化学成分如多糖、三萜和核苷等[6-7]。1998年侯翠英等[8]还从灵芝中分离纯化出两种生物碱,即胆碱和甜菜碱。胆碱具有促进脑发育、提高记忆能力、调控信息传递、促进脂肪代谢和降低血清胆固醇等生理功能[9-13]。
目前胆碱的检测方法有雷氏盐比色法[14]、雷氏盐重量法[15]以及酶比色法[16]等,由于这些方法操作繁琐,干扰因素多,选择性差等不足之处,近年来发展起来的高效液相色谱法[17-19]和离子色谱法可以准确地测定胆碱的含量。目前灵芝及其孢子粉中胆碱的含量测定未见报道,因此作者建立一种高效液相色谱快速高效检测灵芝中胆碱质量分数的方法,为灵芝及其孢子粉中质量评价提供依据。
1 材料与方法
1.1 材料与试剂
灵芝及其孢子粉 (泰山):山东泰安农科院提供;灵芝及其孢子粉(浙江):浙江龙泉灵芝基地提供。
胆碱:购自北京百灵威科技有限公司;乙腈(色谱纯):购自美国Dikma公司。
1.2 仪器
Waters e2695型高效液相色谱仪:美国Waters公司产品;Waters 2424型蒸发光散射检测器:美国Waters公司产品;KQ-600B型超声清洗器:昆山市超声仪器有限公司产品;恒温混匀仪:杭州奥盛仪器有限公司产品;5415D微型离心机:德国Eppendorf公司产品。
1.3 方法
1.3.1 色谱条件 色谱柱:ZORBAX 300-SCX阳离子交换色谱柱(4.6mm×250mm ,5μm),柱温 30 ℃;流动相:乙腈(A)-质量分数 0.3%乙酸铵(B),V(A)∶V(B)=60∶40,等度洗脱;流量:1.0 mL/min;进样量:10 μL;运行时间:25 min;蒸发光散射检测器检测,漂移管温度:60℃;喷雾器:模式为加热;雾化气:净化空气,压力为172.4 kPa。
1.3.2 对照品储备液的制备 精密称取胆碱111.1 mg,用超纯水稀释,然后用1 mol/L的醋酸调节pH至中性,再转移到50 mL容量瓶中,加超纯水定容至刻度,得1 mg/mL胆碱标准品储备液。
1.3.3 提取方法的比较 加热提取:精确称取灵芝孢子粉0.5 g于离心管中,加入蒸馏水10 mL,密封,置恒温混匀仪中提取,设定温度60℃,转速300 r/min,时间 60 min;待提取结束后,冷却至室温,离心,上清液经0.22 μm微孔滤膜过滤,进高效液相系统分析测定。用体积分数95%乙醇代替蒸馏水进行以上操作,每组处理做3组平行。
超声提取:精确称取灵芝孢子粉0.5 g于离心管中,加入所选提取溶剂10 mL,密封,置超声波清洗仪中,室温超声提取60 min,后续操作同上。将超声波清洗仪温度设为60℃,超声提取30 min和60 min两组样品,其他操作同上。
1.3.4 提取条件的优化 按照1.3.3实验确定的提取方法,设定提取时间分别为 30、60、120、180 min,比较实验结果确定提取时间;设定提取温度分别为40、60、80、100 ℃, 比较实验结果确定提取温度;设定料液质量体积比为 1 g∶10 mL~1 g∶60 mL,比较实验结果确定料液质量体积比。
1.3.5 样品中胆碱质量分数测定 按照1.3.3和1.3.4确定的样品前处理方法和1.3.1的色谱条件测定样品中胆碱的质量分数。
2 结果与分析
2.1 色谱条件确定
2.1.1 流动相优化 实验中用醋酸调节流动相的pH值,结果表明,乙酸铵的pH值越小,检测器的基线噪音越小,峰型也变好,考虑色谱柱的pH值使用范围,最终将乙酸铵pH调节为3.28,此时,峰型和基线良好,灵敏度较高。调节流动相A和B的比例。结果表明,乙腈比例越高,样品色谱峰的保留时间越长,这应该是流动相的极性减弱导致的;另外,考虑到样品峰面积在 V(A)∶V(B)=60∶40 时最大,故确定流动相 V(A)和 V(B)的比例为 60∶40。
2.1.2 检测器条件优化 漂移管温度由60℃变为80℃,基线噪音减小,但同时样品峰信号也变小,其他无明显变化,故漂移管温度确定为60℃。
胆碱标准品和灵芝孢子粉样品的高效液相图谱如图1所示,可以看到胆碱的出峰时间在18 min,灵芝孢子粉样品中胆碱和其他成分可有效分离。

图1 胆碱标准品(a)和样品(b)的高效液相图谱Fig.1 HPLC chromatograms of choline standard(a) and test sample(b)
2.2 样品提取条件的优化
2.2.1 提取溶剂和提取方法的比较 分别用蒸馏水和95%乙醇作为溶剂,对灵芝孢子粉中胆碱提取效果进行比较,结果表明:水作为提取溶剂所得胆碱质量分数为0.611 mg/g,显著(P≤0.05)高于体积分数95%乙醇作为提取溶剂,故选择蒸馏水作为提取溶剂。对超声提取和加热提取两种方法进行比较,结果发现:超声时间在30~60 min,超声温度在25~60℃范围内,胆碱提取量无显著性差异 (P>0.05),说明超声时间大于30 min后,时间和温度对超声提取结果基本无影响。超声提取的胆碱平均质量分数为0.579 mg/g,低于加热提取胆碱质量分数,故选择加热提取。
2.2.2 提取条件比较 当提取时间达到60 min时,可以达到较好的提取效果,且显著性分析表明,随着时间的延长,胆碱提取量无显著性差异(P>0.05),故确定提取时间为60 min。当提取温度大于60℃,可以达到较好的提取效果,且在60~100℃范围内胆碱提取量无显著性差异(P>0.05),故提取温度确定为中间值80℃。料液质量体积比在1 g∶10 mL~1 g∶40 mL范围内,胆碱提取量随着提取溶剂的增加而增加;料液质量体积比大于1 g∶40 mL时,胆碱提取量略有减少,故确定料液质量体积比为1 g∶30 mL。
2.3 方法学考察
2.3.1 线性范围 精密吸取对照品储备液适量,用超纯水逐级稀释为不同浓度,测定相应质量分数下对照品的峰面积,以对照品质量分数的对数(lgC)为横坐标,以峰面积的对数(lgA)为纵坐标,绘制标准曲线,计算回归方程为Y=1.540 9X+2.500 3,R2=0.999 8,表明胆碱在 6.25~200 μg/mL 范围内具有良好的线性关系。
2.3.2 检测限和定量限 计算2.3.1中不同浓度对照品溶液的信噪比(S/N),以S/N大于等于3确定检测限为6 μg/mL,S/N大于等于10确定定量限为12 μg/mL。按照1.3.1的色谱条件,分别对检测限和定量限的对照品溶液连续进样3次,计算信噪比。结果表明:检测限的平均信噪比为 3.12,RSD为2.24%;定量限的平均信噪比为 10.05,RSD为1.28%。

表1 提取溶剂和提取方法的比较结果Table 1 Results of different extraction solvents and extraction methods
2.3.3 精密度 按照1.3.1的色谱条件,连续进样6次50 μg/mL的对照品溶液,测定峰面积。结果表明:对照品峰面积的RSD为0.84%,表明仪器的精密度良好。
2.3.4 重复性 精密称取同一批次样品6份,按照1.3.3和1.3.4确定的样品前处理方法制备供试液,按照1.3.1的色谱条件测定。结果表明:样品中胆碱的平均质量分数为0.654 mg/g,RSD为0.67%,表明该方法的重现性良好。
2.3.5 稳定性 按照1.3.3和1.3.4确定的样品前处理方法制备供试液,分别在 0、2、4、6、12、24 h 按1.3.1的色谱条件测定。结果表明:供试液中胆碱质量分数的RSD为1.91%,表明供试液在24 h内胆碱质量分数稳定。
2.3.6 加样回收率 按照2.3.4测出样品中的胆碱平均质量分数,添加等量的胆碱标准品于样品中,按照1.3.3和1.3.4确定的样品前处理方法制备供试液,按1.3.1的色谱条件测定,做6组平行。加样回收率测定结果见表2,结果表明:该方法的加样回收率在96.54%~102.85%范围内,平均回收率为100.37%,RSD为2.86%,表明该方法回收率良好。
2.4 样品中胆碱质量分数
由表3可知,不同产地的灵芝孢子粉和子实体胆碱质量分数都不同,并且同一产地的灵芝孢子粉胆碱质量分数显著(P≤0.05)高于灵芝子实体。
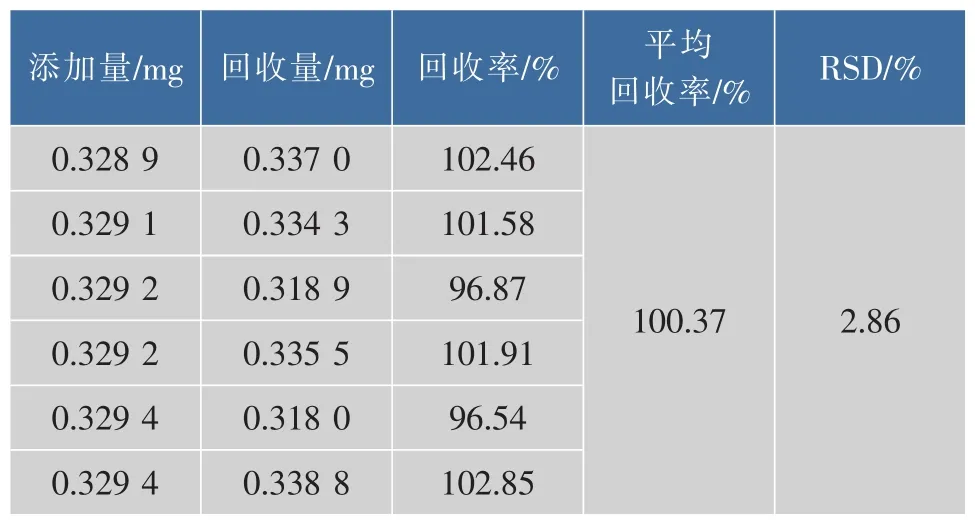
表2 回收率实验结果Table 2 Results of recovery experiments

表3 样品测定结果Table 3 Results of sample determination
3 讨 论
示差折光检测器和蒸发光散射检测器都是通用型检测器,但是示差折光检测器对压力和温度等变化敏感,灵敏度较低,且不能用于梯度洗脱,而蒸发光散射检测器要求样品组分不易挥发,流动相为易挥发溶剂,且是一种破坏性检测器。作者首先选择了示差折光检测器,但是发现检测信号基线噪音大,考虑到可能是由于泵将流动相A和B混合时,引起流量不稳所致,故将流动相A和B提前混合后使用,结果基线噪音有所改善,但依然较大,并且色谱峰存在严重拖尾现象;改用蒸发光散射检测器后,检测信号的基线噪音小,且不受流动相A和B的混合方式影响,色谱峰也不存在拖尾现象,可以满足实验要求。
胆碱是一种离子化合物,碱性较强,作者选用阳离子交换色谱柱[19],为了使胆碱溶液的pH在色谱柱的要求范围内,实验前用醋酸将胆碱溶液调节为中性。样品水提物中胆碱的保留时间为18 min,峰较小,但峰型良好,并能和其它物质峰有效分离,这表明该色谱柱在本实验条件下适合灵芝孢子粉中胆碱的分离检测;实验发现在保留时间为14 min处,有一较大的单一色谱峰,该物质目前尚不明确,需另做深入研究。
作者建立了运用HPLC_ELSD测定灵芝及其孢子粉中胆碱质量分数的方法,该方法简便快速,精密度、重复性、稳定性和回收率均良好,可以用来进行灵芝及其孢子粉中胆碱的定性分析。目前灵芝类产品的质量评价指标主要是多糖质量分数和三萜质量分数,胆碱是灵芝中的一种重要组成成分,具有多种生理功能,将来可以考虑把胆碱质量分数作为评价灵芝类产品质量的一个重要指标。
参考文献:
[1]LIU Feng,LI Peng,HUANG Xiuwang,et al.Anti-tumor effect of triterpene GLE from GanodermaLucudum in vivo and in vitro[J].Chinese Journal of New Drugs,2012,21(23):2790-2793.(in Chinese)
[2]VAN T N,NGUYEN T T,TO D C,et al.Cytotoxic and anti-angiogenic effects of lanostane triterpenoids from Ganoderma lucidum[J].Phytochemistry Letters,2015(12):69-74.
[3]Ying-Juan L,Jin-Liang D,Li-Ping C,et al.Anti-inflammatory and hepatoprotective effects of Ganoderma lucidumpolysaccharides on carbon tetrachloride-induced hepatocyte damagein common carp (Cyprinus carpio L.)[J].International Immunopharmacology,2015(25):112-120.
[4]BOJANA B,MARIN B,JINGSONG Z,et al.Ganoderma lucidum and its pharmaceutically active compounds[J].Biotechnology Annual Review,2007,13:265-301.
[5]ZHANG Yue,LUO Jun,HUANG Nenghui,et al.Protective effects and mechanism of Ganoderma lucidum triterpenoids on learning and memory function of Alzheimerdisease model animals[J].Journal of Food Science and Biotechnology,2012,31(7):741-744.(in Chinese)
[6]LIN Zhibin,WANG Pengyun.The pharmacological study ofGanoderma spores and their active components[J].Journal of Peking University(Health Sciences),2006,38(5):541-547.(in Chinese)
[7]刘思妤.灵芝化学成分的研究[D].沈阳:沈阳药科大学,2007.
[8]HOU Cuiying,SUN Yiting,YANG Lin, et al.Studies on the chemical constitutions of the spores from Ganoderma lucidum(Leyss.et Fr.) Karst[J].Chinese Bulletin of Botany,1998,30(1):66-70.(in Chinese)
[9]WANG Yimin,LI Xiangxiang,YAO Chong.A review of choline biology function and its influence towards the motor ability[J].Journal of Ankang University,2014,26(5):96-99.(in Chinese)
[10]XINYIN J,ALLYSON A W,MARIE A C.Maternal choline supplementation:a nutritional approach for improving offspring health?[J].Trends in Endocrinology and Metabolism,2014,25(5):263-273.
[11]VERNER K,SARADELA S,JOELLE C,et al.Neurocognitive effects of acute choline supplementation in low,medium and high performer healthy volunteers[J].Pharmacology,Biochemistry and Behavior,2015(131):119-129.
[12]CRYSTAL D,JIAN Y,SIRAPHAT T,et al.Choline intakes exceeding recommendations during human lactation improve breast milk choline content by increasing PEMT pathway metabolites[J].Journal of Nutritional Biochemistry,2015,(26):903-911.
[13]潘志远.胆碱和阿司匹林协同抗炎作用及其药理学机制的研究[D].天津:中国人民解放军军事医学科学院,2014.
[14]XUN Yamai,ZHAO Zemin,CHU Xiaobo.Analysis on the determination of choline in milk powder for infant[J].China Dairy,2015,159:65-66.(in Chinese)
[15]SONG Rong,CHANG Biying.Determination of choline chloride byReinekes salt gravimetricmethod[J].Food China,2001,23:17-19.(in Chinese)
[16]GB/T 5413.20-1997,婴幼儿配方食品和乳粉胆碱的测定[S].
[17]ANDREW J O,JASON R S,THOMAS D N.Development and validation of a simple UHPLC-MS/MS method for the simultaneous determination of trimethylamine N-oxide,choline,and betaine in human plasma and urine [J].Journal of Pharmaceutical and Biomedical Analysis,2015,109:128-135.
[18]CHRISTOPHER J M,SANDY S,MICHAEL L.Measurement of plasma free choline by high performance liquid chromatography with fluorescence detection following derivatization with 1-naphthyl isocyanate[J].Analytica Chimica Acta,2009,644:90-94.
[19]LI Yuanyuan,GUAN Shuwen,WANG Wei,et al.Analysis of choline in fomula milk powder for infant andyoung children by HPLC[J].Food Science and Technology,2009,34(10):263-265.(in Chinese)

