牛奶中残留麻保沙星的微生物学检测方法
陈秀金, 任国艳, 许凯旋, 崔 璨,张永丽, 侯玉泽, 胥传来, 李 根
(1.河南科技大学 食品与生物工程学院,河南 洛阳 471023;2.江南大学 食品学院,江苏 无锡214122)
麻保沙星 (Marbofloxacin,CAS 号:115550-35-1),其化学名为 9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪)-7-氧-7H-吡啶-[3,2,1-ij][4,1,2]-苯并噁二嗪-6-羧酸,为动物专用的一种新型氟喹诺酮类抗菌药,因抑制细菌DNA复制中所需要的拓朴异构酶而表现出杀菌活性,具有抗菌谱广、抗菌活性强、生物利用度高、毒性低、对其他抗菌物无交叉耐药性等优点[1-4]。然而,由于经济利益的驱使 ,一些养殖户不合理地使用和滥用麻保沙星,如在休药期出售和屠宰畜禽[5],从而导致了动物性源食品中的麻保沙星残留超标。长期食用超标的动物源性食品,易使人体内的敏感菌产生耐药性,严重时导致人体长期腹泻或营养不良,还可能会引起皮疹、过敏性休克等不良反应[6]。因此,建立牛奶中残留麻保沙星的有效的检测方法是目前的当务之急。
用于检测麻保沙星残留的方法有高效液相色谱法[7]、高效毛细管电泳法[8]和免疫分析法[9-11],其中高效液相色谱法和毛细管电泳法检测限低,但设备昂贵,不易推广。免疫法虽然简便快速,但抗体制备周期长。微生物法检测样品成本低,简便可靠,不需要特殊设备,适用于麻保沙星残留大量样品的初步筛选。为了更好对麻保沙星残留进行质量监控,作者选择金黄色葡萄球菌为工作菌,建立麻保沙星在牛奶中残留的微生物学检测方法,为牛奶中麻保沙星残留的检测提供了一种简便、可行的方法。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种 金黄色葡萄球菌(Staphylococcus aureus subsp.aureus,ATCC 27217),购自中国工业微生物菌种保藏管理中心。
1.1.2 试验材料 纯牛奶:市售。
1.1.3 主要试剂 麻保沙星标准品:购自上海楚定分析仪器有限公司;酵母粉、蛋白胨、琼脂粉、牛肉膏:购自深圳市科天化玻仪器有限公司。
1.1.4 麻保沙星标品贮备液的配制 准确称取麻保沙星标准品50.0 mg,采用无菌的磷酸盐缓冲溶液(0.05 moL/L,pH 7.2)溶解后,用 50 mL 容量瓶定容,得到质量浓度为1 000 μg/mL麻保沙星标准品储备液,4℃下保存2周。
1.1.5 培养基 培养基I、培养基II和培养基III按照参考文献[12]进行配制。
1.2 仪器设备 超净工作台:苏州净化设备有限公司产品;生化培养箱:上海博迅有限公司医疗设备产品;水平型电子数显摇床:上海双旭电子有限公司产品。
1.3 菌悬液的制备
将实验室保存的金黄色葡萄球菌斜面转接到新制备的营养琼脂斜面上,在37℃下恒温培养20 h,完成活化过程。然后将活化过的斜面菌种用接种针接种到液体培养基中,振荡混匀,同时以未接种的液体培养基作为空白对照,在37℃生化培养箱中培养,采用可见分光光度仪测定不同培养时间下菌悬液在560 nm波长下的透光率,选择透光率为20%时的菌悬液进行涂布[13]。
1.4 菌液平板的制备
试验采用混菌双层平板法进行抑菌试验。首先向直径为90 mm的平皿中加入融化的固体培养基II 7.0~8.0 mL,左右晃动后,放置在超净台上凝固;带培养基完全凝固后,另取固体培养基II适量加热溶化,冷却至50℃,一般每100 mL培养基中加入1 mL透光率为20%的菌悬液,摇匀,在每一平皿中分别加入7.0~8.0 mL左右,左右晃动使其铺满平皿作为菌层。待平皿中的培养基完全凝固后,采用无菌操作用镊子将灭菌的试纸片放到菌层上,对每个平皿进行标记,每个试验做3次平行。
1.5 麻保沙星标准曲线的建立
1.5.1 基于磷酸盐缓冲溶液的麻保沙星标准曲线绘制 采用0.05 moL/L,pH 7.2无菌磷酸盐缓冲溶液将麻保沙星的标准贮备液稀释为0.1,0.2,0.4,0.8,1.6 μg/mL,然后量取不同浓度的麻保沙星标准液滴加到平板的滤纸片上,每个浓度做3个平行试验,每个滤纸片上麻保沙星的添加体积为100 μL。标记每个平板后,将其小心平移至4℃冰箱中,放置4 h,而后转入37℃生化培养箱中培养20 h。再用游标卡尺测定每个抑菌圈的直径,计算平均值,以抑菌圈直径的平均值为横坐标,麻保沙星浓度的对数值为纵坐标,采用origin 8.5软件进行线性回归拟合,得到测定麻保沙星的标准曲线和回归方程。
1.5.2 空白牛奶的测定 采用混菌双层平板法进行抑菌试验,其中滤纸片上仅添加牛奶样品,经培养后,依据平板上是否产生抑菌圈,判断牛奶中是否含有抑制金黄色色葡萄球菌的抗生素(包括麻保沙星)。若平板上无抑菌圈产生,则可以选作空白奶样。
1.5.3 牛奶基质的麻保沙星标准曲线的绘制 采用空白牛奶将麻保沙星的标准贮备液稀释为0.1,0.2,0.4,0.8,1.6 μg/mL,其他试验步骤参照 1.5.1 方法进行,绘制牛奶基质的麻保沙星标准曲线。1.6 添加回收试验
从100 μg/mL的麻保沙星标品储备液中准确移取30,60,120 μL加到一定体积奶样中,总体积为10 mL,得到添加麻保沙星终浓度的水平分别为0.3,0.6,1.2 μg/mL, 每个浓度分别设置 3 个平行试验,回收率按照1.5.3方法建立的标准曲线进行计算。
2 结果与分析
2.1 菌悬液浓度的确定
按照1.3的方法,测定不同培养时间菌悬液在560 nm处透光率。随着培养时间的延长,菌悬液浓度不断增加,透光率将不断变小。通常选择菌悬液在560 nm波长下透光率为20%的培养时间。同时对透光率为20%的菌悬液涂平板,37℃下恒温培养20 h,观察菌落的生长状态。通过抑菌试验得出,培养时间为10.5 h时,菌悬液浓度可以产生清晰的抑菌圈。
2.2 麻保沙星对金黄色葡萄球菌的抑菌结果
按照1.5.1方法测定金黄色葡萄球菌对麻保沙星(质量浓度:0.4 μg/mL)的敏感性,结果见图1。

图1 麻保沙星抑菌结果Fig.1 Inhibition result of marbofloxacin
由图1可见,在长满金黄色葡萄球菌的平板上,仅滤纸片的周围形成了明显的抑菌圈,说明麻保沙星对金黄色葡萄球菌具有抑菌作用。因此,选择金黄色葡萄球菌作为敏感菌。
2.3 麻保沙星标准曲线的绘制
2.3.1 空白牛奶的测定结果 按照1.5.2的方法对牛奶样品抑菌效果进行测定,结果见图2。
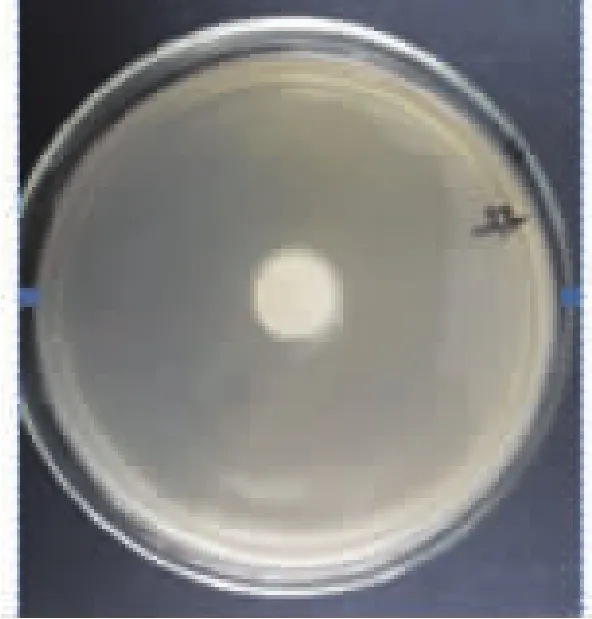
图2 空白牛奶的测定结果Fig.2 Detection result of control milk samples
由图2可见,在滤纸片周围没有产生抑菌圈,说明牛奶中不含有对金黄色葡萄球菌有抑制作用的药物 (包括麻保沙星),故可以选其作为空白样品。
2.3.2 麻保沙星标准曲线的绘制 对不同麻保沙星质量浓度按照1.5的方法进行抑菌试验,以麻保沙星质量浓度c对数为横坐标,以抑菌圈直径为纵坐标,绘制基于磷酸盐缓冲溶液和牛奶基质的麻保沙星标准曲线,结果见图3。

图3 测定麻保沙星的标准曲线Fig.3 Standard curve of marbofloxacin determination
在磷酸盐缓冲溶液的麻保沙星标准曲线基础上,建立了基于牛奶基质的麻保沙星标准曲线。以磷酸盐缓冲溶液和伊利纯牛奶为基质的麻保沙星标准曲线线性回归方程分别为Y=0.053X-1.052和Y=0.061X-1.05;相关系数都在0.99以上;在抑菌圈直径和麻保沙星质量浓度对数之间存在着良好的线性关系,在此范围内测定麻保沙星的结果较接近真实值。
2.4 添加回收试验
按照1.6方法测定添加阳性奶样中麻保沙星含量,基于牛奶基质麻保沙星标准曲线的回归方程计算回收率,其中抑菌圈的直径是减去滤纸片直径(d=13 mm)后的数据,结果见表1和图4。

表1 添加回收试验结果Table 1 Result of spiked test


图4 麻保沙星的抑菌结果Fig.4 Inhibition result of marbofloxacin in milk sample
由表1和图4可见,作者建立的方法对牛奶中麻保沙星的平均回收率在77.3%~93.3%之间,说明该方法具有较好的可靠性。重复性试验的变异系数在2.69%~4.05%之间,批间试验的变异系数5.27%~7.26%变化,说明该方法批内和批间的稳定性较好。
3 结 语
1)作者首次选择金黄色葡萄球菌为敏感菌种,建立了牛奶中麻保沙星残留的微生物学检测方法。
2)通过试验表明,采用分光光度法不仅有效地节省了试验时间,而且减少不同批次培养菌悬液造成的浓度波动,有效地保证了该方法的稳定性。
3)试验过程必须严格执行无菌操作,尽可能地避免平板污染现象发生。另外,作者还研究了滤纸片上麻保沙星添加体积对结果的影响,每个滤纸片上的添加体积以100 μL为宜。在添加麻保沙星标液后,一定要将平板缓慢地平移至冰箱。
4)目前,用于检测麻保沙星的各种仪器分析方法存在前处理复杂和检测成本高的缺点,不适合对日常大量样品的初筛,难以实现在基层的普及应用。而作者建立的方法操作简单、成本低和不需要前处理,完全能用于牛奶中残留麻保沙星的初筛,并为制定其标准的检测技术提供依据。
参考文献:
[1]YAN Xiaomin.Determination of raw marbofloxacin by high performance capillary zone electrophoresis[J].Guide of China Medicine,2012,10(35):72-73.(in Chinese)
[2]DUBREUIL L,HOUCKE I,LEROY I.In vitro activity of a new fluoroquinolone marbofloxacin (RO 09-1168) against strictly anaerobic bacteria and some bacteria from human fecal flora[J].Pathologie-Biologie,1996,44(5):333-336.
[3]HEINEN E.Comparative serum pharmacokinetics of the fluoroquinolones enrofloxacin,difloxacin,marbofloxacin,and orbifloxacin in dogs after single oral administration[J].Journal of Veterinary Pharmacology and Therapeutics,2002,25(1):1-5.
[4]CARRETERO M,RODRIGUEZ C,ANDRES M I S A N,et al.Pharmacokinetics of marbofloxacin in mature horses after single intravenous and intramuscular administration[J].Equine Veterinary Journal,2002,34(4):360-365.
[5]CHEN Yizi,HU Bin.Reasons&harm of animal medicine remainder to animal material food[J].Journal of Food Science and Biotechnology,2009,28(2):162-166.(in Chinese)
[6]魏雷雷.牛奶中氟喹诺酮类残留量测定新方法的研究与应用[D].衡阳:南华大学,2010.
[7]MAHMOOD A H,MEDLEY G A,GRICE J E,et al.Determination of trovafloxacin and marbofloxacin in sheep plasma samples by HPLC using UV detection[J].Journal of Pharmaceutical and Biomedical Analysis,2012,62:220-223.
[8]LI Zhiwei,CUI Zhe,LIU Bo,et al.Determination of marbofloxacin by high performance capillary zone electrophoresis[J].Journal of Hebei University of Science and Technology,2011,32(1):75-77.(in Chinese)
[9]SHENG W,XIA X,WEI K,et al.Determination of marbofloxacin residues in beef and pork with an enzyme-linked immunosorbent assay[J].Journal of Agricultural and Food Chemistry,2009,57(13):5971-5975.
[10]SHENG W,LI T,XU X,et al.Enzyme-linked immunosorbent assay and colloidal gold-based immunochromatographic assay for several(fluoro)quinolones in milk[J].Microchimica Acta,2011,173(3-4):307-316.
[11]LI Yuanzhen,SHENG Wei,LIU Enmei,et al.Determination of QNs residues in milk by enhanced chemiluminescent enzyme immunoassay[J].Food Research and Development,2013,34(16):78-81.(in Chinese)
[12]LIU Xiuli,HAO Yongqing,SI Qin,et al.Determination of ciprofloxacin residues in milk by microbioIogical method[J].Progress in Veterinary Medicine,2009,30(3):59-62.(in Chinese)
[13]HU Xiaomiao,ZHANG Danjun,ZHAO Ruihong,et al.Determination of ofloxacin residues in faeces of chicken by microbiological method[J].Chinese Agricultural Science Bulletin,2009,25(23):31-33.(in Chinese)

