抗肿瘤治疗相关心功能不全的防治进展
张艳丽 综述 刘莹 审校
(大连医科大学附属第一医院心血管病医院心内科,辽宁 大连 116021)
近年来,随着医学诊疗水平的不断提高,恶性肿瘤患者的生存期不断延长。同时,肿瘤治疗相关心血管疾病日益凸显。其中,肿瘤治疗相关心功能不全是放疗、化疗、靶向治疗最常见的不良反应之一,可严重影响患者的生存质量及预后。有研究报道,接受过蒽环类药物化疗和/或纵膈放疗的儿童癌症幸存者,发生心功能不全的风险增加15倍[1]。不同种类的化疗药物引起心功能不全的发生率不尽相同(见表1)。因此,应多学科协作,对接受抗肿瘤治疗患者进行综合管理,监测、防治心血管并发症。现对肿瘤治疗相关心功能不全防治进展做一综述。
1 抗肿瘤治疗前的基线心血管疾病评估
在抗肿瘤治疗开始之前进行的基线心血管疾病风险评估至关重要,可早期识别可能出现心脏毒性的高危患者。化疗相关心功能不全危险因素见表2,放疗相关心功能不全常见危险因素包括前或上胸部放疗部位、放射剂量累积>30 Gy、年轻患者(<50岁)、高放射分数(>2 Gy/d)、肿瘤在心脏内或毗邻心脏、缺少防护、伴随化疗、同时并存心血管危险因素(如糖尿病、吸烟、肥胖、高血压、高胆固醇)、既往存在心血管疾病。在整个治疗过程中及治疗后,应建立详细的心血管管理计划,尽可能早期发现无症状心脏疾病,进而调整化疗方案,适时加用心脏保护药或者增加随访频率。通常应由肿瘤科医师对患者进行基线危险因素评估,将高危患者转诊至心脏科医师进行进一步评估,可根据危险因素个数和严重程度判断是否为高危患者,由心血管医师对患者进行评估检查,必要时可由心脏-肿瘤专家组共同评估病情,建议借鉴国内外一些中心经验,推荐建立肿瘤心脏病单元,以规范抗肿瘤治疗中对心血管疾病进行全程管理。
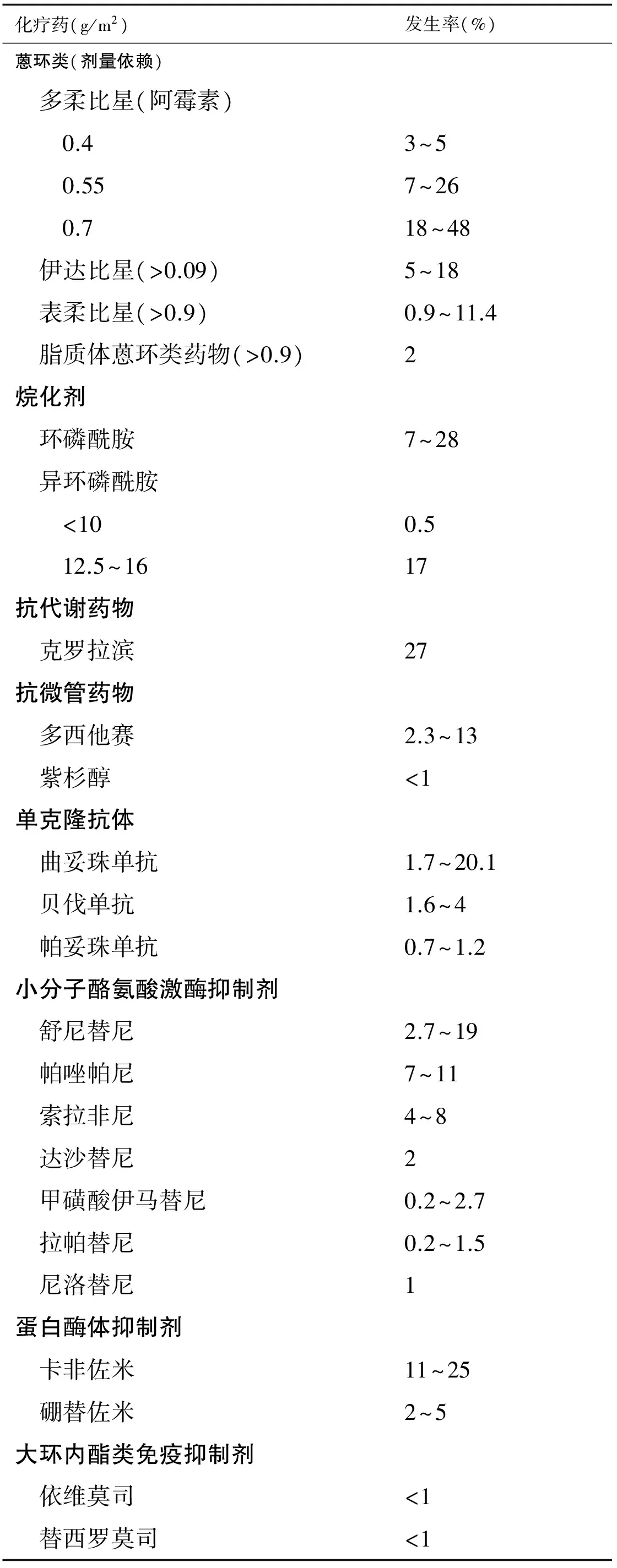
表1 化疗相关的左室功能不全发生率[2]
2 抗肿瘤治疗相关心功能不全的监测
2.1 心脏超声心动图
心脏超声心动图在评价心脏结构和功能中占有中心位置,在多数病例中为首选影像学检查方法,也是肿瘤患者治疗前、中、后监测心功能最常用的影像学技术。左室射血分数(LVEF)是评估心功能最常用的参数。目前肿瘤相关性心功能不全定义为:LVEF下降幅度>10%,且低于正常值下限。临床上常用二维双平面法(双平面辛普森法)测量LVEF,但因其测量依赖图像质量,不同测量者之间存在差异,故重复率低。对于二维成像欠佳的患者,可考虑应用心肌超声造影。三维超声在数学模型、几何假设、心室透视性等方面可弥补二维超声心动图的不足,在计算左室容积时准确性、重复性更高,在幸存的癌症患者中应用三维超声测得的LVEF与心脏磁共振(CMR)测得的LVEF存在较好的相关性[3],被认为是癌症患者监测心功能和心脏毒性的首选技术。
尽管目前LVEF仍是衡量左室收缩功能的最佳指标,但它是心脏毒性的晚期监测指标,同时受心脏前后负荷的影响。因此,临床需监测心肌损伤的早期指标。应用二维斑点追踪技术,进行超声应变分析,已在监测早期心肌损伤方面展现优势。整体纵向应变(GLS)可早期预测LVEF下降[4],目前认为GLS较基线水平下降15%提示早期亚临床左室功能不全;但目前并无证据表明仅因GLS降低而中断抗肿瘤治疗或化疗药物减量。此外,该技术目前也存在一定局限性,如耗时、操作技术要求高、不同的超声机器和软件可产生不同的结果,导致不同设备测得的GLS难以相互比较。目前,对于早期亚临床左室功能不全的超声心动图评价仍是研究的热点。
2.2 CMR
CMR无辐射、组织分辨率高,能清楚地显示心脏解剖结构,可用于检测癌症治疗前、治疗期间以及治疗后的心脏功能变化。CMR能在几周到数月内检测出蒽环类药物和曲妥珠单抗导致的心脏毒性损伤,包括心肌水肿和可能无症状的左心收缩功能降低,是测量左室容积、射血分数及左室质量的金标准。此外,CMR能检测出心肌是否已发生纤维化,纤维化的程度、范围。一项研究纳入65例使用蒽环类药物化疗的患者,随访3个月后发现,心肌T2值并无显著变化,但其增强后T1值升高,并发现既往使用过化疗药物的患者T1值高于未使用过化疗药物的患者,且在心肌17节段中均无显著差异性,这提示化疗药物对于心肌纤维化的影响可能是不可逆的,且是弥漫性的[5]。
CMR心肌应变技术目前认为可能是一个早期心脏损害的检测指标。一项研究对于使用曲妥珠单抗(TZB)的乳腺癌患者,18.9%的患者出现了化疗诱导心脏毒性,61.4%的患者GLS出现了异常,前壁及间隔壁心肌收缩受损较为多见,并在发生心脏毒性的患者中更为显著。心肌变形的患者发展为心脏毒性的风险提高了4.9倍[6]。

表2 化疗基线心脏毒性危险因素[2]
注:a脑钠肽>100 pg/mL或N-末端脑钠肽前体>400 pg/mL,且不能用其他原因解释。
在目前多元化、多模态成像的时代,CMR具有独特的优势,CMR可精确地测量心脏体积和射血分数变化,用于监测放化疗前、后患者的心脏损伤。CMR还可评估患者心肌是否发生炎症、水肿和纤维化,这使得临床医生能及时发现放疗或化疗对患者心脏造成的早期或晚期的损伤。与此同时,T1值和心肌细胞外容积分数测量、心肌应变、扩散加权成像与体素内组织运动不相干成像等新技术使得在早期就检测出心脏损伤成为可能。CMR由于其成像信息的精确性将成为肿瘤心脏病学中重要甚至首选的成像方式。
2.3 心电图
放疗、化疗等导致的心肌损伤,可继发心肌缺血、各种心律失常,如窦性心动过速、窦性心动过缓、心房颤动、房性期前收缩、室性期前收缩、房室传导阻滞、QT间期延长等。心电图是发现心律失常最常用的检查方法。2016年ESC指南建议所有接受抗肿瘤治疗的患者,在治疗前、治疗中、治疗后都应定期复查心电图。
2.4 心脏生物标志物
尽管目前临床中不常规应用,但心脏生物标志物是早期筛查和监测心脏毒性的可靠指标。
2.4.1 肌钙蛋白
肌钙蛋白是参与肌肉收缩的重要调节蛋白,包括肌钙蛋白C(cTnC)、肌钙蛋白T(cTnT)、肌钙蛋白I(cTnI)。在心肌细胞发生变形坏死、细胞膜破损时,cTnT、cTnI释放入血。心肌损伤后2~3 h,血肌钙蛋白即可升高。多项研究表明,肌钙蛋白升高可预测LVEF降低[7-8]。一项研究纳入703例接受化疗的乳腺癌患者,分别于化疗前、化疗后3 d内(早期)、化疗后1个月(晚期)检测cTnI,21%的患者cTnI早期升高,9%的患者cTnI早期、晚期均升高,随访发现cTnI未升高的患者LVEF无明显降低,1%的患者发生心脏不良事件。而化疗后1个月cTnI仍持续升高的患者,LVEF明显降低,且84%发生心脏不良事件[9]。
2.4.2 脑钠肽
脑钠肽(BNP)和N-末端脑钠肽前体是目前公认的心力衰竭患者常用的检测指标,血浓度与心力衰竭程度相关,是判断心力衰竭及其严重程度的客观指标。BNP升高可见于成人及儿童人群化疗导致的左室功能不全,但目前研究尚未证实BNP和心功能不全之间的关系[10],这可能与化疗期间心脏仅发生容量改变但LVEF无变化有关。目前,对于肿瘤治疗过程中可能出现心肌损伤的高危患者,是否需常规检测BNP尚需进一步研究。
2.4.3 其他生物标志物
一些研究已发现一些其他潜在的心脏损伤标志物,如反映心肌纤维化的指标生长刺激表达基因2蛋白(ST2),氧化应激和炎症指标(C反应蛋白、白介素等)。抗肿瘤治疗期间及之后这些标记物可能会发生有意义的改变,但这些改变对心功能改变的预测意义尚需进一步研究。
目前建议为了便于对比评价病情变化,在整个治疗过程中应采用相同的影像学和/或生物标志物作为监测指标,不建议更换监测指标;推荐将重复性稳定的影像学检查和化验指标作为监测指标。尽管抗肿瘤治疗导致心功能不全的检测方法很多,但至今仍无研究证实哪一种检测方法可推荐为“金标准”。探索更敏感、更特异的检测方法是目前的研究热点。
3 抗肿瘤治疗相关心功能不全的治疗
美国心脏病学会(ACC)/美国心脏协会(AHA)将心力衰竭的发生、发展过程分为4个阶段。A阶段为存在高危因素,但心脏并未发生结构性改变;B阶段为心脏发生结构性改变,但无心力衰竭症状;C阶段为患者出现结构性改变,并存在心力衰竭症状;D阶段为晚期心力衰竭患者。
基于上述分类,每个接受心脏毒性肿瘤治疗的患者都应被认为处于一个心力衰竭的A阶段。因此,一级预防的重要方法是如果存在替代治疗药物,应避免应用心血管毒性药物。行放疗的患者,应用现代放疗计划以及应用新技术减少心脏辐射损伤,降低心力衰竭风险。
3.1 药物治疗
以往有小规模临床观察研究提示预防性应用血管紧张素转化酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)、β受体阻滞剂、右丙亚胺等药物,对抗肿瘤治疗所致心肌损害有保护作用,可预防化疗结束后心功能受损或心力衰竭的发生[11-14]。在刚刚举行的第67届美国心脏病学会年会(ACC 2018)上,公布了两项关于乳腺癌化疗相关心脏毒性一级预防的药物临床试验结果。Ceccy研究(Carvedilol for PrEvention of Chemotherapy-Induced CardiotoxicitY)为前瞻性、随机、双盲、安慰剂对照研究,旨在探讨卡维地洛对蒽环类药物相关心肌毒性的一级预防作用。该研究纳入200例HER2阴性乳腺癌接受化疗的成年患者。化疗方案为:环磷酰胺、阿霉素;序贯以紫杉醇。患者随机分为预防性应用卡维地洛组及安慰剂对照组,随访6个月,监测超声心动图、cTnI及BNP。结果显示卡维地洛组与安慰剂组在LVEF下降方面并无显著统计学差异,但卡维地洛组cTnI升高及心室舒张功能障碍的发生率较安慰剂组明显减少(cTnI:26.0% vs 41.6%,P=0.003;左室舒张功能障碍:15.2% vs 21.8%,P=0.039)。赖诺普利、卡维地洛对TZB诱发心肌毒性的预防研究(Lisinopril or Carvedilol for Prevention of Trastuzumab Induced Cardiotoxicity)为前瞻性、多中心、随机安慰剂对照临床试验,旨在探讨ACEI或β受体阻滞剂可否预防TZB导致的LVEF降低。该项研究共纳入468例HER2阳性接受TZB治疗的成人乳腺癌患者(曾接受蒽环类药物化疗189例,未接受蒽环类化疗279例)。患者被随机分为预防性应用赖那普利组、卡维地洛组及安慰剂对照组,随访2年(第1年为TZB治疗期,第2年为随访期)。主要终点事件为LVEF较基线下降≥10%;次要终点包括TZB停药发生率、接受蒽环类药物治疗组和非蒽环类治疗组治疗效果是否一致。随访结果显示,与安慰剂对照组相比,赖那普利和卡维地洛均未有效预防TZB所致LVEF降低,TZB停药发生率在三组患者中无统计学差异;但在曾接受过蒽环类药物化疗的亚组分析中发现,赖那普利和卡维地洛组发生LVEF降低的风险降低。通过上述研究可见,目前对于化疗相关心肌毒性的一级预防尚存在争议。虽然上述两项研究并未得到期待的临床结果,但也给了很多的提示:CECCY研究随访6个月发现卡维地洛未能有效预防蒽环类药物所致LVEF降低,但蒽环类所致心功能不全是一个进行性加重的过程,研究中cTnI 作为急性心肌损伤标志,卡维地洛组可有效预防cTnI升高,说明卡维地洛可有效减轻化疗后早期心肌损伤,进一步的长期随访或可提供更多的临床结果。未来对于抗肿瘤治疗心肌毒性的一级预防研究或可考虑纳入心脏毒性的多因素风险评价体系,通过建立不同危险分层,对于化疗相关心肌毒性的高危患者,进行一级预防的药物干预可能会取得更好的临床结果。
对于化疗后监测到心功能受损(B阶段心力衰竭)患者,一些研究提示心脏保护药的应用可逆转下降的LVEF。近期的一项meta分析表明,右丙亚胺可使左心功能不全和/或心力衰竭相对风险下降55%~73%(n=1 163),β受体阻滞剂可使风险下降37%~84%(n=458),ACEI为71%~96%(n=244)[15]。2016年ESC指南推荐,对LVEF明显下降(>10%)至低于正常值下限(<50%)水平者,若无禁忌,应用ACEI(或ARB)联合β受体阻滞剂,以延缓心功能不全进展或心力衰竭症状出现;若无禁忌,推荐所有心功能不全患者(无论是否存临床症状)应用ACEI(或ARB)联合β受体阻滞剂[2]。
如果出现症状性心力衰竭(C阶段和D阶段),可根据已有的心力衰竭指南进行治疗,ACEI/ARB、β受体阻滞剂是治疗症状性心力衰竭的关键药物。可根据患者情况应用利尿剂、醛固酮受体拮抗剂和地高辛等药物。
3.2 植入型心律转复除颤器和心脏再同步化治疗
植入型心律转复除颤器(ICD)可显著降低部分收缩性心力衰竭患者死亡率,如具备指征,无论心力衰竭病因为何,在指南中均推荐应用[16];但在注册研究UNOS中,放疗相关性心肌病患者中,40%接受ICD,INTERMACS研究中66%接受ICD[17]。在近期一个纳入272例患者的回顾性研究中,癌症伴有心力衰竭同时具备心脏再同步化治疗(CRT)指征的患者58%接受了CRT治疗[18]。Ajijola等[19]报道了4例药物难治性化疗相关性心肌病患者进行CRT治疗后,通过NYHA心功能分级、6分钟步行试验、明尼苏达心力衰竭问卷调查、LVEF和6个月后左室内径进行评估,均提示治疗获益。Rickard等[20]回顾性分析了进行CRT的18例化疗相关性心肌病患者和非缺血性心力衰竭患者,随访9个月后发现化疗相关性心肌病患者获益更明显,平均LVEF由19%升至27%,左室舒张末期内径由60 mm缩减到56 mm,二尖瓣反流程度由4.3减轻到3.1,NYHA心功能分级由2.9降至2.4。
目前临床中肿瘤合并心力衰竭患者ICD和CRT应用不足。且CRT在化疗相关性心肌病患者中治疗仍存在争议。因为化疗相关性心肌病在大型临床试验中比较少见,正在进行的MADIT-化疗相关性心肌病临床试验(Clinical Trials 注册号:NCT02164721)前瞻性地评估了接受CRT治疗的化疗相关性心肌病患者的疗效,将为CRT在这一人群中的应用提供依据。
3.3 原位心脏移植
虽然近年来药物治疗和器械支持治疗不断进步,但原位心脏移植(OHT)仍是终末期心力衰竭的最终治疗方法;但5年内活跃或近期发生的实体器官或血液恶性肿瘤是OHT的绝对禁忌证。且因其供体来源受限及排异反应已开展。目前OHT在肿瘤治疗相关心功能不全的治疗证据有限。
4 小结
总之,对于肿瘤心脏病学的研究重点在于早期防治,需在抗肿瘤治疗前进行心脏毒性危险因素的早期评估、评价风险与获益,并积极开展早期预防,“防”重于“治”。随着肿瘤精准治疗的不断推陈出新,越来越多的临床新兴问题亟待多学科的协作,共同探讨解决。在进行抗肿瘤治疗前需更好地进行个体化评估,加强早期预防和严格随访,制定系统化的诊疗规范,目前仍需大规模的临床试验提供更多的循证医学证据。肿瘤治疗相关心脏毒性的防治任重而道远!
[1] Oeffinger KC,Mertens AC,Sklar CA,et al.Chronic health conditions in adult survivors of childhood cancer[J].N Engl J Med,2006,355(15):1572-1582.
[2] Zamorano JL,Lancellotti P,Rodriguez MD,et al.2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines:The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC)[J].Eur Heart J,2016,37(36):2768-2801.
[3] Armstrong G,Plana J,Zhang N,et al.Screening adult survivors of childhood cancer for cardiomyopathy:comparison of echocardiography and cardiac magnetic resonance imaging[J].J Clin Oncol,2012,30(23):2876-2884.
[4] Thavendiranathan P,Poulin F,Lim KD,et al.Use of myocardial strain imaging by echocardiography for the early detection of cardiotoxicity in patients during and after cancer chemotherapy:a systematic review[J].J Am Coll Cardiol,2014,63(25):2751-2768.
[5] Jordan JH,D’Agostino RB Jr,Hamilton CA,et al.Longitudinal assessment of concurrent changes in left ventricular ejection fraction and left ventricular myocardial tissue characteristics after administration of cardiotoxic chemotherapies using T1-weighted and T2-weighted cardiovascular magnetic resonance[J].Circ Cardiovasc Imaging,2014,7(6):872-879.
[6] Portugal G,Moura Branco L,Galrinho A,et al.Global and regional patterns of longitudinal strain in screening for chemotherapy-induced cardiotoxicity[J].Rev Port Cardiol,2017,36(1):9-15.
[7] Ky B,Putt M,Sawaya H,et al.Early increases in multiple biomarkers predict subsequent cardiotoxicity in patients with breast cancer treated with doxorubicin,taxanes,and trastuzumab[J].J Am Coll Cardiol,2014,63(8):809-816.
[8] Mavinkurve-Groothuis AM,Marcus KA,Pourier M,et al.Myocardial 2D strain echocardiography and cardiac biomarkers in children during and shortly after anthracycline therapy for acute lymphoblastic leukaemia:a prospective study[J].Eur Heart J Cardiovasc Imaging,2013,14(6):562-569.
[9] Cardinale D,Sandri MT,Colombo A,et al.Prognostic value of troponin I in cardiac risk stratification of cancer patients undergoing high-dose chemotherapy[J].Circulation,2004,109(22):2749-2754.
[10] Curigliano G,Cardinale D,Dent S,et al.Cardiotoxicity of anticancer treatments:epidemiology,detection,and management[J].CA Cancer J Clin,2016,66(4):309-325.
[11] Cadeddu C,Piras A,Mantovani G,et al.Protective effects of the angiotensin Ⅱ receptor blocker telmisartan on epirubicin induced inflammation,oxidative stress,and early ventricular impairment[J].Am Heart J,2010,160(3):487.e1-e7.
[12] Lipschultz SE,Scully RE,Lipsitz SR,et al.Assessment of dexrazoxane as a cardioprotectant in doxorubicin-treated children with high-risk acute lymphoblastic leukaemia:long-term follow-up of a prospective,randomized,multicentre trial[J].Lancet Oncol,2010,11(10):950-961.
[13] Kalay N,Basar E,Ozdogru I,et al.Protective effects of carvedilol against anthracycline-induced cardiomyopathy[J].J Am Coll Cardiol,2006,48(11):2258-2262.
[14] Kaya MG,Ozkan M,Gunebakmaz O,et al.Protective effects of nebivolol against anthracycline-induced cardiomyopathy:a randomized control study[J].Int J Cardiol,2013,167(5):2306-2310.
[15] Kalam K,Marwick TH.Role of cardioprotective therapy for prevention of cardiotoxicity with chemotherapy:a systematic review and meta-analysis[J].Eur J Cancer,2013,49(13):2900-2909.
[16] Russo AM,Stainback RF,Bailey SR,et al.ACCF/HRS/AHA/ASE/HFSA/SCAI/SCCT/SCMR 2013 appropriate use criteria for implantable cardioverter-defibrillators and cardiac resynchronization therapy:a report of the American College of Cardiology Foundation appropriate use criteria task force,Heart Rhythm Society,American Heart Association,American Society of Echocardiography,Heart Failure Society of America,Society for Cardiovascular Angiography and Interventions,Society of Cardiovascular Computed Tomography,and Society for Cardiovascular Magnetic Resonance[J].Heart Rhythm,2013,10(14):e11-58.
[17] Bianco CM,Al-Kindi SG,Oliveira GH.Advanced Heart Failurer Therapies for Cancer Therapeutics Related Cardiac Dysfunction[J].Heart Failure Clin,2017,13(2):327-336.
[18] Fadol AP,Mouhayar E,Fellman B,et al.The use of cardiac resynchronization therapy in cancer patients with heart failure:preliminary findings in a comprehensive cancer center[J].J Card Fail,2016,22:S57.
[19] Ajijola OA,Nandigam KV,Chabner BA,et al.Usefulness of cardiac resynchronization therapy in the management of doxorubicin-induced cardiomyopathy[J].Am J Cardiol,2008,101(9):1371-1372.
[20] Rickard J,Kumbhani DJ,Baranowski B,et al.Usefulness of cardiac resynchronization therapy in patients with adriamycin-induced cardiomyopathy[J].Am J Cardiol,2010,105(4):522-526.

