五种弹性配准方法在放射治疗CT图像配准中的应用比较
庞皓文 孙小杨 杨 波
在临床放射治疗过程中,由于患者体重变化、肿瘤退缩以及危及器官分次状态不同,导致肿瘤靶区与危及器官吸收剂量与初始放射治疗计划产生较大不同,通过重新扫描CT图像以及重新制作放射治疗计划,减少上述变化带来的影响,并监测放射治疗过程中肿瘤与危及器官的变化,以及带来的剂量影响,而实现患者的自适应放射治疗是肿瘤放射治疗研究的热点[1-5]。
弹性配准算法通过比较不同分次放射治疗时患者CT图像,了解肿瘤与危机器官的形变过程,进一步计算出放射治疗全过程中肿瘤与危机器官的累加剂量,是自适应放射治疗的理论基础,同时加入时间因素的四维放射治疗也建立在弹性配准基础上[6-7]。Mencarelli等[8]和Francisco等[9]通过研究形变配准算法模型模拟肿瘤与危及器官在放射治疗过程中变化的不确定性,探索了弹性配准在放射治疗中的应用,而在放射治疗中应用弹性配准算法,需要建立准确、快速与自动的软件平台。为此,本研究通过自主编程的软件平台,对Horn-Schunck光流法、Demons算法、加速Demons算法、水平集算法以及快速自由形变算法5种常见的弹性配准方法在盆腔放射治疗患者CT图像中的配准精度进行比较。
1 CT图像配准设备与方法
1.1 设备与原理
(1)设备。使用LightSpeed Plus 4型CT(美国GE公司)。
(2)原理。5种常见的弹性配准方法有Horn-Schunck光流法[10]、Demons算法[11]、加速Demons算法[12]、水平集算法[13]以及快速自由形变算法[14]。
设定两组图像,一组为待配准图像灰度值为M(v);一组为参考图像灰度值为S(v),v为三维空间的方向。弹性配准是通过找出待配准图像形变为参考图像合适的位移场u(v),使得其灰度值从M(v)改变为M(v-u)后,与参考图像的灰度值S(v)类似,用于测量相似度的函数计算为公式1:
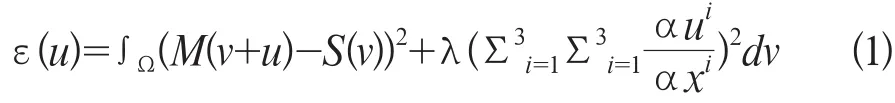
图像弹性形变的过程是搜寻位移场u(v)的过程,不同的弹性配准方法u(v)的取值各有差异。
1.2 Horn-Schunck光流法
Horn-Schunck光流算法u(v)实现迭代为公式2:
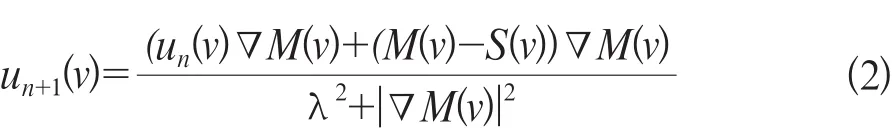
式中u为邻域均值;λ为权重值;n为迭代次数。
1.3 Demons算法
Demons算法u(v)实现迭代为公式3:
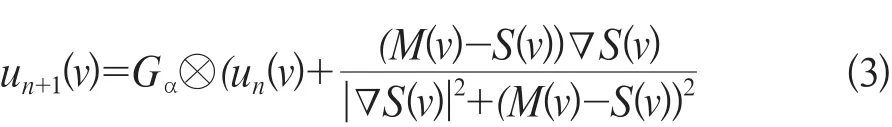
式中Gσ为高斯低通滤波函数,窗宽为σ;n为迭代次数。
1.4 加速Demons算法
加速Demons算法u(v)实现迭代为公式4:
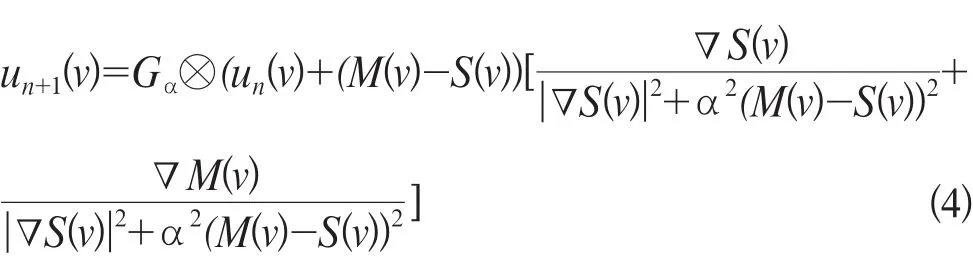
式中Gσ同Demons算法;n为迭代次数。
1.5 水平集算法
水平集算法u(v)实现迭代为公式5:
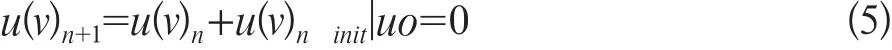
式中u(v)ninit=(M(v)-S(v)),Gσ同Demons算法,n为迭代次数。
1.6 快速自由形变算法
快速自由形变算法u(v)实现迭代为公式6:

式中Lm,n= λΔ2(um,n)-[M(vm+um)-S(vm)]gm,n(vm+um),g(v)=ΔM(v), n为迭代次数。
1.7 弹性配准迭代步骤
(1)初始时,n=0,u(v)0=0。
(2)设n=n+1,选取公式(2~6)中一种对位移场u(v)n+1实现迭代,待配准图像迭代为Mn(v-u(v)n+1)。
(3)判别迭代次数小于预设值,转为迭代停止[步骤(4)],否则转为步骤(2)。
(4)迭代停止,Mn(v-u(v)n+1)为最后待配准图像,弹性配准中选用多分辨策略。
2 CT图像配准结果
2.1 试验对比参数
使用Matlab 2016 a软件,根据上述5种常见的弹性配准算法原理,编写具有完全知识产权代码的弹性配准程序,并对10例行盆腔放射治疗患者的定位时与放射治疗中两组CT图像执行弹性配准。其中放射治疗定位时CT图像为参考图像、放射治疗中CT图像为待配准图像,比较五种常见的弹性配准方法的配准精度。硬件为英特尔酷睿i5-3210 M CPU,2.5 GHz,4 G内存。10例行盆腔放射治疗患者CT断层图像分辨率为512×512,层厚为5 mm。10例患者均方误差(mean squared error,MSE)、平均相关系数(correlation coefficient,CC)及平均配准用时见表1。
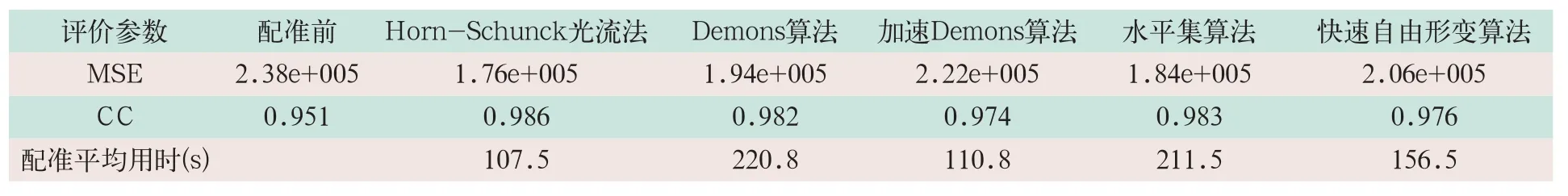
表1 五种算法评价参数及用时
2.2 平均MSE
Horn-Schunck光流法平均MSE减少26.0%,Demons算法平均MSE减少18.5%,快速Demons算法平均MSE减少6.7%,水平集算法平均MSE减少22.7%,快速自由形变算法平均MSE减少13.4%。
2.3 平均CC
Horn-Schunck光流法平均CC提高3.7%,Demons算法平均CC提高3.3%,快速Demons算法平均CC提高2.4%,水平集算法平均CC提高3.4%,快速自由形变算法平均CC提高2.6%;均配准时间为107.5~220.8 s。
2.4 配准后的CT冠状面差分图
为了更全面了解配准前后放射治疗CT图像的差别,选取本研究中第5例盆腔放射治疗患者为例,其基于5种常用的弹性配准算法配准后的CT冠状面差分图如图1所示。
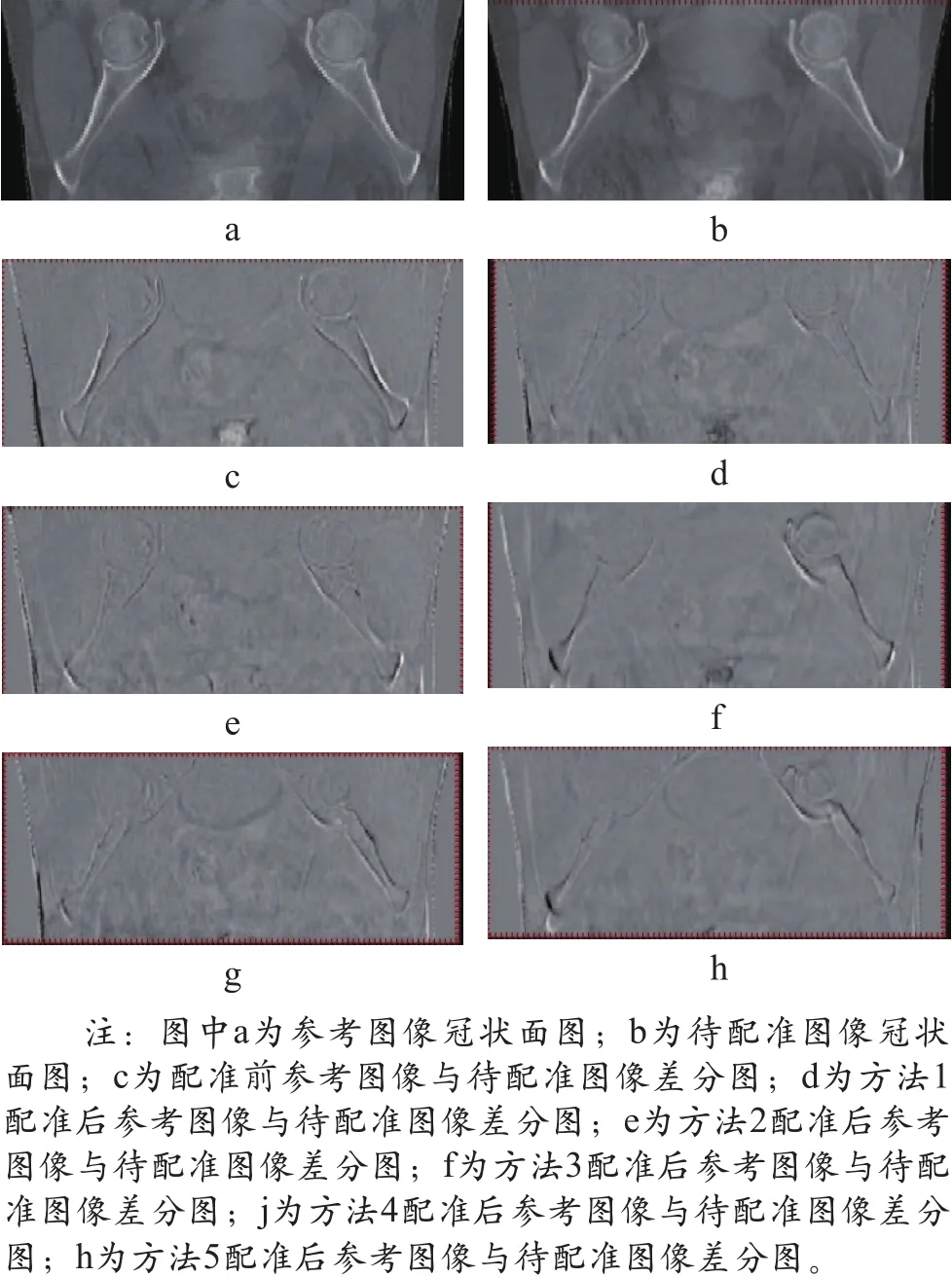
图1 五种常用弹性配准算法配准后的CT冠状面差分图
3 结论
评价参数表明,本研究中的5种常用的弹性配准算法均取得了较好的配准结果,其中Horn-Schunck光流法平均MSE减少26.0%、CC提高3.7%,其配准平均耗时也最少,因此推荐使用Horn-Schunck光流法对放射治疗CT图像进行配准。全部放射治疗过程中肿瘤及危及器官持续变化,将弹性配准方法应用于放射治疗图像配准中,可进一步了解肿瘤及危及器官的变化带来的剂量学变化。但现阶段的弹性配准理论并不能真实模拟肿瘤及危及器官的实际变化,故下一步研究拟开发出应用于放射治疗的具有自主知识产权和代码的医学图像弹性配准软件平台,通过在肿瘤或危及器官中植入标记点的方法,总结最真实模拟各个肿瘤及危及器官的变化模型,并将其转化为适合各个肿瘤及危及器官个体化的弹性配准数学模型,进一步提高配准精度,对放射治疗中肿瘤及危及器官的变化进行评估,实现放射治疗全程中肿瘤及危及器官的个体化剂量监测[15-18]。
[1]Yan D,Jaffray DA,Wong JW.A model to accumulate fractionated dose in a deforming organ[J].Int J Radiat Oncol Biol Phys,1999,44(3):665-675.
[2]Noel CE,Santanam L,Olsen JR,et al.An automated method for adaptive radiation therapy for prostate cancer patients using continuous fiducial-based tracking[J].Phys Med Biol,2010,55(1):65-82.
[3]Qi XS,Santhanam A,Neylon J,et al.Near Real-Time Assessment of Anatomic and Dosimetric Variations for Head and Neck Radiation Therapy via Graphics Processing Unit-based Dose Deformation Framework[J].Int J Radiat Oncol Biol Phys,2015,92(2):415-422.
[4]Swaminath A,Massey C,Brierley JD,et al.Accumulated Delivered Dose Response of Stereotactic Body Radiation Therapy for Liver Metastases[J].Int J Radiat Oncol Biol Phys,2015,93(3):639-648.
[5]Teo BK,Bonner Millar LP,Ding X,et al.Assessment of cumulative external beam and intracavitary brachytherapy organ doses in gynecologic cancers using deformable dose summation[J].Radiother Oncol,2015,115(2):195-202.[6]Velec M,Moseley JL,Craig T,et al.Accumulated dose in liver stereotactic body radiotherapy:positioning,breathing,and deformation effects[J].Int J Radiat Oncol Biol Phys,2012,83(4):1132-1140.
[7]Chan MK,Kwong DL,Ng SC,et al.Experimental evaluations of the accuracy of 3D and 4D planning in robotic tracking stereotactic body radiotherapy for lung cancers[J].Med Phys,2013,40(4):041712.
[8]Mencarelli A,van Kranen SR,Hamming-Vrieze O,et al.Deformable image registration for adaptive radiation therapy of head and neck cancer:accuracy and precision in the presence of tumor changes[J].Int J Radiat Oncol Biol Phys,2014,90(3):680-687.
[9]Salguero FJ,Saleh-Sayah NK,Yan C,et al.Estimation of three dimensional intrinsic dosimetric uncertainties resulting from using deformable image registration for dose mappi ng[J].Med Phys,2011,38(1):343-353.
[10]Horn B,Schunck B.Determining optic flow[J].International Journal of Artificial Intelligen ce,1981,17(2):185-203.
[11]Thirion JP.Image matching as a diffusion process: an analogy with Maxwell's demons[J].Med Image Anal,1998,2(3):243-260.
[12]Wang H,Dong L,O'Daniel J,et al.Validation of an accelerated'demons' algorithm for deformable image registration in radiation therapy[J].Phys Med Biol,2005,50(12):2887-2905.
[13]Vemuri BC,Ye J,Chen Y,et al.Image registration via level-set motion:applications to atlas-based segmentation[J].Med Image Anal,2003,7(1):1-20.
[14]Lu W,Chen ML,Olivera GH,et al.Fast free-form deformable registration via calculus of variations[J].Phys Med Biol,2004,49(14):3067-3087.
[15]Jin P,van der Horst A,de Jong R,et al.Markerbased quantification of interfractional tumor position variation and the use of markers for setup verification in radiation therapy for esophageal cancer[J].Radiother Oncol,2015,117(3):412-418.
[16]Bolton WD,Richey J,Ben-Or S,et al.Electromagnetic Navigational Bronchoscopy:A Safe and Effective Method for Fiducial Marker Placement in Lung Cancer Patients[J].Am Surg.2015,81(7):659-662.
[17]Langerak T,Mens JW,Quint S,et al.Cervix motion in 50 cervical cancer patients assessed by daily cone beam computed tomographic imaging of a new type of marker[J].Int J Radiat Oncol Biol Phys,2015,93(3):532-539.
[18]Takao S,Miyamoto N,Matsuura T,et al.Intrafractional baseline shift or drift of lung tumor motion during gated radiation therapy with a real-time tumor-tracking system[J].Int J Radiat Oncol Biol Phys,2016,94(1):172-180.

