毛蚶对石油烃的生物富集与释放规律研究
李永仁,张 超,梁 健,郭永军
(天津农学院 水产科学系 天津市水产生态及养殖重点实验室,天津 300384)
随着海洋航运、海上石油开采的迅速发展以及陆源污染物向海洋中排放,滩涂及近岸海域石油污染日趋严重,影响海洋生物的繁殖和生长,破坏近岸海域生态平衡[1],并对海产双壳类等海洋经济动物的食用安全产生显著的负面影响。因此,对贝类的石油烃监测和评价广泛开展[2-8]:蔡玉婷等[2]的研究表明,相同环境下主要海产经济动物的石油烃含量为:贝类>甲壳类>鱼类;马继臻等[3]评价了东海沿岸6种经济贝类的石油烃含量:褶牡蛎(Crassostreaplicatula)>毛蚶(Scapharcasubcrenata)>四角蛤蜊(Mactraveneriformis)>文蛤(Meretrixmeretrix)>紫贻贝(Mytilusedulis)>泥蚶(Arcaganosa)。
因此,对比其他海水经济动物,毛蚶等海产双壳类较易富集石油烃,且影响了其经济价值与食用安全,但针对双壳类的石油烃富集规律的相关研究较少,主要集中在菲律宾蛤仔(Ruditapesphilippinarum)与紫贻贝:薛秋红等[9]测定了紫贻贝对石油烃的生物富集动力学参数,高萍等[10]研究了菲律宾蛤仔对石油烃的富集与释放特征,确定了生物富集系数、吸收速率、释放速率、排出率等基本参数,姜朝军等[11]研究了菲律宾蛤仔对石油烃的富集规律,并以此探讨养殖水体的石油安全限量。以上研究采用的研究方法主要为接触染毒法,该法操作简单,试验结果稳定可靠,是研究水产动物对重金属、石油烃等有害物质响应规律的常用方法。
毛蚶是我国重要的海产经济贝类,分布范围北起鸭绿江,南至广西,莱州湾、渤海湾、辽东湾等浅水区资源尤为丰富[12],生活在内湾浅海低潮线下至水深十多米的泥砂中,易受石油污染[3],但尚无对蚶科动物富集石油烃的相关报道。本研究采用接触染毒法探讨毛蚶对大港原油的富集和释放特征,旨在为毛蚶的净化处理以及海洋石油类污染的生态风险评价提供参考。
1 材料与方法
1.1 试验材料
试验海水取自天津高沙岭东部海域,经沉淀、砂滤及孔径0.45 μm纤维膜过滤,盐度30.2,pH 8.12±0.02,温度(10.0±0.2) ℃。试验用大港原油采自大港油田独流减河北侧采油点。三角瓶中加入海水5 L及大港原油50 g,磁力搅拌器搅拌24 h,静置4 h,虹吸下层溶液作为石油类母液,棕色瓶中储存待用。
试验用毛蚶于2016年12月初采自天津市大神堂南部海域,洗净后置于250 cm×150 cm×100 cm的敞口玻璃钢箱中,箱中注满海水,连续充气,每日半换水一次。投喂小球藻(Chlorellavulgaris)2.0×106个/mL及新月菱形藻(Cylindrothecaclosterium)1.0×106个/mL,每日2次。暂养18 d后,选择规格均一,活力良好的毛蚶作为试验对象,壳长(31.1±1.2) mm。
1.2 接触染毒试验
取规格70 cm×46 cm×40 cm蓝色敞口塑料箱6个,分别加入80 L海水,向处理组加入石油类母液,使海水石油类含量分别达到0.1、0.2、0.4、0.8、1.6、3.2 mg/kg。各箱内分别放入毛蚶50只,用密封膜迅速封闭箱口,减少石油类挥发,每24 h更换等石油类含量的海水。投喂经离心净化的小球藻2.0×106个/mL及新月菱形藻1.0×106个/mL,每日2次。及时捡出死亡毛蚶,不再补充。第0 d、10 d,每箱随机取毛蚶10只,海水100 mL。
石油烃释放阶段,将每箱中剩余毛蚶吊养于250 cm×150 cm×100 cm的敞口玻璃钢水槽中,充气、换水、投喂等操作与上一步相同,释放10 d后,每组随机取毛蚶10只。
试验设3个平行。
1.3 取样及测定
采用荧光分光光度法测定海水和毛蚶的石油烃含量,操作方法依照《海洋监测规范》GB 7378—2007进行[13-14]。
1.4 数据处理
数据以SPSS22.0对组间石油烃含量进行方差分析,多重比较差异显著性(显著水平P<0.5)。
生物富集系数= 毛蚶石油烃含量/海水石油类浓度。
吸收速率= 富集后毛蚶石油烃含量/富集时间(d) 。
释放速率=(富集后毛蚶石油烃含量-释放后毛蚶石油烃含量)/释放时间(d)。
2 试验结果
2.1 石油烃的富集与释放
样本的石油烃含量见图1,毛蚶石油烃含量与海水石油类含量呈正相关,海水石油类含量在0.4 mg/kg以下时,毛蚶石油烃含量随海水石油类含量的提高而迅速升高,各组差异极显著(P<0.1);在海水石油类含量由0.8 mg/kg升至3.2 mg/kg,毛蚶石油烃含量升高减缓,其中,海水石油类含量为0.8 mg/kg与1.6 mg/kg的两组毛蚶石油烃含量差异不显著(P>0.5)。在海水中处理10 d后,各组毛蚶的石油烃含量均低于20 mg/kg,与富集阶段的海水石油类含量呈正相关,组间差异减小,其中,0.2 mg/kg、0.4 mg/kg与0.8 mg/kg海水含量组毛蚶的石油烃含量差异不显著(P>0.5)。
2.2 毛蚶对石油烃的吸收速率、释放速率以及生物富集系数
毛蚶对石油烃的吸收速率与海水石油类含量的对数呈线性正相关(图2),回归曲线为y=14.37+3.294logx(r2=0.9766)。毛蚶对石油烃的释放速率与富集阶段海水石油类含量的对数亦呈线性正相关,回归曲线为y=12.86+3.139logx(r2=0.9734)。

图1 毛蚶生物体石油烃的累积和释放
毛蚶对石油烃的生物富集系数与海水石油类含量的回归曲线为y=14.37+3.294logx(r2=0.9861)(图3),随水体石油类含量升高,毛蚶对石油烃的生物富集系数减小,且水体石油类含量越高,生物富集系数的减小越缓慢。
3 讨 论
3.1 毛蚶对石油烃的富集与释放
本研究中,毛蚶石油烃含量最高达180 mg/kg,在相同的环境石油类含量下,菲律宾蛤仔石油烃含量未超120 mg/kg[10],紫贻贝在石油类含量1.15 mg/kg的海水中,石油烃累积含量达到500 mg/kg以上[9],毛蚶对石油烃的吸收速率以及平衡时的石油烃含量均高于菲律宾蛤仔而低于紫贻贝。李厦等[15]的研究表明,天津近岸海域的毛蚶受石油烃的污染程度高于扁玉螺(Neveritadidyma)、短蛸(Octopusochellatus)等其他受试种类。说明在环境水体受石油类污染后,毛蚶作为食品对消费者健康的危害可能低于紫贻贝而高于菲律宾蛤仔等大多数贝类。
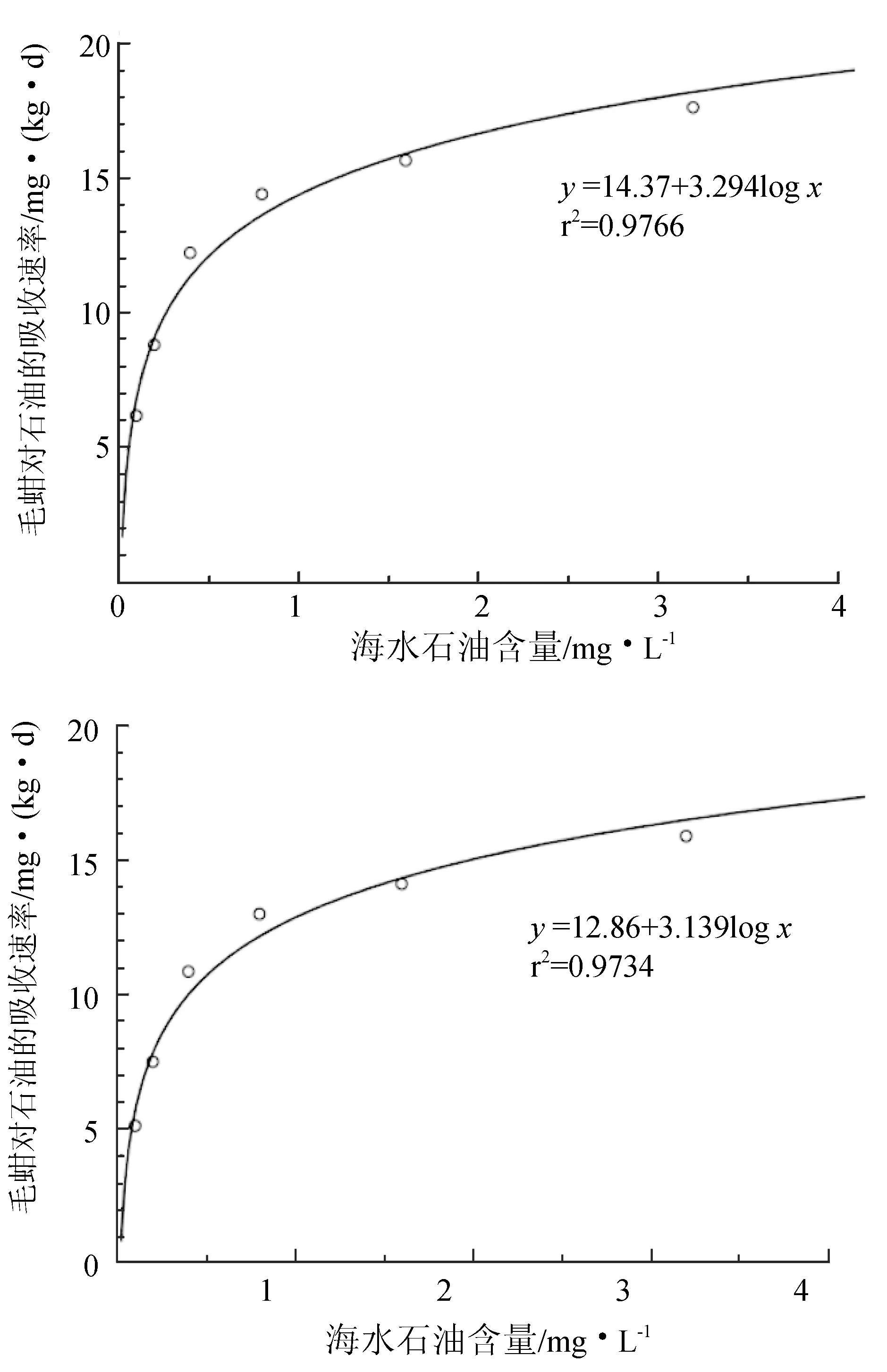
图2 毛蚶软体石油烃积累速率与释放速率
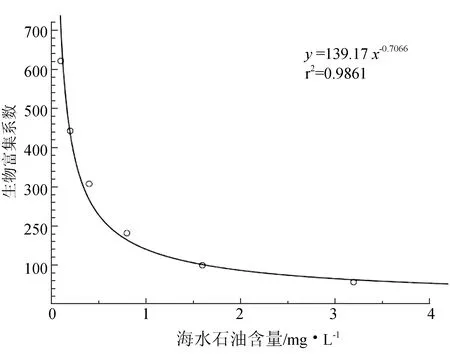
图3 毛蚶软体生物富集系数与水体石油烃的关系
菲律宾蛤仔对大港原油的生物富集系数为30.61~231.2[10],紫贻贝对大港原油的生物富集系数为737[9],本试验中毛蚶对大港原油的生物富集系数为55.15~618.5,说明毛蚶对石油烃的富集能力强于菲律宾蛤仔,弱于紫贻贝。这可能与几种贝类的生态位差异有关,紫贻贝与毛蚶生活于底质表面及浅层,直接利用鳃滤食,菲律宾蛤仔生活于底质深层,以水管吸入海水进行摄食[16],在较高的石油类含量下,可通过入水管调节滤水量,从而降低石油烃在体内的累积。
已有研究表明,石油烃对毛蚶的24、48、72、96 h半致死含量分别是6.863、5.129、2.965、1.914 mg/kg,试验水温为20~22 ℃[17],但在本研究中,3.2 mg/kg石油类含量下毛蚶的死亡率升高,但10 d内各组死亡率均低于20%,本试验在冬季开展,水温10 ℃。表明低温显著提高了毛蚶对石油类污染的耐受力。
3.2 石油烃与毛蚶品质
依照我国海洋生物质量评价标准(GB 18421—2001)对贝类石油烃含量的规定[18],在不同环境石油类含量下,毛蚶石油烃含量的质量分析见表1。
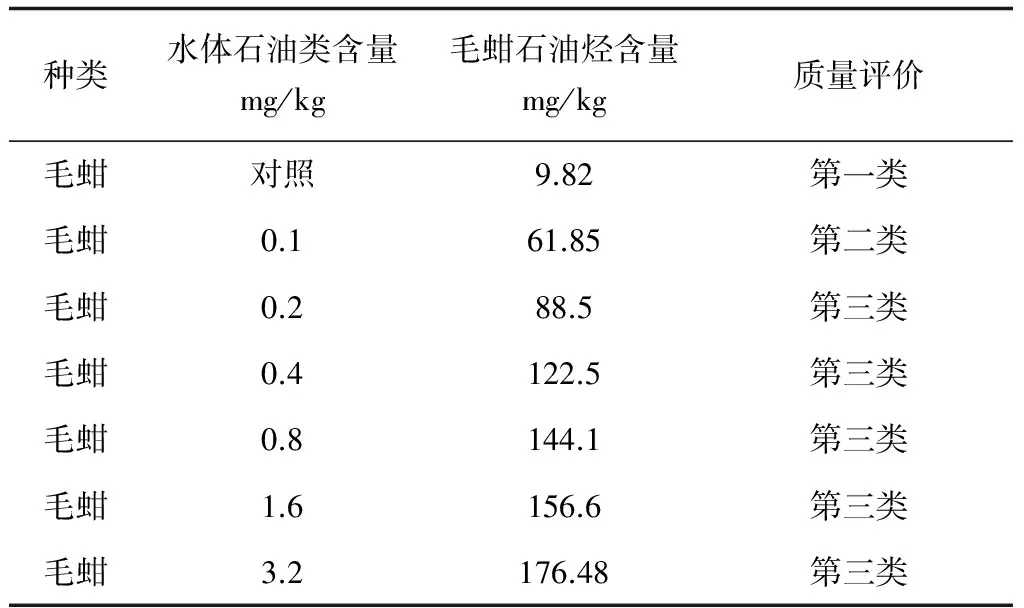
表1 不同环境石油类含量下的毛蚶石油烃含量分析
本试验中,对照组用水为自然海水,测定石油类含量为0.02 mg/kg,对应毛蚶石油烃含量为9.82 mg/kg,符合我国一类海洋生物质量标准,而当水体石油类含量达到0.1 mg/kg时,对应毛蚶石油烃含量为61.85 mg/kg,达到第二类海洋生物质量标准,当水体石油类含量超过0.2 mg/kg时,毛蚶富集石油烃的平衡含量均超过第三类海洋生物质量标准。另有研究表明,当毛蚶所含石油烃超过25~30 mg/kg,食用毛蚶可感知石油异味[15],因此,当环境水体石油类含量较高时,毛蚶石油烃含量将超过石油异味阈值,消费者从味觉上难接受,经济价值降低。
本试验中,在水体石油类含量0.8 mg/kg以下富集石油烃的毛蚶,经10 d的释放,其石油烃含量均符合海洋生物质量第一类标准;而在石油类含量1.6~3.2 mg/kg的水体中富集石油烃的毛蚶,经10 d的释放,石油烃含量仍超海洋生物质量第一类标准,但低于石油异味阈值。这表明:在受石油类污染的海域,毛蚶的石油烃含量升高,品质下降,但在清洁海水中毛蚶进行净化处理,可有效降低其石油烃含量,提高经济价值。
[1] Axiak V,George J,Moore M.Petroleum hydrocarbon in the marine bivalveVenusverrucosaaccumulation and cellular responses[J].Marine Biology,1998,97(3):225-230.
[2] 蔡玉婷,许贻斌,吴立峰.海洋养殖生物体中石油烃含量分布及变化情况研究[J].福建水产,2008(3):40-43.
[3] 马继臻,袁骐,蒋玫,等.东海沿岸不同区域贝类体内石油烃含量的分布特征及其评价[J].海洋通报,2008,27(2):73-78.
[4] 甘居利,林钦,蔡文贵,等.广东沿海近江牡蛎氯代烃和石油烃含量分布与变化趋势[J].热带海洋学报,2006,25(1):47-50.
[5] 郑燕,蔡雷鸣.福州主要海水贝类养殖区菲律宾蛤仔污染状况调查[J].福建水产,2009(4):62-66.
[6] 阮金山,罗冬莲,许翠娅,等.泥洲湾牡蛎体重金属和石油烃的含量及评价[J].福建水产,2001(4):1-6.
[7] 贾晓平,林钦,吕晓瑜.珠江口沙井水域及牡蛎体中石油烃的含量、组成及其变化特点[J].中国水产科学,1994,1(1):48-54.
[8] Boehm P,Quinn J.The persistence of chronically accumulated hydrocarbons in the hard shell clamMercenariamercenaria[J].Marine Biology,1977,44(3):227-233.
[9] 薛秋红,孙耀,王修林,等.紫贻贝对石油烃的生物富集动力学参数的测定[J].海洋水产研究,2001,22(1):32-36.
[10] 高萍,夏斌,崔毅.菲律宾蛤仔对石油烃的富集与释放特征[J].海洋环境科学,2013,32(1):63-66.
[11] 姜朝军,乔庆林,蔡友琼,等.菲律宾蛤仔对石油烃的污染动力学和阈值研究[J].海洋渔业,2006,28(4):314-320.
[12] 陈蓉,刘建勇,唐连俊,等.中国5个海区不同群体毛蚶形态差异分析[J].海洋科学,2009,33(7):64-68.
[13] 国家海洋局.GB 17378.4,海洋监测规范 第4部分:海水分析[S].2007.
[14] 国家海洋局.GB 17378.6,海洋监测规范 第 6 部分:生物体分析[S].2007.
[15] 李厦,刘宪斌,田胜艳.天津大港近岸海域生物体内重金属、石油烃含量及其安全风险评价[J].安全与环境学报,2013,13 (3) :157-160.
[16] 张国范,闫喜武.蛤仔养殖学[M].北京:科学出版社,2010.
[17] 陈建华,阎斌伦,李盈蕾,等.石油烃和镉对毛蚶的急性毒性与联合毒性效应研究[J].水生态学杂志,2010,03(3):85-89.
[18] 国家海洋局.GB 18421,海洋生物质量[S].2001.

