牛支原体、牛病毒性腹泻病毒和牛传染性鼻气管炎病毒三重二温式PCR检测方法的建立及应用
范 晴,谢芝勋,谢志勤,谢丽基,黄 莉,黄娇玲,张艳芳,曾婷婷,王 盛,罗思思,邓显文,刘加波,庞耀珊
(广西兽医研究所/广西兽医生物技术重点实验室,广西南宁 530001)
牛支原体(Mycoplasmabovis,MB)、牛病毒性腹泻病毒(Bovine viral diarrhea,BVDV)和牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV)是牛呼吸综合征(Bovine respiratory disease complex,BRD)常见的3种主要病原,由此引起的传染病是危害养牛业最为严重的疾病,制约着全球养牛业的发展[1]。牛支原体属支原体科、支原体属,可引起犊牛肺炎、乳腺炎、角膜炎和关节炎,以引起呼吸系统疾病最为多见。MB通常存在于牛的呼吸道和生殖道中,当牛因环境变化或其他应激因素导致免疫力低下时容易引起感染发病,还伴有多种细菌和病毒的混合感染,可引起牛呼吸系统疾病及乳腺疾病[2]。BVDV被认为是一种牛的“呼吸道病毒”,可从牛的下呼吸道和感染牛的肺泡巨噬细胞中分离到该报道。BVDV可引起机体的免疫抑制,使感染牛继发细菌性或病毒性肺炎。一些BVDV毒株(1a和1b,生物非细胞致病基因)常能从牛肺中分离到,且常与呼吸道疾病发生有关,2型的病毒会导致犊牛出现严重的间质性肺炎,血小板减少,骨髓坏死和腹泻,且持续感染BVDV的犊牛或母牛一旦发病会迅速形成细菌性肺炎[3]。牛传染性鼻气管炎是由牛Ⅰ型疱疹病毒(IBRV)引起的上呼吸道和气管的传染病。像很多其他疱疹病毒一样,以前被感染过的牛,常伴有隐性感染,当遇到传染性疾病时,运输或皮质类固醇的应激时IBRV便可复发,常继发细菌性支气管肺炎,或同时感染BVDV,可出现灾难性的死亡[4-5]。3种病原体均能引起牛呼吸道疾病,临床症状相似,难以区分,且常以混合感染形式存在,感染后都会引起严重的经济损失[6-7]。因此,急需建立牛支原体、牛病毒性腹泻病毒和牛传染性鼻气管炎病毒的快速检测技术,为我国MB、BVDV和IBRV的防控提供技术支持。
目前对这3种牛病原体的检测方法主要有病毒分离、ELISA、血清中和试验及PCR等方法[8]。其中PCR方法因操作简便、快速、特异性强、敏感性高等特点,已广泛应用于牛病病原微生物的检测和诊断。多重PCR是一种高效的PCR,可在同一个PCR反应管内,同时鉴别检测多种病原体,在多种病原混合感染的鉴别诊断上具有优势和临床实用价值。二温式PCR是在常规PCR基础上发展而成的更简便的PCR检测技术,二温式PCR将退火和延伸在同一温度下完成,退火温度比常规三温式PCR的高,因此不仅提高了PCR的特异性,且二温式PCR省略了反复升温降温的时间消耗,节省时间,提高疾病的诊断效率[9-10]。本研究综合两种PCR,建立了同时检测MB、BVDV和IBRV三重二温式PCR方法,大大缩短反应时间,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 菌株及毒株 3株牛病毒性腹泻病毒参考毒株(Oregon CV24、NADL、AV68)、1株牛传染性鼻气管炎病毒(AV20),购自中国兽药监察所;14株BVDV广西分离株、3株牛支原体广西分离株(GL-1、BS-1、NN-1)株,广西兽医研究所分离保存;其他牛源对照病原体包括口蹄疫病毒(Foot-and-mouth-disease virus,FMDV)、水疱性口炎病毒(Vesicular stomatitis virus,VSV)、蓝舌病病毒(Bluetongue virus,BTV)、牛轮状病毒(Bovine rotavirus,BRV)、小反刍兽疫病毒(Peste des petits ruminants virus,PPRV),来源见表1。
1.1.2 试剂和设备 RNA/DNA共提试剂盒、pEASY-T1载体、质粒小量提取试剂盒Plasmid miniprep kit,全式金公司产品;限制性内切酶SpeⅠ、DNase、PCR试剂(AMV、TaqPolymerase、MgCl2、dNTP等),宝生物工程(大连)有限公司产品;T7体外转录试剂盒RiboMAXTMlarge-scale RNA production systerm-T7 kit,Promega公司产品;NanoDrop 2000核酸测定仪,美国Thermo Fisher Scientific公司产品;Tprofessional thermocycler PCR仪,美国Iometra公司产品。
1.2 方法
1.2.1 引物设计 根据GenBank数据库中已有的各病原体的保守区基因序列,即MB的Uvrc基因、BVDV的5′-UTR、IBRV的GB基因,利用生物软件DNA Star MegAlign 1.0和primer5.0设计特异性检测引物,通过NCBI核酸数据库进行同源性比对验证,获得的引物如表2[11-13]。引物全部由上海Invitrogen公司合成,稀释成25 nmol/L, 置-20℃备用。
1.2.2 三重二温式PCR的条件优化 参照全式金RNA/DNA共提试剂盒说明书,抽提毒株和菌体的RNA/DNA模板。
根据引物Tm值,将退火延伸温度按55℃~68℃依次递增,多次重复确定最佳退火延伸温度。

表1 毒株和菌株来源
注:GVRI.广西兽医研究所;YNCIQ.云南出入境检疫检测局;CVCC.中国兽药监察所。
Note:GVRI.Guangxi Veterinary Research Institute;YNCIQ.Yunnan Entry-Exit Inspection and Quarantine Bureau;CVCC.Chinese Veterinary Culture Collection Center.
采用25 μL反应体系,对如下条件进行优化:AMV(1 U~5 U)、MgCl2(1 mmol/L~10 mmol/L)、TaqPolymerase(1 U~5 U)、dNTP(0.1 mmol/L~0.8 mmol/L)、引物(1 pmol/μL~10 pmol/μL)。每次检测时,设置阳性对照(MB/GL-1支原体培养液)和阴性对照(健康牛血液样本抽提的全基因组DNA)。在阴性对照和阳性对照均成立时,整个试验有效,可判定结果。
1.2.3 特异性试验 使用下列毒株验证三重二温式PCR的特异性:3株MB广西分离株,3株BVDV参考毒株,13株BVDV 1型广西分离株,1株BVDV 2型广西分离株,3种口蹄疫病毒灭活病毒(A、O和Asia 1型),6种蓝舌病病毒灭活病毒(4、8、9、15、17、18型),2种水疱性口炎灭活病毒(NJ型、ND型),2株牛轮状病毒参考毒株,1株小反刍兽疫病毒,1株牛传染性鼻气管炎病毒,各毒株详情见表1。参照全式金RNA/DNA共提试剂盒说明书,抽提上述病原体核酸,1 μL作为模板进行反应,反应体系和反应条件见1.2.2。
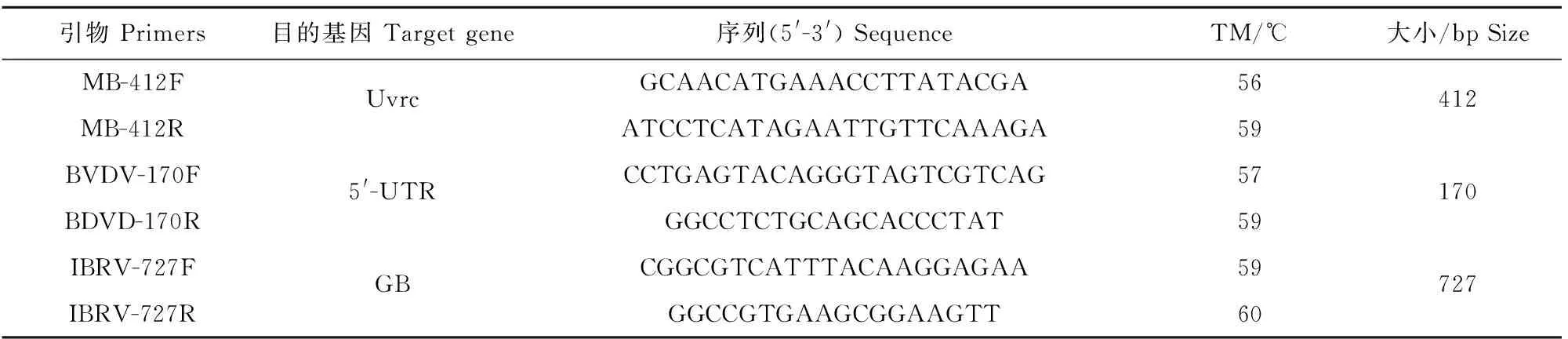
表2 引物信息
1.2.4 敏感性试验 用表2引物分别扩增MB、BVDV和IBRV的基因组,将PCR产物进行纯化,克隆到pEASY-T1 载体,提取阳性重组菌的质粒。BVDV、IBRV重组质粒用限制性内切酶SpeⅠ将重组质粒线性化,参照T7体外转录试剂盒(RiboMAXTMlarge-scale RNA production systerm-T7 kit)说明书,将线性化DNA体外转录为RNA,之后用DNase处理体外转录的RNA,消除其中的DNA污染,利用NanoD rop 2000测定体外转录RNA的浓度,MB重组质粒直接测定DNA浓度,根据阿弗加德罗常数将浓度转换为拷贝数[14]。用双蒸水将已知拷贝数的RNA/DNA进行10倍梯度稀释,稀释成1×108~1拷贝/μL,并将等浓度的3种体外转录RNA/DNA等体积混合,制备成标准品。每个标准品取1 μL为模板,用优化好的三重二温式PCR检测,测定其敏感性。
1.2.5 干扰性试验 为了测试不同模板之间浓度差异较大时,高浓度模板对低浓度的模板扩增是否存在抑制作用,是否仍能敏感的检测到低浓度的模板,使用不同浓度的核酸组合为模板进行三重式二温PCR。制备7组不同模板浓度的模拟混合感染样品:样品A:MB (105拷贝/μL)+BVDV(107拷贝/μL)+IBRV(106拷贝/μL);样品B:MB(105拷贝/μL)+BVDV(108拷贝/μL)+IBRV(104拷贝/μL);样品C:MB(108拷贝/μL)+BVDV(104拷贝/μL)+IBRV(106拷贝/μL);样品D:MB(107拷贝/μL)+BVDV(106拷贝/μL)+IBRV(105拷贝/μL);样品E:MB(104拷贝/μL)+BVDV(106拷贝/μL)+IBRV(108拷贝/μL);样品F:MB(107拷贝/μL)+BVDV(104拷贝/μL)+IBRV(104拷贝/μL);样品G:MB(106拷贝/μL)+BVDV(105拷贝/μL)+IBRV(105拷贝/μL),用所建立的三重二温式PCR进行检测。
1.2.6 临床应用 50份拭子样品采集自广西某一农场,该农场2016年曾发生牛支原体肺炎,采集样品时牛均未表现任何临床症状。样品包括38份鼻腔拭子,12份阴道拭子。拭子用PBS洗胶,5 000 r/min离心5 min, 取上清参照全式金RNA/DNA共提试剂盒说明书,抽提核酸,1 μL作为模板进行反应,反应体系和反应条件见1.2.2,验证三重二温式PCR的临床检测效果。
2 结果
2.1 三重二温式PCR检测反应体系和反应条件
通过对二温式PCR反应条件的优化,最后确定最佳的反应体系为:10×buffer 2.5 μL,AMV 5 U,TaqPolymerase 2.5 U,MgCl250 mmol/L 0.75 μL,dNTP 10 mmol/L 0.5 μL,每种引物各25 pmol,模板各1 μL,加水补足25 μL。最佳反应条件为:42 ℃ 30 min;94 ℃ 5 min;94 ℃ 30 s,67 ℃ 30 s,35个循环;72 ℃ 10 min。其最佳退火-延伸温度为67℃,既提高了特异性,又节省了时间。最后PCR产物置于10 g/L的琼脂糖凝胶电泳观察结果。
2.2 特异性试验结果
特异性试验结果显示,特定病原呈现出扩增条带为MB 412 bp,BVDV 170 bp,IBRV 727 bp,与预期相符合。用该方法检测其他牛病原体口蹄疫病毒、水疱性口炎病毒、蓝舌病毒、牛轮状病毒、小反刍兽疫病毒,均未出现任何扩增条带,判为阴性,表明该方法有较好的特异性(表1和图1)。表明三重二温式PCR方法可从基因水平同时检测MB、BVDV和IBRV,结果可靠稳定。
2.3 敏感性试验结果
将已经制备好的不同稀释倍数(1×108拷贝/μL~1×100拷贝/μL)RNA/DNA标准品(含等浓度的3种体外转录RNA/DNA),各1 μL为模板,用优化好的三重二温式PCR检测,测定其敏感性。结果显示,建立的三重二温式PCR,最低能检测到MB、BVDV和IBRV各10 000个拷贝的病原DNA/RNA(图2),由此可见,该检测方法灵敏度高。
2.4 干扰性试验结果
将不同浓度的MB、BVDV和IBRV的体外转录RNA/DNA模板进行混合,发现当一个模板浓度较高,而另一个较低时,所建立的方法依然可以不受干扰同时检测到MB、BVDV和IBRV(图3),由此可见,该方法干扰性小。
2.5 临床样品的检测结果
用建立的三重二温式PCR对50份临床样品进行检测,牛支原体阳性样品17份,感染率为34%;牛传染性鼻气管炎阳性样品5份,感染率为10%,牛病毒性腹泻病毒阳性样品3份,感染率为6%,阳性样品中有1份样品为牛支原体和牛传染性鼻气管炎混合感染,除此之外并未检出其他混合感染样品。所有样品的PCR产物送公司测序,结果正确,均为对应病毒,无假阳性检出。结果表明该三重二温 PCR临床检测效果良好。

M.DNA 标准DL 1 000;1.牛病毒性腹泻病毒;2.牛支原体;3.牛传染性鼻气管炎病毒;4.牛支原体+牛传染性支气管炎病毒;5.牛支原体+牛病毒性腹泻病毒;6.牛病毒性腹泻病毒+牛支原体;7.牛支原体+牛病毒性腹泻病毒+牛传染性鼻气管炎病毒;8.口蹄疫病毒A型;9.水疱性口炎病毒NJ型;10.蓝舌病病毒4型;11.牛轮状病毒;12.小反刍兽疫病毒;13.阴性对照
M.DNA Marker DL 1 000;1.BVDV;2.MB;3.IBRV;4.MB+IBRV;5.MB+BVDV;6.BVDV+IBRV;7.MB+BVDV+IBRV;8.FMDV A;9.VSV NJ;10.BTV4;11.BRV;12.PPRV;13.Negative control
图1三重二温式PCR特异性试验
Fig.1 The specificity test of two-temperature triplex PCR for MB,BVDV and IBRV

M.DNA 标准DL 1 000;1~9.108、107、106、105、104、103、102、101、100拷贝/μL
M.DNA Marker DL 1 000;1-9.108,107,106,105,104,103,102,101,100copies/μL
图2三重二温式PCR灵敏度试验
Fig.2 Sensitivity test of two-temperature triplex PCR for MB,BVDV and IBRV
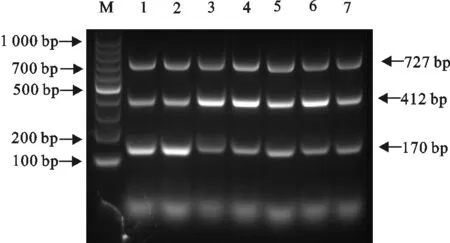
M.DNA 标准DL 1 000;1~7.样品A~G
M.DNA Marker DL 1 000;1-7.Sample A-G
图3三重二温式PCR干扰性试验
Fig.3 Interference test of two-temperature triplex PCR for MB,BVDV and IBRV
3 讨论
BRD是严重危害国内外养牛业健康发展的一类疾病,其病原主要包括细菌性病原体、病毒性病原和支原体病原,通常由一种或数种病原单独或混合感染引起[15-18]。主要危害犊牛、育肥肉牛和奶牛,具有发病率和病死率高的特点,给养牛业造成惨重的经济损失。牛支原体是当今导致BRD主要病因之一。据报道,欧美国家约1/4~1/3的BRD都是由牛支原体引起的。每年所造成经济损失达1.40亿美元,单个牛场感染率最高达70%;在欧洲每年约25%~33%的犊牛肺炎是由牛支原体引起的,每年损失大约1.44亿~1.92亿欧元;其中英国患牛支原体肺炎的牛只每年大约有190万头,死亡达15.7万头,单个牛场最高感染率达70%[19]。BVDV和IBRV都属于免疫抑制性疾病,表现为下呼吸道的多重损伤,病毒感染机体后还可继发细菌感染,导致更严重的呼吸道疾病,引起BRD,病死率高[1]。随着我国养牛业的迅速发展,国外品种不断被引入,BVDV和IBRV在我国发生、流行呈上升趋势。不同学者对不同地区牛群的感染情况进行了流行病学调查,结果显示,当前我国IBRV的感染率处于较高水平,辽宁、吉林、内蒙、山西、北京、青海、河南、新疆、河北、天津、陕西、山东、山西等地均有感染,IBRV抗体阳性率分别为35.0%和84.0%[20]。
二温式PCR是在普通PCR基本原理基础上建立的,将退火、延伸合并为一个温度,其最佳温度大于60℃,比普通PCR退火温度高,可减少非特异性扩增,并节约30 min时间。本研究将多重PCR和二温式PCR相结合,建立了三重二温式PCR,能成功地检测MB、BVDV和IBRV。敏感性最低检测量与姚怀兵等[21]报道的O型口蹄疫病毒二温式RT-PCR的最低检出率有差异,姚怀兵的最低检出率为1.665 pg/μL,根据阿弗加德罗常数换算后为1.12×105拷贝/μL。推测其原因可能是由于选用的酶、反应体系20 μL与本试验反应体系25 μL体积上有差异,且退火延伸温度不一样,因此造成了二温式PCR在敏感性上存在一定的差异。本试验的敏感性与刘婷婷等[22]的H3亚型禽流感病毒二温式RT-PCR一致,均可检测到104个拷贝的病原DNA/RNA。研究推荐使用RNA/DNA共提试剂抽提待检病料基因组,反应体系中存在反转录酶AMV,可高效反转录RNA,且不影响DNA的扩增。临床样品的检测结果中,虽然样品采集自无症状的牛,但该牛场曾暴发过牛支原体肺炎,牛支原体的感染率高达34%,说明牛支原体在该牛场并未清除,仍能持续排毒,不能忽视。BRD存在于牛场中,需准确检测出带病牛体,逐步清除,才能净化牛群。本研究所建立的三重二温式PCR,全程只需1次抽提,1次PCR,1次电泳即可检测3种病原,非常适合混合感染的样品,省时省力。该方法特异性好,与其他牛病病原体无扩增,灵敏度高,为BRD的防控提供了新的技术方法,具有很高的临床应用价值。
[1] Tomas J D,Simo F P.奶牛疾病学[M].北京:中国农业大学出版社,2009:73-119.
[2] 胡长敏,石 磊,龚 瑞,等.牛支原体病研究进展[J].动物医学进展,2009,30(8):73-77.
[3] Houe H.Epidemiology of bovine viral diarrhea virus[J].Vet Clin North Am Food Anim Pract,1995,11:521-547.
[4] 徐晓琴,冷 雪,李真光,等.牛传染性鼻气管炎诊断方法研究进展[J].动物医学进展,2010,31(1):81-86.
[5] Waldner C L,Kennedy R I.Associations between health and productivity in cow-calf beef herds and persistent infection with bovine viral diarrhea virus, antibodies against bovine viral diarrhea virus,or antibodies against infectious bovine rhinotracheitis virus in calves[J].Am J Vet Res, 2008, 69(7):916-927.
[6] Santman-Berends I M,Mars M H,van Duijn L,et al.Evaluation of the epidemiological and economic consequences of control scenarios for bovine viral diarrhea virus in dairy herds[J].J Dairy Sci,2015,98(11):7699-7716.
[7] Cernicchiaro N,White B J,Renter D G,et al.Evaluation of economic and performance outcomes associated with the number of treatments after an initial diagnosis of bovine respiratory disease in commercial feeder cattle[J].Am J Vet Res,2013,74(2):300-309.
[8] Word Organization for Animal Health (OIE).The OIE List of Notifiable Terrestrial and Aquatic Animal Diseases 2016[EB/OL].Available from:http://www.oie.int/en/international-standard-setting/terrestrial-manual/access-online/.
[9] 范 晴,谢芝勋,刘加波,等.牛轮状病毒二温式PCR检测方法的建立[J].广西农业科学,2010(10):1125-1127.
[10] 范 晴,谢芝勋,刘加波,等.BVDV与BRV二温式多重PCR检测方法的建立[J].西南农业学报,2011(5):1952-1954.
[11] Anne T,Isabelle D,Annick L,et al.Vileib conservation of the uvrC gene sequence inMycoplasmabovisand its use in routine PCR diagnosis[J].Vet J,2004,168:100-102.
[12] Letellier C,Kerkhofs P,Wellemans,et al.Detection and genotyping of bovine diarrhea virus by reverse transcription-polymerase chain amplification of the 5' untranslated region[J].Vet Microbiol,1999, 64:155-167.
[13] Wang J,O'Keefe J,Orr D,et al.Validation of a real-time PCR assay for the detection of bovine herpesvirus 1 in bovine semen[J].J Virol Methods,2007,144:103-108.
[14] Zeng T T,Xie Z X,Xie L J,et al.Simultaneous detection of six immunosuppressive chicken viruses by GeXP analyser-based multiplex PCR assays[J].Virol J,2015,12:226-231.
[15] Mcvey D S.BRD research needs in the next 10-20 years[J].Animal Health Res Rev,2009,10(2):165-167.
[16] EJJis J A.Update on viral pathogenesis in BRD[J].Animal Health Res Rev,2009,10(2):149-153.
[17] Confer A W.Update on bacterial genesis in BRD[J].Animal Health Res Rev,2009,10(2):145-148.
[18] Nichol R A,Ayling R D.Mycoplasmabovis:disease diagnosis and control[J].Res Vel Sci,2003,74(2):105-112.
[19] Caswell J L, Archambault M.Mycoplasmabovispneumonia in cattle[J].Animal Health Res Rev,2007,8(2):161-186.
[20] 李 程,陈颖钰,索朗斯珠,等.牛传染性鼻气管炎的流行与防控进展[J].中国奶牛,2015(17):40-43.
[21] 姚怀兵,赵 毅,刘 宏,等. 口蹄疫O型病毒二温式RT-PCR检测方法的建立及初步应用[J].中国畜牧兽医,2017,44(2):311-318.
[22] 刘婷婷, 谢芝勋, 宋德贵,等. H3亚型禽流感病毒二温式RT-PCR检测方法的建立及初步应用[J].中国兽医杂志,2015,51(1):14-16.

