颈盲蝽取食对薇甘菊叶片营养物质和防御酶的影响
李 胜, 郑端靖, 王 尹, 林 莹, 刘梦然, 桂富荣,3,4, 万方浩, 喜 超,4*
1云南农业大学植物保护学院,云南省生物资源保护与利用国家重点实验室; 2云南省农业环境保护监测站;3云南农业大学科技管理处; 4云南省高原特色农业产业研究院,云南 昆明 650201; 5中国农业科学院深圳农业基因组研究所,广东 深圳 518120
薇甘菊MikaniamicranthaH.B.K.原产于中、南美洲,为菊科攀缘草本植物,英文名为Mile-a-minute-weed(1分钟1英里的杂草),素有“植物杀手”之称(Zhangetal.,2010),是世界上最为严重的100种外来入侵物种之一(Loweetal.,2000; Mini & Abraham,2005)。薇甘菊既可以通过产生大量种子进行有性繁殖、扩散,又能够通过极强的无性繁殖能力进行传播(周晓梅和黄炳球,2001)。自20世纪80年代初传入我国深圳以后,已迅速扩散至我国广东、海南,以及云南德宏、普洱、西双版纳等地(莫南,2011; 徐小伟等,2014),侵入当地的果园、苗圃、草坪等,对生态环境、农业、林业、园林等造成了严重的危害,其控制管理问题已经成为世界性难题(徐高峰等,2014; Lietal.,2006)。薇甘菊的防除主要采用人工清除、化学防除和生物防治等方法,但目前国内外尚无高效防除薇甘菊方法的报道,而生物防除被认为是有广阔前景的一种途径(朱西儒,2000)。
薇甘菊颈盲蝽Pachypeltissp.是一种能够控制薇甘菊的非常重要的本地天敌。泽桑梓等(2013)研究发现,颈盲蝽取食薇甘菊叶片汁液后,严重抑制了薇甘菊叶片的光合作用,有效抑制了薇甘菊的生长、繁殖,甚至造成植株枯死。国外暂未见颈盲蝽取食对薇甘菊影响的相关报道;国内有研究表明,颈盲蝽取食会使薇甘菊叶片中的过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenoloxidase,PPO)、苯丙氨酸酶(phenylalaninase,PAL)产生变化(季梅等,2014);而有关颈盲蝽取食对薇甘菊叶片营养物质、叶绿素含量,过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)等活性的影响尚未见报道。因此,本研究通过实验探讨颈盲蝽取食后薇甘菊叶片的抗氧化能力、营养物质和叶绿素含量的变化,为薇甘菊的生物防治提供理论依据。
1 材料与方法
1.1 材料
薇甘菊与颈盲蝽均采自云南省德宏州瑞丽市(98°E、24°N)。剪取长度5 cm、茎直径2 mm的薇甘菊枝条,采用口径13.5 cm、高13.0 cm的花盆扦插种植,每盆1株。待其生长40 d、株高20 cm左右时,选取长势一致的薇甘菊备用。采回的颈盲蝽若虫利用薇甘菊活株饲养,挑选羽化时间一致的成虫进行实验。
1.2 实验设计
挑选12株叶片大小、高度、长势一致的薇甘菊,单株放入养虫笼内,并在每个养虫笼内接入3头健康的新羽化的颈盲蝽成虫。分别于接入颈盲蝽12、24、48、96 h后,从3盆盆栽薇甘菊上采摘被取食的薇甘菊叶片,作为3次重复处理,并称重。样品用液氮冷冻后置于-80 ℃冰箱保存,用于物质含量和酶活性测定。以接入颈盲蝽前的植株作为对照。
实验于云南省昆明市云南农业大学温箱内进行,每天光照12 h,光照度为15000 lx,温度(27±1) ℃,相对湿度80%。
1.3 测定方法
1.3.1 酶液的提取 称取植物叶片0.1 g,放入预冷的研钵中,用液氮研磨后加入2.5 mL预冷的提取液,冰浴下研磨成匀浆,将匀浆液12000 r·min-1、4 ℃离心10 min,上清液即为酶提取液。提取液为50 mmol·L-1磷酸缓冲液(pH 7.8),内含1%聚乙烯吡咯烷酮。
1.3.2 各指标的测定方法 POD活性的测定采用愈创木酚法,以每克鲜重每分钟D470 nm变化0.01为一个酶活力单位(U·g-1·min-1);SOD活性采用黄嘌呤氧化酶法测定,以每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个酶活力单位(U·mg-1);CAT活性的测定通过钼酸铵终止过氧化氢酶分解H2O2,并与剩余的H2O2作用生成淡黄色的络合物,在405 nm处测定其变化量,计算出酶活力,以每毫克组织蛋白每秒分解1 μmoL H2O2的量为一个酶活力单位(U·mg-1)。可溶性蛋白质含量用考马斯亮蓝G-250染色法测定;可溶性糖含量采用蒽酮比色法测定。叶绿素含量的测定:利用96%乙醇提取后,根据提取液在波长665、649和470 nm下的吸光度,计算1 g新鲜叶片中叶绿素含量(张以顺,2009)。以上每个处理重复3次。
1.4 数据处理
采用软件Microsoft Excel 2016和SPSS 17.0对数据进行处理,不同处理的薇甘菊叶片防御酶活性、营养物质含量及叶绿素含量差异,均采用单因素方差分析(One-way ANOVA: Fisher′s LSD test)。
2 结果与分析
2.1 颈盲蝽取食对薇甘菊叶片酶活性的影响
2.1.1 POD活性 如图1A所示,颈盲蝽取食后,薇甘菊叶片中的POD活性在12~48 h内迅速升高,在48 h时POD活性达到最大值,为对照的4.43倍,差异达到显著水平(P<0.05);之后POD活性下降,但96 h时,被取食叶片的POD活性仍高于对照,与对照差异达到显著水平(P<0.05)。
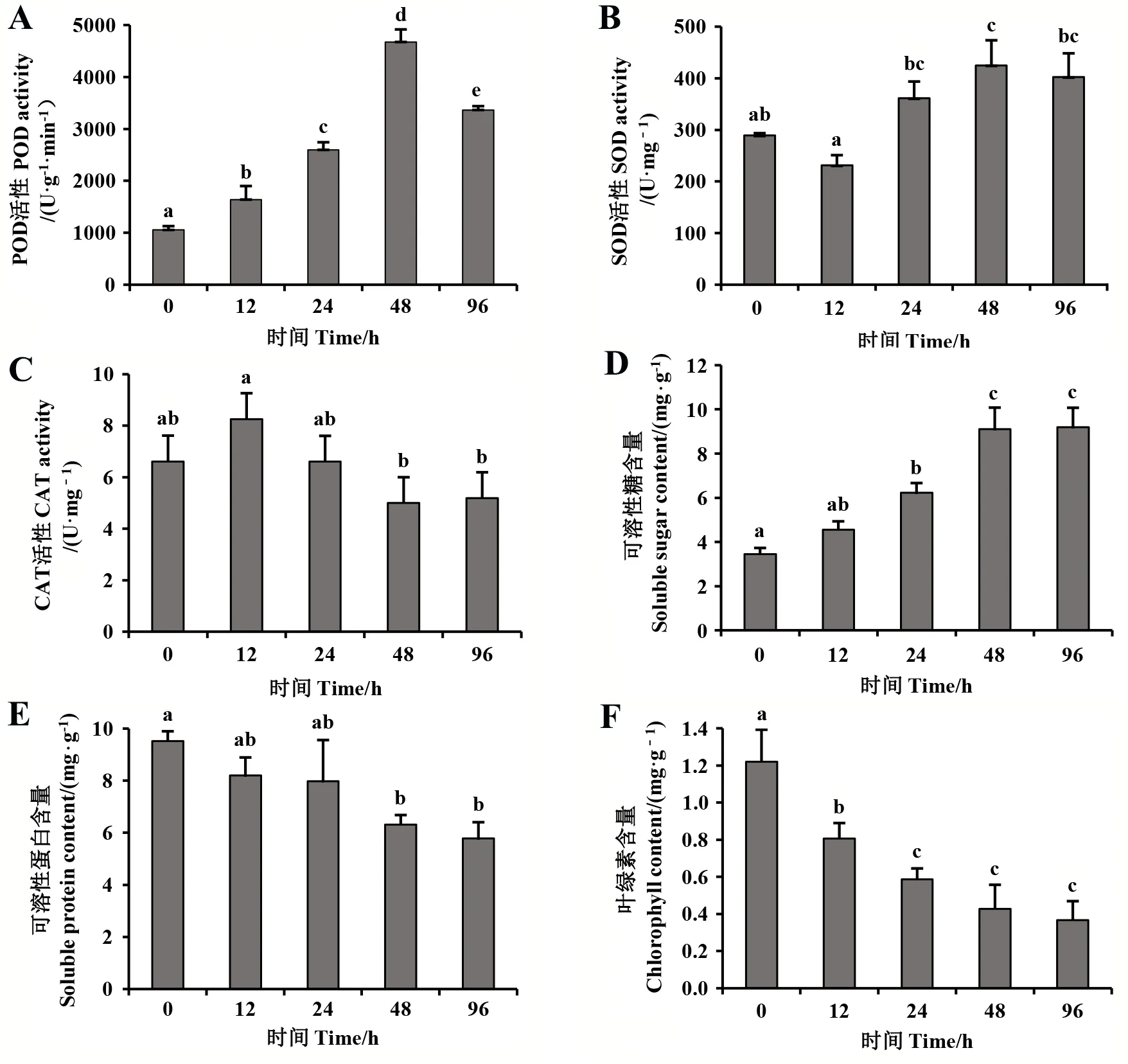
图1 颈盲蝽取食后薇甘菊叶片中防御酶活性和营养物质含量的变化Fig.1 Changes of defensive enzyme activities and nutrient contents in M. micratha leaves after exposed to feeding by Pachypeltis sp.不同字母表示在5%水平上差异显著。Different letters mean significant differences at 5% level.
2.1.2 SOD活性 如图1B所示,薇甘菊被颈盲蝽取食12 h时,SOD活性较对照降低,但差异不显著(P>0.05);取食48 h时,被取食的薇甘菊叶片SOD活性达到最高值,与对照差异达到显著水平(P<0.05),为对照的1.47倍;取食96 h时,SOD活性较48 h降低,但仍高于对照,与对照差异不显著(P>0.05)。
2.1.3 CAT活性 由图1C可知,颈盲蝽取食后,薇甘菊叶片中的CAT活性呈现先上升后下降再上升的趋势:在取食12 h时达到最高点,此时薇甘菊叶片中CAT活性较对照升高24.9%;随后CAT活性下降,取食24 h时恢复到对照水平;取食48 h时,CAT活性较对照降低了24.4%;取食96 h时,CAT活性较48 h升高,但仍低于对照21.5%。
2.2 颈盲蝽取食对薇甘菊叶片营养物质和叶绿素含量的影响
2.2.1 可溶性糖含量 由图1D可知,颈盲蝽取食后,薇甘菊叶片中可溶性糖含量持续升高,取食12、24、48、96 h时可溶性糖含量与对照相比分别高32.55%、81.71%、166.73%、169.03%,差异均达到显著水平(P<0.05)。其中,取食12~48 h内,可溶性糖含量升高较快,96 h与48 h相比可溶性糖含量变化较小。
2.2.2 可溶性蛋白含量 由图1E可知,颈盲蝽取食后,薇甘菊叶片中可溶性蛋白含量逐渐下降:取食12、24、48、96 h时可溶性蛋白含量分别比对照低13.91%、20.00%、33.67%、39.30%。其中,颈盲蝽取食48 h后,薇甘菊叶片中可溶性蛋白含量与对照差异达到显著水平(P<0.05)。
2.2.3 叶绿素含量 由图1F可知,颈盲蝽取食后,薇甘菊叶片中叶绿素含量逐渐下降:取食12、24、48、96 h时,薇甘菊叶片中叶绿素含量均显著低于对照(P<0.05),分别比对照降低33.88%、51.91%、65.00%、69.94%。其中,取食12、24和48 h,叶绿素含量下降较快;取食48 h与96 h叶绿素含量相差较小。对叶片的表观性状观察显示,取食48 h时薇甘菊叶片表面已基本变为黑褐色。
3 讨论
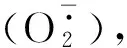
季梅等(2014)研究显示,薇甘菊在培育60 d后,每瓶中接入20头颈盲蝽,在96 h内薇甘菊叶片中的POD活性总体呈下降趋势;而本实验中,薇甘菊培育40 d后每株接入3头颈盲蝽,在被取食后叶片POD活性迅速升高,取食48 h时POD活性达到最高值。有研究表明,植物发育阶段以及受胁迫程度会影响POD活性(吴明江和于萍,1994)。因此,本实验中薇甘菊叶片POD活性的变化趋势与季梅等(2014)研究的差异是否与颈盲蝽的接入量、薇甘菊的生长时间有关,还需要进一步研究。取食12 h时,薇甘菊叶片中的SOD活性低于对照,之后活性逐渐上升,在48 h时与对照差异显著;取食12 h时,薇甘菊叶片中的CAT活性升高,之后逐渐降低,并在48 h时降至最低值。颈盲蝽取食96 h时,薇甘菊叶片中的POD和SOD活性较48 h降低,CAT活性较48 h升高,但仍低于对照。这说明颈盲蝽的刺吸胁迫会引起薇甘菊叶片酶促防御反应中关键酶活性的变化,并最终导致薇甘菊叶片关键酶活性降低,对颈盲蝽的抵御能力下降,叶片防御酶系统受到破坏。
叶绿体是植物光合作用过程中吸收光能的器官,其中,叶绿素是叶绿体中的主要色素,直接参与光合作用中光能的吸收、传递、分配和转化等过程(代惠萍,2013)。颈盲蝽取食后,薇甘菊叶片中叶绿素含量显著下降,在取食96 h时降到最低值,被取食叶片出现萎蔫和坏疽。这说明颈盲蝽的取食严重破坏了薇甘菊的光合系统,抑制了薇甘菊叶片的光合作用。泽桑梓等(2013)田间调查发现,在颈盲蝽取食初期,薇甘菊叶片表面会形成大小不一的斑点;取食面积超过叶面积50%后,随着日照、蒸腾作用加强,可导致叶片皱缩甚至死亡。本实验中观察发现,薇甘菊叶片无论在被取食初期还是后期,受害部位均会逐渐枯萎,说明颈盲蝽取食对薇甘菊叶片造成了不可逆转的损伤。
寄主植物中可溶性糖、蛋白质、氨基酸是昆虫的重要营养物质,这些物质的缺乏或搭配比例不当,会影响昆虫的生长发育,通过降低昆虫的生存率而获得抗虫性(李传明等,2017; 张风娟等,2006)。李传明等(2017)研究发现,辣椒可以通过增加自身可溶性糖含量、降低可溶性蛋白的含量来增强对烟粉虱的抗性。本研究发现,颈盲蝽取食后,薇甘菊叶片可溶性糖含量比未被取食叶片显著上升,可溶性蛋白含量逐渐下降,在48 h与对照差异显著。对于还原糖、可溶性糖、可溶性蛋白等营养物质含量与抗虫的相关性,目前尚无定论(李继东,2003; 王秋芬等,2015; 王紫薇等,2016)。另有研究表明,刺吸式昆虫会根据不同的寄主植物和不同的生理需要,通过唾液组分的改变来达到取食和发育的目的,一些蝽类的唾液酶中包含的淀粉酶、蛋白酶、海藻糖酶等能帮助其对食物进行体外消化,将食物的淀粉转化为麦芽糖,并最终经消化系统分解为葡萄糖(严盈等,2008; Azevedoetal.,2007; Kazzazietal.,2005)。因此,对于颈盲蝽取食后薇甘菊叶片中可溶性糖与可溶性蛋白含量等的变化是植物自身抗虫性的调节还是由某些物质分解导致,需进一步研究。
代惠萍, 2013. 植物对非生物胁迫的生理响应机制. 成都: 西南交通大学出版社.
高俊凤, 2006. 植物生理学实验指导. 北京: 高等教育出版社.
季梅, 泽桑梓, 赵宁, 杨斌, 2014. 颈盲蝽取食对薇甘菊叶片防御性酶活性的影响. 浙江农业学报, 26(3): 748-751.
李传明, 何菁, 顾爱祥, 苏宏华, 吴晓霞, 张海波, 解雅梅, 邬亚红, 周福才, 2017. 烟粉虱取食对不同抗虫性辣椒品种营养物质和抗性物质的影响. 中国生态农业学报, 25(10): 1456-1462.
李继东, 2003. 毛白杨无性系对桑天牛抗性相关生理指标研究. 硕士学位论文. 郑州: 河南农业大学.
刘长仲, 兰金娜, 2009. 苜蓿斑蚜对三个苜蓿品种幼苗氧化酶的影响. 草地学报, 17(1): 32-35.
莫南, 2011. 云南省薇甘菊发生特点及防控措施. 宁夏农林科技, 52(2): 40-41.
南芝润, 范月仙, 2008. 植物过氧化氢酶的研究进展. 安徽农学通报, 14(5): 27-29.
王秋芬, 胡启蒙, 吝亚杰, 宇文杏, 刘婷婷, 白会聪, 林胜男, 2015. 美国白蛾危害前后树木可溶性糖含量与抗虫性的关系. 广东农业科学, 42(22): 73-78.
王紫薇, 徐华潮, 汪云珍, 包志泉, 2016. 树皮内含物对光肩星天牛取食与刻槽产卵量的影响. 环境昆虫学报, 38(5): 942-949.
吴明江, 于萍, 1994. 植物过氧化物酶的生理作用. 生物学杂志 (6): 14-16.
徐高峰, 申时才, 张付斗, 2014. 异质环境下入侵植物薇甘菊的适应性与繁殖特性. 生态环境学报, 23(8): 1258-1264.
徐小伟, 泽桑梓, 杨斌, 季梅, 2014. 薇甘菊的分布危害、生物防治及资源化利用研究现状与展望. 热带农业科学, 34(12): 75-84.
严盈, 刘万学, 万方浩, 2008. 唾液成分在刺吸式昆虫与植物关系中的作用. 昆虫学报, 51(5): 537-544.
鱼欢, 冯佰利, 张英, 刘鹏涛, 何永艳, 代惠萍, 李生秀, 2007. 不同栽培模式下冬小麦叶片衰老与活性氧代谢研究. 作物学报, 33(10): 1729-1732.
泽桑梓, 苏尔广, 闫争亮, 翟雍善, 季梅, 2013. 薇甘菊颈盲蝽对薇甘菊的控制作用. 西部林业科学, 42(1): 46-52.
张风娟, 陈凤新, 徐东生, 霍志梅, 2006. 植物组织结构与抗虫性的关系(综述). 河北科技师范学院学报, 20(2): 71-76.
张以顺, 2009. 植物生理学实验教程. 北京: 高等教育出版社.
张宇婷, 高建民, 张琼琳, 张爱东, 王海霞, 孙杰, 2016. 植物超氧化物歧化酶的研究进展. 畜牧与饲料科学, 37(9): 28-31.
周晓梅, 黄炳球, 2001. 薇甘菊的发生及防治. 世界农业 (10): 42-43.
朱西儒, 2000. 薇甘菊的生物防除技术研究与应用前景∥中国农业科学院生物防治研究所, 中国科学院武汉病毒研究所, 中山大学生物防治国家重点实验室. 全国生物防治暨第八届杀虫微生物学术研讨会论文摘要集. 广州: 中山大学生物防治国家重点实验室: 4.
AZEVEDO D D O, ZANUNCIO J C, ZANUNCIO J S, MARTINS G F, MARQUES-SILVA S, SOSSAI M F, SERRAO J E, 2007. Biochemical and morphological aspects of salivary glands of the predatorBrontocoristabidus(Heteroptera: Pentatomidae).BrazilianArchivesofBiologyandTechnology, 50(3): 469-477.
KAZZAZI M, BANDANI A R, HOSSEINKHANI S, 2005. Biochemical characterization of α-amylase of the Sunn pest,Eurygasterintegriceps.EntomologicalScience, 8(4): 371-377.
LI W H, ZHANG C B, JIANG H B, ZHANG C B, JIANG H B, XIN G R, YANG Z Y, 2006. Changes in soil microbial community associated with invasion of the exotic weed,Mikaniamicrantha, H.B.K.PlantandSoil, 281(1/2): 309-324.
LOWE S, BROWNE M, BOUDJELAS S, DE POORTER M, 2000. 100oftheworld′sworstinvasivealienspecies.AselectionfromtheGlobalInvasiveSpeciesDatabase. Auckland, New Zealand: Invasive Species Specialist Group (ISSG).
MINI A, ABRAHAM C T, 2005. Biology of mile-a minute weedMikaniamicranthaH. B. K. an alien invasive weed in Kerala.IndianJournalofWeedScience, 37(1/2): 153-154.
ZHANG L Y, YE W H, CAO H L, FENG H L, 2010.MikaniamicranthaH.B.K. in China — an overview.WeedResearch, 44(1): 42-49.

