玉米ZmLTP3基因启动子的克隆及功能分析
宁慧宇, 江 敏, 张丙林, 邹华文
(长江大学农学院,湖北荆州 434025)
植物转脂蛋白(lipid transfer proteins,简称LTPs)是植物体内具有结合和转运脂类功能的一类小分子蛋白。又因其对各种脂类(如辅酶A、磷脂和脂肪酸等)具有较高的亲和力,又被称为非专一性转脂蛋白(non-specific lipid transfer proteins,简称nsLTPs)[1-3]。植物转脂蛋白是一类碱性蛋白,分子内部都含有1个由8个半胱氨酸组成的保守基序(C-Xn-C-Xn-CC-Xn-CXC-Xn-C-Xn-C)。这8个半胱氨酸形成4对二硫键,所以转脂蛋白分子具有较高的耐高温、耐变性等特性[4]。最初根据分子量大小,植物LTPs成员被分为2种类型:Ⅰ型、Ⅱ型[5]。此后,Edstam等根据半胱氨酸之间的距离、保守内含子的位置以及翻译后糖基磷脂酰肌醇锚(GPI-anchor)的添加与否,把LTPs重新划分为A、B、C、D、E、F、G、H、J和K型[1]。因为具有膜间转移脂分子的功能,植物LTPs最初被认为参与生物膜系统的生物合成[6]。然而随着N-端信号肽的发现和胞外定位,使人们开始重新认识LTPs的功能。现有的研究表明,LTPs涉及植物多种生理过程,包括参与蜡质的合成和运输、生殖器官的发育、提高植物抗性、促进细胞壁的伸长,此外还有调节果胶降解活性等[7-9]。其中研究较多的是其在蜡质的合成和运输、生殖器官的发育以及在提高植物抗性中的作用。
在之前的研究中,笔者从玉米中克隆到1个转脂蛋白家族成员,并命名为ZmLTP3(GenBank登录号 JX435819.1),过量表达ZmLTP3基因的拟南芥表现出明显的抗盐性[10]。在美国国立生物技术信息中心(National Center for Biotechnology Information,简称NCBI)数据库中,ZmLTP3基因上游启动子序列并未测通。为了阐述ZmLTP3基因的作用机制,本研究克隆并测序ZmLTP3基因上游完整的启动子序列,并对此序列进行生物信息学分析,拟构建融合GUS报告基因的植物表达载体,将其转化拟南芥,并对转基因拟南芥纯合体株系进行GUS组织化学染色,验证启动子功能。本研究为深入分析ZmLTP3基因的作用机制奠定了基础。
1 材料与方法
1.1 材料
植物材料拟南芥(Columbia 生态型)、玉米B73、大肠杆菌菌株 DH5α、农杆菌GV3101、植物表达载体pGreen0029-GUS等,均由笔者所在实验室保存并提供。
1.2 方法
1.2.1 启动子克隆及序列分析 利用十六烷基三甲基溴化铵(简称CTAB)法[11]提取3叶1心期的玉米叶片基因组DNA。在NCBI网站(https://www.ncbi.nlm.nih.gov/)上下载得到ZmLTP3基因ATG上游 2 881 bp(不包括gap的碱基数)的启动子序列,并在此序列内部缺口的两端设计上下游引物,扩增完整的启动子序列。上游引物序列为5′-GGCGACTGTGACACTATCC-3′,下游引物序列为5′-AAGTAGGGCTATCGAAACAGG-3′。得到完整序列后,在NCBI网站上比对测序结果与数据库中序列的异同。在Plantcare网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)上预测测序启动子序列中所含有的顺式作用元件。
1.2.2 拟南芥的遗传转化 以测序的启动子序列为模板,在-1 301 bp处设计上游引物,扩增启动子片段,并将此启动子片段插入到植物表达载体pGreen0029-GUS中GUS的上游。同时,也把笔者所在实验室保存的35S启动子片段插入到上述载体中作为阳性对照。拟南芥的培养、基因转化及转基因株系的分子鉴定参考文献[12]。在GUS基因序列内部设计1对引物,用于对转基因拟南芥的PCR检测,上游引物序列为5′-TTCTGATTAACCACAAAC-3′,下游引物序列为5′-CGGTTCGTTGGCAATACTCC-3′。
1.2.3 启动子功能分析 分别取转空载体、35S、ZmLTP3基因启动子载体的阳性植株和野生型拟南芥叶片,参照Gross等的方法[13]进行GUS染色。
2 结果与分析
2.1 ZmLTP3基因启动子克隆
得到准确、完整的启动子序列,是启动子功能分析的第1步。但是查询NCBI数据库发现,ZmLTP3基因起始密码子ATG上游-1 270 bp处有未测通的缺口,并且序列内部含有重复序列及反向重复序列(图1)。为了得到准确的序列,笔者在距缺口较远的位置设计上下游引物, 扩增此片段。测序结果表明,从上游引物到ATG只有1 302 bp的距离,而不是NCBI数据库中的2 492 bp (不包括缺口的碱基数)。BLAST结果表明,测序的启动子序列与网上序列一致性为99%,序列内部没有重复及反向重复序列(图2)。


2.2 ZmLTP3基因启动子序列分析
利用Plantcare网站分析发现,测序序列含有众多顺式作用元件,包括14个TATA-box,这14个TATA-box中离ATG最近的位于-149 bp处,离ATG最远的位于-1 196 bp处,此外,测序序列中还含有7个CAAT-box(表1)。除了TATA-box、CAAT-box等启动子必需的元件外,该启动子片段包含许多重要的结合位点及功能元件,例如参与植物防御和逆境响应的调控元件(TC-rich repeats)、参与脱落酸响应的作用元件(ABRE)、参与干旱诱导响应的元件(MBS)、参与水杨酸响应的元件(TCA-element)、众多光响应元件等。这些功能元件的存在,说明ZmLTP3基因可以响应多种逆境胁迫(包括生物逆境以及非生物逆境)的诱导,并且在逆境胁迫中发挥作用。

表1 ZmLTP3基因启动子区顺式作用元件
2.3 ZmLTP3基因启动子的拟南芥转化及鉴定
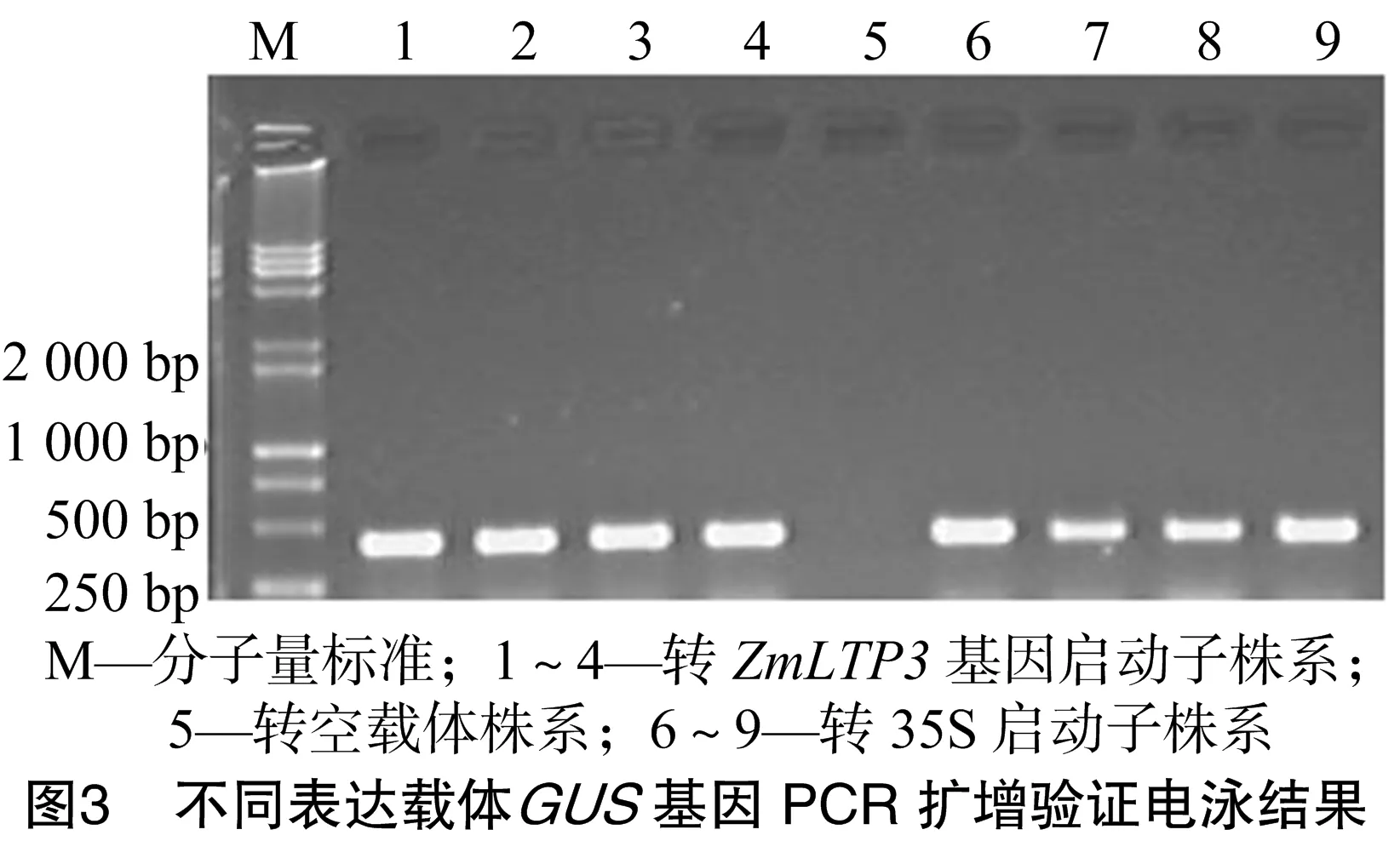
花苞用浸蘸法转化拟南芥后,收取T0代种子,消毒后播种在含有50 μg/L卡那霉素的MS培养基上培养,种子发芽后,选取正常生长状态的幼苗进行PCR鉴定。如图3所示,所选择的转基因株系在400 bp左右都有1条阳性条带,而野生型株系的对照扩增结果为阴性,表明所采样的拟南芥植株均为成功转化了的阳性株系,可以用来进行下一步试验。
2.4 ZmLTP3基因启动子的功能鉴定
在本试验中,分别采取成熟阶段的不同拟南芥植株的叶片作为试验材料进行GUS染色。如图4所示,野生型及空白载体转化的拟南芥植株叶片未显示蓝色,而转35S启动子及ZmLTP3基因启动子的转基因拟南芥株系都呈现不均匀的蓝色,且转35S启动子的拟南芥株系染色较转ZmLTP3基因启动子的深,暗示ZmLTP3基因启动子的表达强度不及35S启动子。

3 讨论与结论
从现有的资料来看,研究者大多集中在对LTPs生物学功能的探究,而对其作用机制则很少有报道,尤其是对其上游的分子调控机制也鲜有系统的研究。另外,尽管第1条编码植物LTP的cDNA是从玉米中获得的,但是之后关于玉米中LTP基因家族及其功能的研究很少有深入的报道。本研究通过对ZmLTP3基因启动子的分析,为进一步阐明ZmLTP3基因作用机制,尤其是其上游调控机制打下了基础。
尽管玉米基因组测序工作的完成给玉米分子生物学的研究带来了极大的方便,但是由于玉米基因组结构的复杂性,尚有一些未测通的片段,这也给相关工作的开展带来了诸多不便。例如,本研究中ZmLTP3基因上游的启动子序列就没有完全测通。本试验以NCBI中公布的ZmLTP3基因上游序列为基础,在序列的缺口上下游合适位置设计引物,成功地克隆了启动子序列,填补了NCBI中此序列的缺口,为其他研究者进行相关研究提供了便利。BLAST结果表明,克隆序列与NCBI中公布的序列一致性为99%。
Plantcare在线分析表明,测序序列除具有TATA-box及CAAT-box等典型的启动子基本顺式作用元件外,还含有多种响应生物胁迫及非生物胁迫的元件,暗示ZmLTP3基因可能参与多种逆境胁迫的信号传导过程,这也与笔者之前的试验结果相吻合[10]。为了验证此启动子序列的功能,构建植物表达载体,转化拟南芥,GUS染色结果初步证明所克隆的序列具有启动子功能。进一步的研究,如启动子核心序列的鉴定、反式作用因子的筛选及验证等则需要进行后续试验。
[1]Edstam M M,Viitanen L,Salminen T A. Evolutionary history of the Non-Specific lipid transfer proteins[J]. Molecular Plant,2011,4(6): 947-964.
[2]Kader J C. Lipid-transfer proteins in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1996,47(1): 627-654.
[3]Smith L J,Roby Y,Allison J R,et al. Molecular dynamics simulations of barley and maize lipid transfer proteins show different ligand binding preferences in agreement with experimental data[J]. Biochemistry,2013,52(30): 5029-5038.
[4]Edstam M M,Laurila M,Höglund A,et al. Characterization of the GPI-anchored lipid transfer proteins in the mossPhyscomitrellapatens[J]. Plant Physiology and Biochemistry,2014,75: 55-69.
[5]Yeats T H,Rose J K. The biochemistry and biology of extracellular plant lipid-transfer proteins (LTPs)[J]. Protein Science,2008,17(2): 191-198.
[6]Kader J C,Julienne M,Vergnolle C. Purification and characterization of a spinach-leaf protein capable of transferring phospholipids from liposomes to mitochondria or chloroplasts[J]. European Journal of Biochemistry,1984,139(2): 411-416.
[7]Fan Y,Du K,Gao Y,et al. Transformation ofLTPgene intoBrassicanapusto enhance its resistance toSclerotiniasclerotiorum[J]. Russian Journal of Genetics,2013,49(4): 380-387.
[8]Orellana S,Yanez M,Espinoza A,et al. The transcription factor SlAREB1 confers drought,salt stress tolerance and regulates biotic and abiotic stress-related genes in tomato[J]. Plant Cell and Environment,2010,33(12): 2191-2208.
[9]Yang Z B,Eticha D,Rotter B,et al. Physiological and molecular analysis of polyethylene glycol-induced reduction of aluminium accumulation in the root tips of common bean (Phaseolusvulgaris)[J]. New Phytologist,2011,192(1): 99-113.
[10]Zou H W,Tian X H,Ma G H,et al. Isolation and functional analysis ofZmLTP3,a homologue to arabidopsisLTP3[J]. International Journal of Molecular Sciences,2013,14(3): 5025-5035.
[11]Zou H W,Wu Z Y,Yang Q,et al. Gene expression analyses of ZmPti1,encoding a maize Pti-like kinase,suggest a role in stress signaling[J]. Plant Science,2006,171(1): 99-105.
[12]Zou H W,Wu Z Y,Zhang X H,et al. Over-expression ofZmPti1,a homologue toPti1,increases salt tolerance ofArabidopsisthaliana[J]. African Journal of Biology,2010,9(5): 656-662.
[13]Gross J,Stein R J,Fett-Neto A G,et al. Iron homeostasis related genes in rice[J]. Genetics and Molecular Biology,2003,26(4): 477-497.

