基于miRNA-10b调控宫颈癌LncRNA-H19网络通路机制的研究
滕彦玲, 牟晓梅
(1.吉林市中心医院 检验科,吉林 吉林 132011;2.北华大学附属医院 检验科)
宫颈癌是严重威胁女性健康的第三大恶性肿瘤。在宫颈癌的发病机制中某些特定基因的异常表达或过表达可能是引起肿瘤细胞增殖的重要原因[1]。H19的表达与宫颈癌的发生密切相关[2],可抑制宫颈癌细胞增殖[3],而二者是否存在相互作用、作用机制未知。本研究从信号通路HOXA1为切入点,结合RNA干扰和miRNA芯片技术,筛选所有可能受到HOXA1转录调控的miRNA分子,通过分析并证实miRNA-10b分子可直接负反馈调控HOXA1,研究LncRNA-H19调控的miRNA-10b家族分子对宫颈癌细胞生长、凋亡的影响,构建一个相对完整的LncRNA-H19、miRNA-10b与靶基因HOXA1信号途径相互作用的调控网络,从而为进一步解释宫颈癌的发生发展提供新的理论基础。
1 材料与方法
1.1细胞培养
选取人源性宫颈癌细胞系HeLa进行研究(由中国科学院上海生命科学院细胞库提供)。将细胞加入到含10%牛血清蛋白DMEM-F12 (1∶1)培养基中,在37℃、5% CO2培养箱中培养,待细胞贴壁生长后用胰蛋白酶处理、传代,取对数期生长细胞以1.0×105的密度接种到六孔板上,备用。
1.2细胞转染
把H19 cDNA(GeneBank accession no.NR_002196.1)构建到pDNA3.1载体(购自美国Invitrogen公司)的多克隆位点上。特异性的H19 siRNA或其阴性对照(H19:4390771,life technologies carlsbad,CA)转染到HeLa细胞中,从而来敲除H19的表达。将宫颈癌细胞按照2×105/孔种植在24孔平板上培养24 h,利用脂质体2000(购自美国Invitrogen公司)将0.5 μg的pDNA-H19或pcDNA-mut-H19转染到两种宫颈癌细胞中,继续培养48小时。
1.3CCK-8检测细胞生长状况
取HeLa的48孔板,以2×105/孔的密度种植在24孔平板上培养24 h,用脂质体2000将0.5 μg的pDNA-H19与miRNA-10b类似物miR-10b mimics(购自上海吉玛制药技术有限公司)一同转染到宫颈癌细胞中,将其分别作为第一、第二组、第三组共同转染pDNA-H19和miRNA-10 inhibitor(对照组),继续培养48小时弃去孔内培养基,加入 CCK-8 溶液 10 μl/孔,置入培养箱中37℃,5%CO2条件下孵育分别经24、48、72小时取出,用酶标仪检测一次,酶标仪波长设定为 450 nm。
1.4实时定量PCR
分别对HeLa细胞做如下处理,miR-10b mimics转染,pDNA-H19和miR-10b mimics共同转染,pcDNA-mut-H19和miR-10b mimics共同转染。取对数生长期的处理后细胞接种到 6 孔板中,接种密度为 2×105个/mL,培养24小时后,用 TRNzol 试剂提取总 RNA,用 M-MLV 逆转录。定量PCR所使用H19引物、miR-10b引物化及U6引物(内参对照)均购自生命科技公司,其完成引物的合成与测序。H19上游扩增引物:5′-AGCGGGTCTGTTTCTTTACTT-3’,下游扩增引物:5′-AGCTGGGTAGCACCATTTC-3′;miRNA-10b 上游引物5′-CGAGGGTCCGAGGTATTCCG-3′ 下游引物5′-CGCCGCCCAGTGTTCAGA-3′,利用生命科技公司(Carlsbad,CA)的Fast Start Universal SYB Green Master(ROX)系统测定H19和miRNA-10b的表达水平,采用相对定量法比较、分析结果,每个实验重复三次。
1.5Westernblot检测蛋白表达水平
将以上三种处理后的细胞提取总蛋白后,BCA法测IGF1R蛋白浓度。配制10%分离胶行SDS-PAGS电泳,转膜后依次加入一抗、二抗孵育。以GAPDH为内参将胶片扫描,凝胶图像处理系统分析目的条带光密度值及分子量,进行统计分析。
1.6统计方法
2 结果
2.1H19可抑制miRNA-10b的表达
用RT-PCR检测miRNA-10b的表达水平,结果显示,与pcDNA-mut-H19和miRNA-10b共转染组比较,pDNA-H19和miR-10b 共转染组的miR-10b表达量下降(P<0.05),与pDNA-H19和miR-10b inhibitor共转染组比较,miR-10b表达量差异没有统计学差异(P>0.05),说明H19 抑制miRNA-10b的表达,见图1。
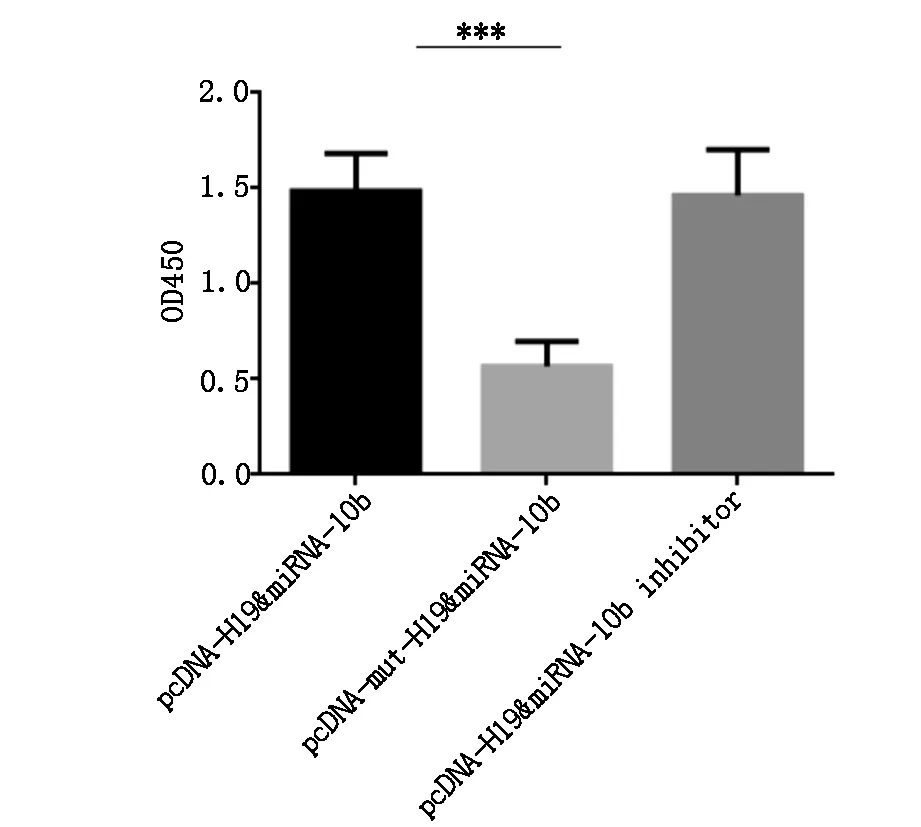
向过表达H19的HeLa细胞转染miRNA-10b或miRNA-10 inhibitor共转染组细胞增长明显高于pcDNA-mut-H19和miRNA-10b共转染组(P<0.05)
图1H19可抑制miRNA-10b的表达
2.2H19促进IGF1R表达
用Western blot检测IGF1R蛋白表达量显示,pDNA-H19和miR-10b 共转染组的IGF1R蛋白量增加(P<0.05),与pDNA-H19和miR-10b inhibitor共转染组比较IGF1R蛋白量没有统计学差异(P>0.05),由此可以说明H19促进IGF1R表达,见图2。
3 讨论
MicroRNAs (miRNAs)被作为一类分子标记物,在近年来的肿瘤研究中占有重要地位。长度为21-23个核苷酸的miRNA片段,可作为非编码miRNA通过与特定的mRNA的3'UTRs区域结合使之降解或抑制其翻译,从而发挥基因调节作用。
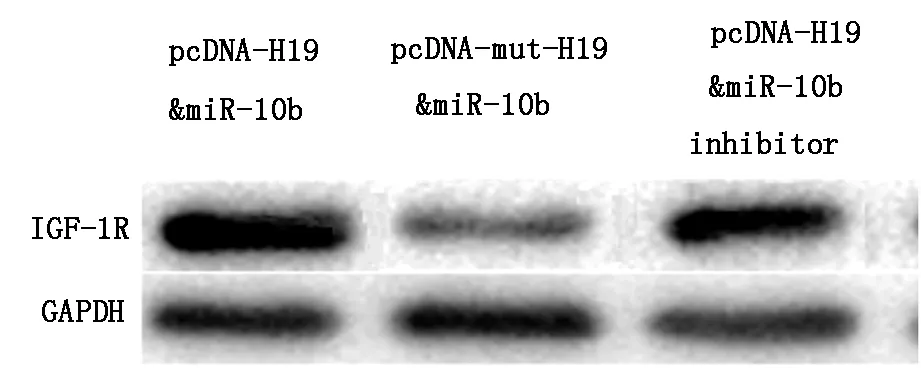
pDNA-H19和miR-10b 共转染组的IGF1R蛋白表达量高于pcDNA-mut-H19和miR-10b 共转染组(P<0.05),与pDNA-H19和miR-10b inhibitor共转染组比较IGF1R蛋白量没有统计学差异(P>0.05)
图2H19促进IGF1R表达
miRNAs可参与细胞的多种生理和病理过程,在细胞增殖、凋亡、迁移,糖和脂质代谢,免疫应答中均可发挥重要作用[4]。有研究报道,miRNA-10b在宫颈癌细胞中的表达量明显降低,借助基因工程在宫颈癌细胞中过度表达miRNA-10b能够抑制肿瘤增殖、侵袭和迁移,且通过调节IGF1R可发挥抑制miRNA-10b表达的作用[5]。
长链非编码RNA(lncRNA)是一类在基因表达的各个层次环节发挥基因调节功能的RNA分子,由200 个核苷酸组成,其作用主要从表观遗传学、转录调控及转录后调控等方面实现。其中 lnc RNA-H19 是目前长链非编码RNA中唯一由印迹基因编码,其基因表达水平随着胚胎发育而降低。多项研究显示H19在宫颈癌组织中有印记缺失现象(Loss of Imprinting,LOI),提示 H19 LOI 和宫颈癌的发生有着高度相关性[6]。
近年来,众多研究者对肿瘤的研究重点放在长链非编码 RNA上。 H19 是一类早期发现由印记基因编码的在胚胎期高度表达的长链非编码 RNA,其表达水平随着个体发育成熟而逐步降低。科学家通过研究阐明,启动子区域的高甲基化是 H19 在成熟机体低表达的重要原因[7]。虽然H19与肿瘤的关系还不能明确,但在多种肿瘤的发生、发展过程中其具有促癌或抑癌的作用。有研究显示,H19可在胃癌组织中高表达,并通过与p53 作用促进细胞增殖[8]。但也有研究报道 H19 和 miR-675 间存在共同作用通路,在前列腺癌的发展过程中通过抑制 TGFBI 的翻译可抑制前列腺癌的迁移[9]。我们的研究发现,在宫颈癌癌细胞中 H19过表达时,miRNA-10b的表达水平降低,同时可引起肿瘤细胞生长速度加快。说明miRNA-10b能够抑制宫颈癌细胞增殖、迁移和侵袭,是与宫颈癌密切相关的分子。 H19 抑制 miRNA-10b表达的这一现象将为此类研究提供线索,为通过调节H19基因序列来治疗宫颈癌提供依据。
[1]钟 茜,赵 霞.宫颈癌诊治中的过度治疗与治疗不足[J].中国计划生育和妇产科杂志,2013,5(2):21.
[2]王文玲.印迹基因H19在宫颈癌中的表达及意义[D].兰州大学,2007.
[3]祝敏捷,孙莲芳,杨 静.血清 miR-21 和 miR-10b 在早期宫颈癌患者中的表达及临床意义[J].现代中西医结合杂志,2017,26(11):1167.
[4]何 烨,王科明.长链非编码RNA在肿瘤中作用的研究及进展[J].现代肿瘤医学,2013,(6):1381.
[5]Hou R,Wang D,Lu J.MicroRNA-10b inhibits proliferation,migration and invasion in cervical cancer cells via direct targeting of insulin-like growth factor-1 receptor[J].Oncology Letters, 2017,13(6):5009.
[6]邱剑萍.宫颈癌中H19基因的特异表达模式及印记缺失分析 [J].中国现代医药杂志,2008,(11):31.
[7]彭 艳,谢海棠,孙 红,等.人长链非编码RNA基因H19克隆、表达载体构建及对MCF7细胞增殖的影响[J].中国药理学通报,2015,16(4):555.
[8]Hao Li,Beiqin Yu,Jianfang Li,et al.Overexpression of lnc RNA H19 enhances carcinogenesis and metastasis of gastric cancer[J].Oncotarget.2014,5(8):2318.
[9]Miaojun Zhu,Qin Chen,Xin Liu,et al.lncRNAH19/mi R-675 axis represses prostate cancer metastasis by targeting TGFBI[J].FEBS J,2014,281(16):3766.

