甲状腺破骨细胞样巨细胞性未分化癌临床病理及分子病理特点分析
黄思念,王丽梅,姚俊霞,刘继灿,朱 婷
(复旦大学附属中山医院青浦分院 病理科,上海201700)
甲状腺未分化癌(ATC)是一种非常少见的高度侵袭性肿瘤,约占甲状腺恶性肿瘤5%,中位生存期约5个月[1]。ATC目前被认为起源于滤泡细胞,虽然非常少见,但生物学行为高度恶性,并且预后很差[2]。外科手术,放疗和化疗,多重治疗模式据报道[2]对ATC有效,但这些治疗模式只能改善肿瘤局部进展速度,并不能提高肿瘤的治愈率和生存率。随着分子生物学技术的发展,小分子抑制剂和单克隆抗体在现在的肿瘤治疗中得到广泛使用,但ATC的治疗目前并没有成熟的靶向药物。研究甲状腺未分化癌的临床病理及分子病理特点,对于揭示甲状腺未分化癌的发病机制以及研究靶向药物,均有十分重要的意义。ATC少见的组织学亚型有[3]:(1)鳞状细胞亚型;(2)腺鳞癌亚型;(3)淋巴上皮样肿瘤亚型;(4) 柱状细胞亚型;(5)破骨细胞亚型;(6) 癌肉瘤亚型;(7) 少细胞亚型;(8) 血管瘤样亚型。目前有关甲状腺破骨细胞样巨细胞性未分化癌的相关研究较为少见,现报导破骨细胞亚型两例,同时分析其临床病理及分子病理特点。
1 材料与方法
1.1临床资料
例1,患者男,51岁,因颈前区不适一月余入院,查B超示双侧甲状腺肿块实性占位。入院查体:左颈前区可扪及一4 cm×3 cm肿块,右颈前区可及一2 cm×2 cm肿块。行双侧甲状腺及峡部切除术,术中见双侧甲状腺肿大,约10 cm×10 cm×6 cm,多发结节,边界不清,质偏硬,表面欠光滑。术后随访半年,患者死于双肺肿瘤转移。
例2,患者女,79岁,发现颈前区肿块一周入院,查B超示双侧甲状腺混合回声团块。入院查体:颈前区偏左侧可扪及一肿块,约有5 cm×5 cm。行双侧甲状腺及峡部切除术,术中见左侧甲状腺、峡部、右侧部分甲状腺明显肿块形成,呈鱼肉状,表面不规则,浸润性生长,肿块大小约6.5 cm×5.5 cm。术后失访。
1.2实验方法
手术切除标本经10%中性福尔马林固定,常规脱水,石蜡包埋,3 μm厚切片,HE染色,光镜观察。
免疫组化染色使用LEICA全自动免疫组化染色仪(LEICA BOND- MAX),采用Envision两步法,一抗包括CD68,CgA,Desmin,TTF- 1,HMB45,CK7,Vimentin,Syn,CK19,TG,PCK,PAX- 8,LCA,EMA,SMA,CD34,购自DAKO公司和基因科技公司,DS9800(LEICA)为二抗。用已知阳性切片作阳性对照,PBS代替一抗作阴性对照。
甲状腺基因突变检测委托厦门飞朔生物技术有限公司完成。基因突变检测具体步骤为:
(1)DNA样品检测:琼脂糖凝胶电泳分析DNA降解程度以及是否有RNA、蛋白质污染,同时对DNA的浓度和纯度进行精确定量;
(2)建库捕获:采用飞朔生物自主专利技术RingCapTM文库构建技术,对样本DNA进行文库制备,对目标序列进行扩增捕获,并使产物形成粘性末端,形成环形产物,同时对环形产物进行特异性扩增放大;
(3)库检:使用Qubit2.0进行初步定量,随后使用qPCR方法对文库的有效浓度进行准确定量;
(4)上机测序:根据库检合格文库的有效浓度及数据产出需求进行Ion torrent平台PGM测序;
(5)数据分析:测序完成后,获得原始测序序列,对测序所产生的数据进行评估,评估之后对样本进行变异检测。
2 结果
2.1眼观例1巨检:双侧甲状腺切除组织,大小9 cm×7 cm×5 cm,切面见一结节,大小6 cm×5 cm×4 cm,部分区坏死,结节外部分区呈灰白色,质嫩。例2巨检:双侧甲状腺切除组织,大小6.5 cm×5.5 cm×5 cm,切面见一结节,大小6.5 cm×5 cm×5 cm,表面尚光滑,切面灰白、灰红,鱼肉状。
2.2镜检例1 诊断:(双侧甲状腺)镜下病变区见大量增生异型短梭形细胞及破骨样巨细胞,可见核分裂像及大片坏死,浸润甲状腺组织,部分区可见增生异型上皮细胞,并见少量真乳头结构,考虑甲状腺未分化癌(破骨细胞样巨细胞型)伴小灶区乳头状癌形成。免疫组化:CD68(巨细胞+),TTF- 1(乳头+),Vimentin(+),CK19(少数+),TG(乳头+),PCK(部分+),Ki- 67(约10%+),PAX- 8(-),CgA(-),Desmin(-),HMB45(- ),CK7(-),Syn(-)。
例2诊断:(双侧甲状腺)未分化癌,破骨巨细胞型,肿瘤浸润周围甲状腺组织,周围脉管内见癌栓,甲状腺切缘未见肿瘤累及。免疫组化:PCK(灶性+),CK7(灶性+),CK19(灶性+),EMA(+),Vimentin(+),CD68(巨细胞+),Ki- 67(约5%+),TG(-),PAX- 8(-),SMA(-),Desmin(-),LCA(-),CD34(-)。
2.3基因突变分析结果例1出现KRAS、NRAS、PIK3CA基因突变;例2出现NRAS基因突变(见表1)。
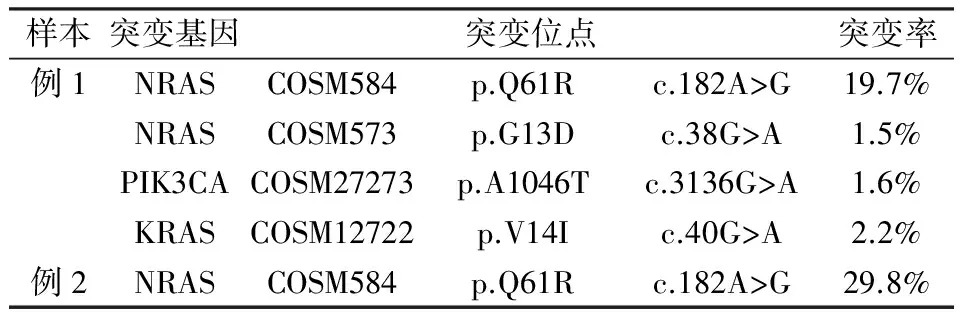
表1 甲状腺未分化癌两例基因突变位点
3 讨论
3.1ATC的诊断标准及其细胞起源甲状腺未分化癌的WHO诊断标准指出:(1)肿瘤以未分化成分为主;(2)必须有明确的上皮分化组织学证据,如果没有,必须有PCK,TG或TTF- 1阳性[4]。Lee等[5]指出,诊断ATC,其未分化细胞成分必须大于10%。本研究中的两例ATC,均以大量增生的破骨样巨细胞为主,同时伴随上皮标记的部分表达。Parenti等[3]指出,大部分的ATC存在残存的分化好的甲状腺肿瘤病灶,包括乳头状癌和滤泡癌。例1出现少量乳头状癌的结构,但甲状腺未分化成分>10%,故仍然诊断为ATC。
ATC中经常可以看到核分裂,包括非典型核分裂。出血和坏死,有时也可以经常看到细胞排列成栅栏状。虽然上述的形态学特点代表了ATC普遍的形态学特点,随着研究的深入,许多新的形态学亚型也被描述出来,其中破骨细胞亚型的定义为混杂的肿瘤细胞中包含反应性的CD68阳性破骨细胞样多核巨细胞[3]。我们研究中的两例ATC,镜下均见大量破骨样巨细胞,CD68示巨细胞呈阳性反应,符合ATC破骨细胞亚型改变。
有关ATC的细胞起源,目前广泛接受的观点是,ATC来源于之前存在的低侵袭性分化好的甲状腺肿瘤,比如PTC(乳头状癌)和FTC(滤泡癌),通过发生去分化的方式,在ATC中发生EMT,表现为失去上皮和甲状腺的分化标记,随着Vimentin表型的表达,同时伴随TTF- 1和TG表型的丧失[6]。Fuziwara等[7]认为,在ATC中,TGF信号通路诱导EMT的产生,开始表达间叶表型vimentin。在我们的病例中,同样可以观察到,两例ATC均表达vimentin,同时在ATC区域出现TTF- 1和TG表型的丧失,同时其中1例残存少许乳头状癌结构,支持ATC来源于之前存在的低侵袭性分化好的甲状腺肿瘤。
3.2ATC的临床病理特征ATC多见于女性病人,中位年龄70岁,容易表现为结节性甲状腺肿[3]。本研究中,两例患者术前B超检查,均提示甲状腺多发结节,类似于结节性甲状腺肿改变,大体改变具有一定的迷惑性。ATC尽管形态学上分化差,但大约45%-80% 表达PCK[3]。在我们的病例中,也出现上皮标记的部分表达。Becker等[4]指出,PAX- 8似乎可以作为甲状腺滤泡上皮肿瘤一个特异性的标记,在ATC的诊断不明确时,PAX- 8可以作为ATC一个较好的诊断指标,并指出PAX- 8阳性的病人更常见于年轻病人,并且预后更好。但在我们的病例中,PAX- 8均呈阴性反应,或许与病例均为老年患者有关。但PAX- 8是否可以作为ATC的一个诊断指标,还需大样本量的病例研究。有研究者指出[8],使用Ki- 67增殖指数可以对甲状腺滤泡上皮细胞肿瘤进行预后分类,Ki- 67的指数≥10%,加上肿瘤坏死和核异型性的增加等形态学特征,可以提示甲状腺肿瘤的高复发危险性。在我们的病例中,其中1例Ki- 67的指数约为10%,伴随大片坏死及大量的异型核,能够提示该病例预后差。
3.3基因突变目前ATC最常见的基因突变有BRAF和 RAS基因突变,在大约在50%- 60%的ATC中可以观察到,其次是 PIK3CA ,以及一些少见的HRAS,CDKN1B,CDKN2C,CTNNB1,HRAS 和 RET的突变[9]。在我们的病例中,均出现Ras基因突变,其中1例伴随出现PIK3CA基因突变,2例均无BRAF基因突变。
Ras基因编码p21,Ras基因的突变在甲状腺癌的早期发生中起作用,与肿瘤组织的分化有关,但对肿瘤组织的恶性转化不起决定性作用[10]。Ras基因突变热点集中于H- Ras、K- Ras和N- Ras的突变,其中以N- Ras突变最为常见[11]。在我们的病例中,均出现Ras基因突变,并且也以N- Ras突变为主,与文献报道相符。
BRAF基因位于染色体7q34,目前多数观点认为BRAFV600E的突变导致甲状腺肿瘤的恶性转化[12]。有文献报道,良性结节中几乎不发生BRAF V600E的突变,因此认为BRAF V600E的突变对甲状腺癌是特异性较高的诊断标志之一[13]。PIK3CA基因是位于染色体3q26.3上的一段34kb的基因,主要功能是催化4,5- PIP2成为3,4,5- PIP3,而PIP3可作为第二信使结合并激活多种细胞内靶蛋白[14]。有研究者在鼠模型中发现,PIK3CA的突变并不能独立驱动甲状腺肿瘤的产生,只有同时发生PIK3CA和BRAFV600E的突变,小鼠才会发展为ATC[15]。该研究者同时认为,ATC中存在特定的突变特点,即Ras基因的突变与BRAF基因的突变互不相交[15]。在我们的病例中,均出现Ras基因的突变,均未出现BRAF基因的突变,或许与ATC中,这两类基因突变互不相交的突变特点有关。但其中1例Ras基因的突变伴随PIK3CA基因的突变,与文献报道不尽相符,我们推测,PIK3CA基因的突变或许并不能独立驱动甲状腺肿瘤的产生,但未必一定伴随BRAF基因的突变,或许存在其他基因伴随突变的可能。
有研究者发现,BRAF基因突变的ATC主要表现为局灶性的淋巴结转移,而RAS基因突变的ATC主要表现为远距离转移[16]。在我们的两例ATC中,均未行淋巴结清扫,虽然无法获知是否发生了淋巴结的转移,但其中1例出现双肺转移,或许也与Ras基因突变易远距离转移的临床特点有关。
3.4预后根据TNM分期,所有的ATC患者都是IV期[9]。肿瘤的大小,病人的性别,甲状腺外的浸润以及白细胞浸润情况都被认为是ATC的预后因素[2]。小尺寸的ATC,或滤泡型的ATC,起源于分化好的甲状腺肿瘤,通常预后更好[3]。ATC治愈率低的原因在于,晚期肿瘤过大,难以完整切除,存在大约20%- 50%的肺转移率[17]。预后较好的指标有:诊断时无远处转移,肿瘤大小<6- 7 cm,年龄< 65岁[4]。其中淋巴结的转移,是影响ATC预后的关键因素[5]。在我们的两例ATC中,两例均未行淋巴结清扫,无法获得病人的淋巴结转移情况,但其中1例病人术后半年即发生双肺转移,并且肿瘤组织的大小均大于6 cm,其中1例出现脉管内癌栓且年龄>65岁,均提示这两例ATC预后差。
[1]Goicochea L,Staats PN.Anaplastic Thyroid Carcinoma,a Cytologic Perspective: Case Report and Review of Anaplastic Thyroid Carcinoma[J].Pathology Case Reviews,2015,20(5):214.
[2]Yoshida A,Sugino K,Sugitani I,et al.Anaplastic thyroid carcinomas incidentally found on postoperative pathological examination[J].World J Surg,2014,38(9):2311.
[3]Parenti R,Salvatorelli L,Magro G.Anaplastic Thyroid Carcinoma:Current Treatments and Potential New Therapeutic Options with Emphasis on TfR1/CD71[J].Int J Endocrinol,2014:685396.
[4]Becker N,Chernock RD,Nussenbaum B,et al.Prognostic significance of β-human chorionic gonadotropin and PAX8 expression in anaplastic thyroid carcinoma[J].Thyroid,2014,24(2):319.
[5]Lee DY,Won JK,Lee SH,et al.Changes of Clinicopathologic Characteristics and Survival Outcomes of Anaplastic and Poorly Differentiated Thyroid Carcinoma[J].Thyroid,2016,26(3):404.
[6]Champa D,Di Cristofano A.Modeling anaplastic thyroid carcinoma in the mouse[J].Horm Cancer,2015,6(1):37.
[7]Fuziwara CS,Kimura ET.MicroRNA Deregulation in Anaplastic Thyroid Cancer Biology[J].Int J Endocrinol,2014:743450.
[8]Kakudo K,Wakasa T,Ohta Y,et al.Prognostic classification of thyroid follicular cell tumors using Ki- 67 labeling index:risk stratification of thyroid follicular cell carcinomas[J].Endocr J,2015,62(1):1.
[9]Lowe NM,Loughran S,Slevin NJ,et al.Anaplastic thyroid cancer:the addition of systemic chemotherapy to radiotherapy led to an observed improvement in survival- - a single centre experience and review of the literature[J].Scientific World Journal,2014:674583.
[10]周 元,蒋红钢,李 克.甲状腺癌分子标志物研究进展[J].临床与实验病理学杂志,2015,31(5):565.
[11]Fukahori M,Yoshida A,Hayashi H,et al.The association between Ras gene mutations and clinical characteristics in follicular thyroid tumors:new insights from a single center and a large patient cohort[J].Thyroid,2012,22(7):683.
[12]Baquero P1,Sánchez- Hernández I,Jiménez- Mora E,et al.(V600E)BRAF promotes invasiveness of thyroid cancer cells by decreasing E- cadherin expression through a Snail- dependent mechanism[J].Cancer Lett,2013,335(1):232.
[13]Xing M,Alzahrani AS,Carson KA,et al.Association between BRAF V600E mutation and mortality in patients with papillary thyroid cancer[J].JAMA,2013,309(14):1493.
[14]刘田田,毕经旺.PI3K / Akt /mTOR 信号通路与结直肠恶性肿瘤[J].实用医药杂志,2016,33(4):367.
[15]McFadden DG,Vernon A,Santiago PM,et al.p53 constrains progression to anaplastic thyroid carcinoma in a Braf- mutant mouse model of papillary thyroid cancer[J].Proc Natl Acad Sci U S A,2014,111(16):E1600.
[16]Landa I,Ibrahimpasic T,Boucai L,et al.Genomic and transcriptomic hallmarks of poorly differentiated and anaplastic thyroid cancersr[J].J Clin Invest,2016,126(3):1052.
[17]Ursino S,Fiorica F,Stefanelli A,et al.Anaplastic thyroid cancer:a case report of a long term survival patient and review of literature data[J].Eur Rev Med Pharmacol Sci,2014,18(9):1368.

