PM2.5与心血管疾病住院患者血清TNF-α表达的相关性研究
贺晓楠,张 城,曹 璇,陈 宇*
(1.首都医科大学附属北京安贞医院 急诊危重症中心,北京100029;2.吉林大学中日联谊医院 心内科,吉林 长春130033)
最近,世界卫生组织发布了2017年世界卫生统计报告,指出心血管疾病是占首位的致死原因。近年来城市雾霾问题日益严重,其重要成分PM2.5是指空气动力学直径≤2.5 μm的颗粒物,是城市空气中的主要污染物。流行病学研究表明短期和长期的暴露于高浓度的PM2.5与心血管疾病的发病率和死亡率存在相关性[1,2]。目前,尚缺乏关于PM2.5和心血管疾病危险的相关性潜在的分子机制的研究。有研究表明PM2.5可能通过氧化应激和炎症反应导致信号分子释放至循环系统[3,4]。本文旨在探讨PM2.5与心血管疾病住院患者TNF-α表达的相关性。
1 对象与方法
1.1研究对象
选取为2015年10月-2016年4月吉林大学中日联谊医院心血管内科门诊及急诊收入住院心血管疾病患者92名,其中冠心病65例,非冠心病27例(心律失常、高血压或心功能不全等)。排除标准:发热及感染性疾病;自身免疫性疾病如动脉炎、类风湿性关节炎、系统性红斑狼疮;慢性阻塞性肺疾病;吸烟。同期长春地区的PM2.5浓度值来源于我国环境保护部发表的数据,根据PM2.5浓度值(0-75 μg/m3污染指数优良组;75-115 μg/m3污染指数轻度组;>115 μg/m3污染指数中重组)将入选患者分为A组、B组、C组。其中A组患者20名、B组患者20名、C组患者52名。其中A组冠心病患者15名,非冠心病患者5名;B组中冠心病患者13名,非冠心病患者7名;C组中冠心病患者37名,非冠心病患者15名。
1.2方法
记录患者入院当日长春市PM2.5浓度。同时收集患者的年龄、性别、是否冠心病以及入院后中性粒细胞计数(NEUT)、淋巴细胞计数(LYM)、单核细胞计数(MONO)、血小板计数(PLT)。入院后即刻留取肘前静脉血,应用ELISA测定血清TNF-α浓度。
1.3统计学方法
采用 SPSS 17.0 软件对数据进行分析,选择χ2检验进行统计分析。检验水准为0.05,P<0.05表示差异具有统计学意义。
2 结果
2.1经分析A组、B组及C组研究对象在年龄、性别均无统计学差异(P>0.05),可认为除外了研究对象间的性别、年龄对NEUT、LYM、MONO、TNF-α的影响,提高了PM2.5对以上指标影响的研究的可靠性。近年认为动脉粥样硬化的形成就是免疫驱动导致氧化脂质的积累的过程,考虑到冠心病患者TNF-α等炎症因子水平高于非冠心病者,进一步应用卡方检验比较三组研究对象的冠心病及非冠心病患者比例结果无显著差异(P=0.780)(见表1、表2)。

表1 A组、B组、C组年龄、CRE、ALT比较


表2 A组、B组、C组性别、冠心病/非冠心病分布比较
备注:检验水准为0.05
2.2比较研究对象短期暴露于不同浓度PM2.5后其外周静脉血中NEUT、LYM、MONO、PLT、TNF-α水平:A组、B组及C组NEUT、MONO、PLT无显著差异(P>0.05)。A组、B组及C组TNF-α浓度差异显著(P<0.05)(表3)。
2.3比较A组、B组、C组两两组间LYM、TNF-α。C组LYM高于B组(P<0.0017),差异具有统计学意义,A组与B组间无明显差异。C组血清TNF-α浓度显著高于A组及B组(P<0.017);B组的中值稍高于A组,但P>0.017,差异无统计学意义。见表4、5,图1、2。

表3 A组、B组、C组血常规、TNF-α比较[M(P25,P75)]
备注:检验水准为0.05,*表示差异具有统计学意义
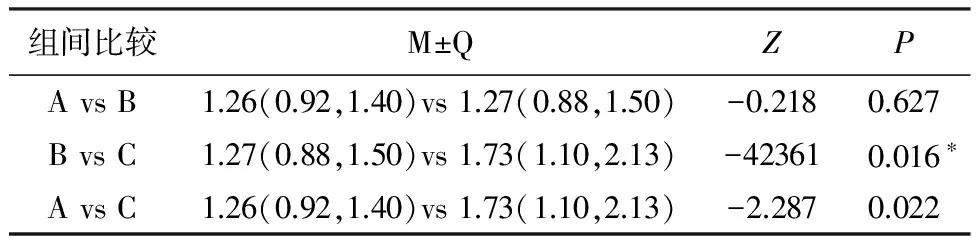
表4 A组、B组、C组LYM比较[M(P25,P75)]
备注:检验水准为0.017,*表示差异具有统计学意义

图1 A组、B组、C组间LYM箱线图
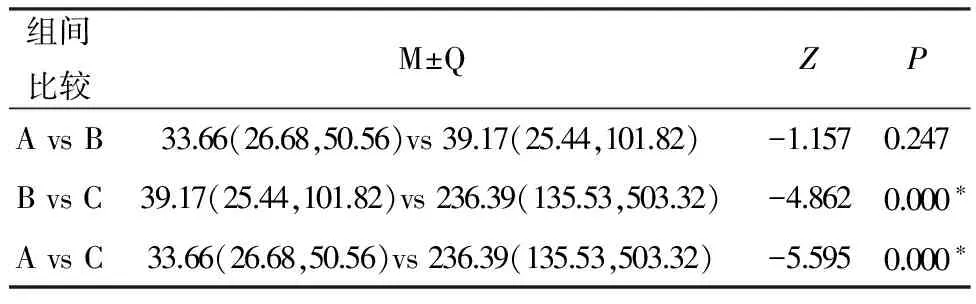
组间比较M±QZPAvsB33.66(26.68,50.56)vs39.17(25.44,101.82)-1.1570.247BvsC39.17(25.44,101.82)vs236.39(135.53,503.32)-4.8620.000∗AvsC33.66(26.68,50.56)vs236.39(135.53,503.32)-5.5950.000∗
备注:检验水准为0.05,*表示差异具有统计学意义
3 讨论
本研究发现短期暴露于不同严重程度空气污染之后,患者血小板计数及单核细胞计数改变无显著性。考虑可能与心血管患者均常年口服阿司匹林和(或)氯吡格雷等抗血小板药物相关。以往有研究发现吸入细颗粒物后机体循环或肺泡灌洗液中单核细胞数量增加[5,6],而本实验并没有得到相似的结果。
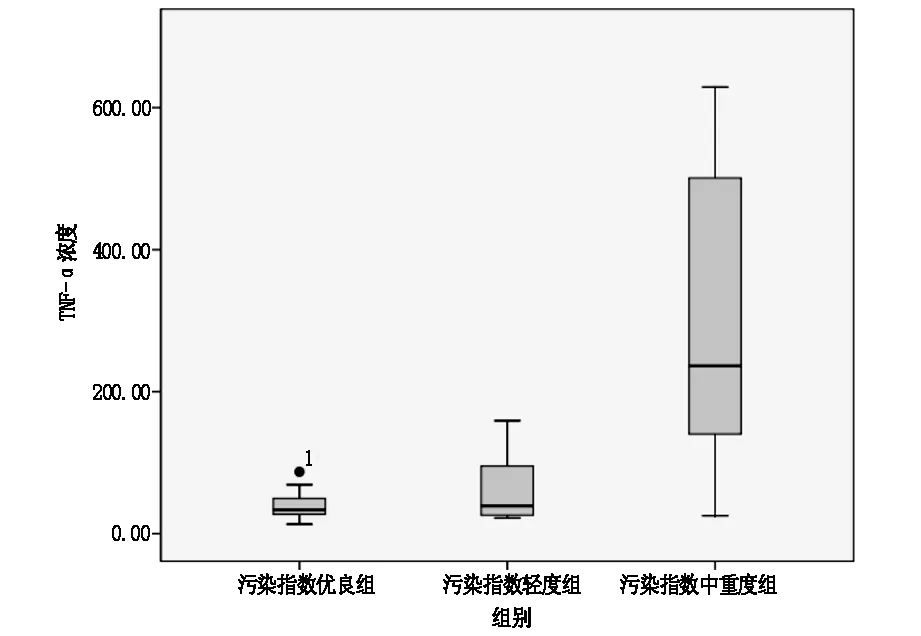
图2 A组、B组、C组TNF-α比较
考虑可能与PM2.5成分的地区异质性相关,也不能除外本次研究中对象的暴露时间不足。
本研究发现短时间暴露于PM2.5后人体内的TNF-α水平显著增加。既往研究报道发现TNF-α等炎症因子水平能预测健康个体未来发生心肌梗死的风险[7]。而且大量实验也已证明TNF-α具有诱导血管发生炎症且能减弱血管的舒张功能,其机制为TNF-α损害血管内皮的NO依赖性信号传导,并减低NO的生物利用度;也可降低内皮一氧化氮合酶(eNOS)的表达水平,从而减少内源性NO生成;并且TNF-α可增加与受体解偶联及内皮功能障碍相关的诱导型一氧化氮合酶(iNOS)表达水平[8,9]。
同时本研究发现心血管患者短期暴露于PM2.5浓度范围在75 μg/m3到115 μg/m3的自然环境中后其血清TNF-α浓度较暴露于空气优良环境中(PM2.5浓度小于75 μg/m3)后的差异无统计学意义,暴露于较高浓度PM2.5环境后心血管患者循环内TNF-α水平显著高于暴露于相对低浓度的PM2.5环境中,考虑可能与暴露时间不足相关。以往大量研究证明短期或长期暴露于细颗粒物均可以导致机体内的炎症反应及相关因子明显增加,但也有研究未得到类似的结果。如Jette等人将健康成年人呼吸含一定浓度细颗粒物的空气5 h后,发现其外周血单核细胞内活性氧、炎症相关基因的表达、氧化应激反应水平前后变化并不明显[10]。还有Pope CA等人发现健康成年人接触颗粒物3小时后其血管舒缩功能并无改变[11]。但也不能除外就是缘于空气中较低的PM2.5浓度不足以引起暴露于其中的个体血清TNF-α及表达水平发生显著变化。目前尚无大样本研究关于引起暴露于其中的人群的TNF-α等炎症介质表达显著增加的大气中的最低PM2.5浓度,这方面需要将来更多的研究来明确。
近年认为冠心病患者体内的TNF-α等炎症因子表达水平高于非冠心病者,动脉粥样硬化的形成就是免疫驱动导致氧化脂质的积累的过程[12],PM2.5能导致个体的血清TNF-α、IL-6、IL-1β、ICAM-1等显著增加。而这些炎症因子多数是通过参与体内的免疫调节反应来促动脉粥样硬化。目前临床上抗动脉硬化的药物最为常见的是他汀类药物以及阿司匹林。Angel K等人研究发现对关节炎患者进行维持3个月的抗TNF-α治疗能明显改善其主动脉硬化。此后Angel K等人又进行对类风湿关节炎或有抗TNF-α治疗的临床适应症的患者,予以维持1年的抗TNF-α治疗。随访1年,发现与对照组相比,抗TNF-α治疗明显延缓了患者颈动脉内膜中膜厚度进展,其动脉硬化也得到明显改善[13]。
根据Angel K等人的研究结果即抗TNF-α治疗能延缓动脉粥样硬化的进展以及可改善动脉弹性,将来将免疫抑制剂广泛应用于抗冠状动脉粥样硬化及狭窄的治疗是非常令人期待的进展。但由于免疫抑制剂可能导致机体免疫力下降,导致机体易感染结核,发生肿瘤的风险增加,因而需要大量实验研究来探索这个问题。
[1]Wang C,Tu Y,Yu Z,et al.PM2.5 and Cardiovascular Diseases in the Elderly: An Overview[J].Int J Environ Res Public Health,2015,12(7):8187.
[2]Turner MC,Cohen A,Burnett RT,et al.Interactions between cigarette smoking and ambient PM for cardiovascular mortality[J].Environ Res,2017,154:304.
[3]Cantone L,Iodice S,Tarantini L,et al.Particulate matter exposure is associated with inflammatory gene methylation in obese subjects[J].Environ Res,2017,152:478.
[4]Fiordelisi,A.,Piscitelli,P.,Trimarco,B.et al.The mechanisms of air pollution and particulate matter in cardiovascular diseases[J].Heart Fail Rev,2017,22(3):337.
[5]Patel MM,Chillrud SN,Deepti KC,et al.Traffic-related air pollutants and exhaled markers of airway inflammation and oxidative stress in New York City adolescents[J].Environ Res,2013,121 71.
[6]Guerra R,Vera-Aguilar E,Uribe-Ramirez M,et al.Exposure to inhaled particulate matter activates early markers of oxidative stress,inflammation and unfolded protein response in rat striatum[J].Toxicol Lett,2013,222(2):146.
[7]Ridker PM,Hennekens CH,Buring JE,et al.C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women[J].N Engl J Med,2000,342:836.
[8]Zhao J,Suyama A,Tanaka M,et al.Ferulic acid enhances the vasorelaxant effect of epigallocatechin gallate in tumor necrosis factor-alpha-induced inflammatory rat aorta.J Nutr Biochem,2014,25(7):807.
[9]Dalaklioglu S,Tasatargil A,Kale S,et al.Metastatic breast carcinoma induces vascular endothelial dysfunction in Balb-c mice: Role of the tumor necrosis factor-α and NADPH oxidase[J].Vascul Pharmacol,2013,59(3-4):103.
[10]Hemmingsen JG,Jantzen K,Møller P,et al.No oxidative stress or DNA damage in peripheral blood mononuclear cells after exposure to particles from urban street air in overweight elderly[J].Mutagenesis,2015,30:635.
[11]C.Arden Pope 3rd,Jaron C.Hansen,Roman Kuprov,et al.Vascular Function and Short-Term Exposure to Fine Particulate Air Pollution[J].J Air Waste Manag Assoc,2011,61:(8):858.
[12]Ridker PM,Rifai N,Rose L,et al.Comparison of C-reactive protein and low-density lipoprotein cholesterol levels in the prediction of first cardiovascular events[J].N Engl J Med,2002,347:1557.
[13]Angel K,Provan SA,Fagerhol MK,et al.Effect of 1-year anti-TNF-α therapy on aortic stiffness,carotid atherosclerosis,and calprotectin in inflammatory arthropathies: a controlled study[J].Am J Hypertens,2012,25(6):644.

