交叉引物等温扩增-核酸试纸条技术检测蜡样芽孢杆菌
□ 刘 敏 莱芜检验检疫局
蜡样芽孢杆菌(Bacillus cereus)是比较常见的引发食源性疾病的病原菌[1]。目前,用于蜡样芽抱杆菌的检测方法有常规平板培养筛选法、PCR、酶反应法、免疫学技术等。近年发展起来的交叉引物等温扩增技术(Cross Priming Amplification,CPA)对仪器设备的要求低[2]。本文拟结合交叉引物等温扩增技术和核酸试纸条技术,建立一种高灵敏、高通量、特异性好、操作简捷的蜡样芽胞杆菌快速检测方法。
1 材料与方法
1.1 试验材料
1.1.1 菌种与试剂
蜡样芽孢杆菌(ATCC7064)、沙门氏菌(ATCC14028)、大肠埃希氏菌(ATCC25922)、金黄色葡萄球菌(ATCC6538)和志贺氏菌(ATCC12022)均为莱芜检验检疫局技术中心冻存菌株。甜菜碱、MgS04购自Sigma公司,DNA Ladder Marker、BstDNA聚 合 酶、dNTPs、10×PCR Buffer、10×loading Buffer、rTaq DNA 和DNA快速提取试剂盒购自TaKaRa公司,核酸检测试剂条和检测装置购自杭州优思达生物技术有限公司。试验中所涉及的微生物培养基均购自北京陆桥公司。
1.1.2 CPA引物与探针的设计
CPA引物及探针序列如表1所示。
1.2 试验方法
1.2.1 菌株DNA模板的制备
分别接种蜡样芽孢杆菌菌株及非蜡样芽孢杆菌菌株于营养琼脂平板上,培养18~24h后抽提单菌落细菌DNA,-20℃保存待用。

表1 CPA引物及探针序列
1.2.2 目的基因重组克隆质粒的构建
以蜡样芽孢杆菌基因组为模板,用外围引物进行PCR扩增,琼脂糖凝胶电泳检测扩增产物。该PCR反应体系为 BCOF 0.8μmol/L 、BCOR 0.8 μmol/L、10×PCR Buffer 2.5 μL、dNTPs 2.0 μL 以 及 rTaq 0.3 μL,加水补足至25.0 μL。反应条件:94℃ 5min;94℃ 30s、60℃ 30s、72℃30s,30个循环;72℃5min。1%琼脂糖凝胶电泳验证PCR产物是否与目的片段大小一致。切胶回收转化至感受态细胞,提取重组克隆质粒进行测序分析,验证产物是否为蜡样芽孢杆菌核酸反应的特异性目标片段。
1.2.3 CPA反应体系的建立与优化
以蜡样芽孢杆菌基因组为模板,用1对外围引物、1对交叉引物及2条标记后的探针,按照通用的CPA扩增条件组成20 μl的反应体系。在63℃恒温条件下反应60min,凝胶电泳对扩增产物进行检测,验证用于CPA扩增的引物及探针是否可行[3]。
1.2.4 CPA结合核酸试纸条法判定检测结果
取扩增产物,采用核酸试纸条进行结果判定。当检测线和质控线同时出现红色条带,则判为阳性,表明样本中含有被检测的目标核酸产物。若检测线没有条带出现,而只有质控线出现红色条带,则判为阴性,表明未检测出目的核酸产物[4]。
2 结果与分析
2.1 蜡样芽孢杆菌gyrB基因片段阳性克隆质粒的构建与验证
电泳结果表明,该扩增片段与目的序列一致,其大小约为330bp,测序结果也表明该PCR扩增产物即为蜡样芽孢杆菌gyrB基因的特异性序列。
2.2 CPA扩增反应体系的优化结果
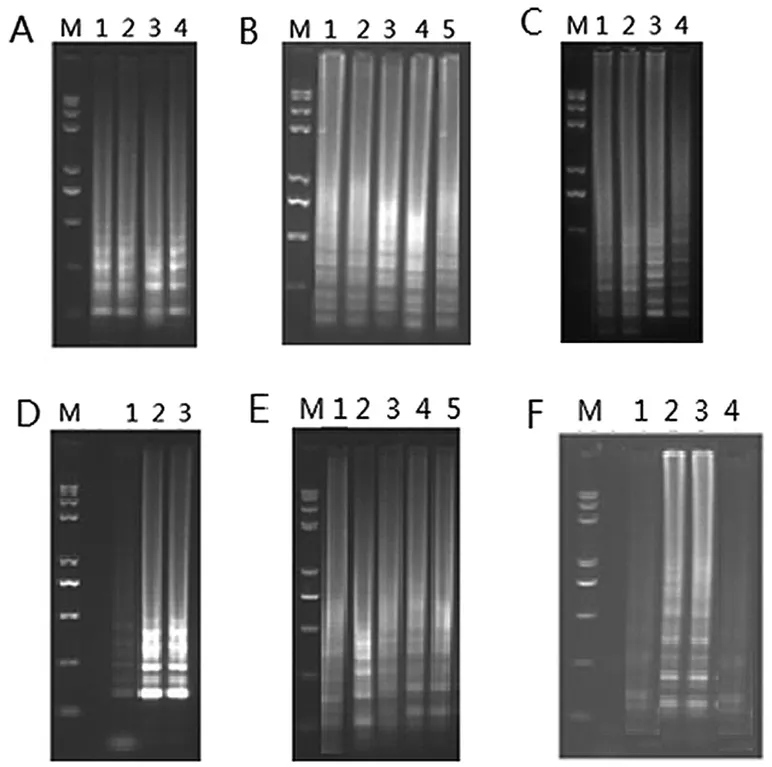
图1 CPA扩增反应体系的优化
结果如图1所示,A中当Mg2+浓度为3.0~4.5mmol/L时,均出现电泳条带;但当Mg2+浓度为4.0mmol/L时,条带最亮,即为最佳Mg2+使用浓度。B中,dNTPs浓度在0.2~0.6mmol/L范围内均能发生有效扩增,但当浓度为0.5mmol/L时,电泳条带最亮,即为最佳dNTPs浓度。C中,在甜菜碱浓度为0.6~1.2mol/L时均有较清晰的电泳条带出现,且亮度随着甜菜碱浓度增大而增大,当1.0mol/L时条带最亮,即甜菜碱的最佳浓度。D中,当Bst DNA polymerase浓度为8U和10U时电泳条带最亮,且目测二者亮度基本相当,为节约试验成本,选取8.0U为最佳的Bst DNA polymerase使用浓度。E中,当温度为60℃时,出现较为明显的电泳条带,最亮条带出现在62℃,高于此温度后,扩增条带开始变暗,则最佳反应温度为62℃。F中,当反应时间为30min时CPA反应无法发生,45min时有轻微的扩增条带出现但较暗,最亮电泳条带出现在60~75min,反应时间超过75min后条带逐渐变暗,则最佳反应时间为60min。
3 讨论
本研究针对蜡样芽胞杆菌特异性基因gyrB保守区域设计引物进行交叉引物恒温扩增,建立了可用于快速筛选蜡样芽胞杆菌的CPA-核酸试纸条法。在该反应体系的建立过程中,通过分析比较反应体系中多个因素的优化结果,发现Mg2+、dNTPs、甜菜碱、Bst DNA polymerase浓度以及反应温度、反应时间均能影响检测效果。但该方法的检测灵敏度有待进一步研究。

