响应面分析法优化菠萝皮渣多糖提取工艺研究
赵巧丽,庞振才,张广明,刘玉革,胡会刚
(中国热带农业科学院南亚热带作物研究所,广东湛江524091)
菠萝(Ananas comosus),又名凤梨、旺梨,是热带四大名果之一,具有解暑止渴、降压利尿和消食止泻等功效。据不完全统计,我国热带地区菠萝种植面积达6.7万公顷,产量达144万吨[1]。在菠萝鲜食和加工过程中会产生大量皮渣,其重量约为全果的50%~60%,每年几乎都被大量丢弃,不仅造成资源浪费,还加重了环境污染。有研究表明,菠萝皮渣中总糖、水分和柠檬酸的比例与果肉相差无几[1],若对这部分废弃物加以综合利用,对于延长菠萝产业链,指导其精深加工具有重要意义。
多糖是菠萝皮渣的主要活性成分之一[2-6],具有抗氧化[7-9]、抗脂质过氧化[10]和抗肿瘤[11]作用,同时还可改善肠道内环境[12]、抑制T和B淋巴细胞增殖[13]、增强断奶猪仔的抗病能力[14]。近年来,有关菠萝皮渣多糖的提取工艺已有一些报道,王诗标等[15]研究用超声波辅助提取菠萝皮渣多糖并分析其抗氧化活性。罗建平[8]和郭巧玲等[12]研究用热水提取菠萝皮渣多糖,但提取时间较长,效率不高。目前,有关超声波辅助热水法提取菠萝皮渣多糖的研究尚未见报道,基于此,本研究将超声波辅助热水提取技术应用于菠萝皮渣的提取,在单因素试验的基础上,采用Plackett-Burman试验设计和Box-Behnken中心组合设计优化提取工艺参数,旨在为菠萝加工副产物的高效利用提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
菠萝皮渣:雷州市英利镇红土地菠萝皮综合利用厂。
无水葡萄糖:美国Sigma公司;浓硫酸:廉江市爱廉化试剂有限公司;苯酚:天津市福晨化学试剂厂;无水乙醇:天津市富宇精细化工有限公司。
1.1.2 仪器与设备
DHG 9140A电热鼓风干燥箱:上海一恒科学仪器有限公司;GL-20G-II高速冷冻离心机:美国Thermo公司;RE-3000B旋转蒸发仪:德国海道尔夫公司;UV-2550型紫外分光光度计:日本岛津公司;PS-30ALD超声波清洗仪:深圳市洁康清净电器有限公司;HH-4恒温水浴锅:金坛区华城润华实验仪器厂;SHZ-D(III)循环水式多用真空泵:巩义市英峪高科仪器。
1.2 方法
1.2.1 原料预处理
将收集到新鲜的菠萝皮渣剔除大颗粒杂质,用蒸馏水洗净后沥去水分,置于烘箱中55℃干燥36 h,经粉碎机粉碎后过40目筛,得菠萝皮渣干粉。取适量菠萝皮渣干粉,加入适量80%乙醇室温搅拌浸泡2 h,抽滤,再将菠萝皮渣置于55℃烘箱中烘干,得去除小分子杂质的菠萝皮渣干粉,储存于干燥器中备用。
1.2.2 菠萝皮渣多糖的提取工艺流程
称取菠萝皮渣干粉1.0 g→按料液比要求加入适量蒸馏水→复溶30 min→根据预设定的条件采用超声波协同热水法提取→离心(6 000 r/min,10 min)→取上清液→浓缩→醇沉(乙醇终浓度80%,4℃静置过夜)→离心(4 000 r/min,10 min)→收集沉淀→用蒸馏水溶解沉淀即得菠萝皮渣多糖溶液
1.2.3 菠萝皮渣多糖含量的测定
1.2.3.1 标准曲线的制作
参考王文平等[16]的方法,并稍作修改。精确吸取质量浓度为 100 μg/mL 葡萄糖标准溶液 0.0、0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL 于具塞试管中,各加蒸馏水补至2.0 mL。依次加入1.0 mL新配制得6%苯酚溶液,摇匀后缓慢加入5.0 mL浓硫酸,振荡均匀后静置5 min,于沸水浴中加热15 min,取出后在冷水浴中迅速冷却至室温;用2.0 mL蒸馏水按同样操作作空白,在波长490 nm处测定吸光度。由测得的吸光度和葡萄糖标准溶液浓度绘制标准曲线,得到回归方程y=0.011 0x-0.000 2,式中:x为葡萄糖浓度(mg/mL);y为吸光度,R2=0.999 4,即葡萄糖浓度在0~0.07 mg/mL范围内与吸光度呈现良好的线性关系。
1.2.3.2 样品多糖得率的测定
取稀释后的样品溶液1.0 mL于刻度试管中,以蒸馏水为对照,按上述方法测定吸光度,根据标准曲线计算多糖含量,根据下式求出各试验组菠萝皮渣多糖的得率。

式中:C为样液中所测葡萄糖的浓度,mg/mL;V为溶液定容体积,mL;N为样品溶液的稀释倍数;M为菠萝皮渣干粉质量,g。
1.2.4 单因素试验
在固定水浴浸提时间1 h、料液比1∶30(g/mL)、超声水浴温度50℃、超声功率160 W、超声时间20 min的条件下,考察不同水浴浸提温度(60、70、80、90、100℃)对菠萝皮渣多糖得率的影响;在固定水浴浸提温度90℃、料液比1∶30(g/mL)、超声水浴温度50℃、超声功率160 W、超声时间20 min的条件下,考察不同水浴浸提时间(1.0、1.5、2.0、2.5、3.0 h)对菠萝皮渣多糖得率的影响;在固定水浴浸提温度90℃、水浴浸提时间2.5 h、超声水浴温度50℃、超声功率160 W、超声时间20 min的条件下,考察不同料液比[1∶20、1∶30、1 ∶40、1 ∶50、1 ∶60(g/mL)]对菠萝皮渣多糖得率的影响;在固定水浴浸提温度90℃、水浴浸提时间2.5 h、料液比1∶50(g/mL)、超声水浴温度50℃、超声时间20 min 的条件下,考察不同超声功率(40、80、120、160、200 W)对菠萝皮渣多糖得率的影响;在固定水浴浸提温度90℃、水浴浸提时间2.5 h、料液比1∶50(g/mL)、超声功率120 W、超声时间20 min的条件下,考察不同超声水浴温度(40、50、60、70、80 ℃)对菠萝皮渣多糖得率的影响;在固定水浴浸提温度90℃、水浴浸提时间2.5 h、料液比1∶50(g/mL)、超声水浴温度60℃、超声功率120 W条件下,考察不同超声时间(20、40、60、80、100 min)对菠萝皮渣多糖得率的影响。
1.2.5 Plackett-Burman试验设计
在单因素试验的基础上,利用Plackett-Burman试验设计法,对影响菠萝皮渣多糖得率的6个因素进行评价,筛选出主效应因子,每个因素设置低(-1)和高(+1)两个水平,共12个试验组合。另外安排3个空项X3、X6、X9,用于误差分析。试验因素及水平取值见表1。

表1 Plackett-Burman试验因素及水平Table 1 Plackett-Burman experimental factor and level
1.2.6 最陡爬坡试验
响应面拟合方程只有在考察结果的临近区域内才能充分接近真实结果,因此要在逼近最佳区域后才能建立有效的响应面拟合方程[17]。根据Plackett-Burman试验筛选出对菠萝皮渣多糖得率影响显著的因素,以及各显著因素的正负效应来确定最陡爬坡试验的变化方向及步长,快速逼近最大响应区域。
1.2.7 响应面试验设计
依据Plackett-Burman试验结果,固定水浴提取时间2.5 h、超声水浴温度60℃、超声功率120 W,选取水浴浸提温度、料液比和超声时间3个因素为自变量,以菠萝皮渣多糖得率为响应值,根据Box-Behnken试验设计的方法,进行三因素三水平的响应面优化试验,因素及水平编码见表2。

表2 Box-Benhnken设计因素及水平编码Table 2 Factors and levels in Box-Benhnken design
2 结果与分析
2.1 单因素试验结果
2.1.1 水浴浸提温度对菠萝皮渣多糖得率的影响
水浴浸提温度对菠萝皮渣多糖得率的影响见图1。

图1 水浴浸提温度对多糖得率的影响Fig.1 Effect of waterbath extraction temperature on the yield of polysaccharide
由图1可知,在60℃~80℃的水浴中进行热处理,菠萝皮渣多糖的提取量随着水浴温度的升高增大趋势较缓,当水浴温度达到80℃后,多糖提取量迅速增大,呈明显上升趋势,在温度为100℃时达到最大。由此说明水浴温度的适度提高对植物组织的浸润具有一定的促进作用[18],有利于多糖的溶出。因此选择水浴浸提温度为80℃~100℃进行后续试验。
2.1.2 水浴浸提时间对菠萝皮渣多糖得率的影响
水浴浸提时间对菠萝皮渣多糖得率的影响见图2。
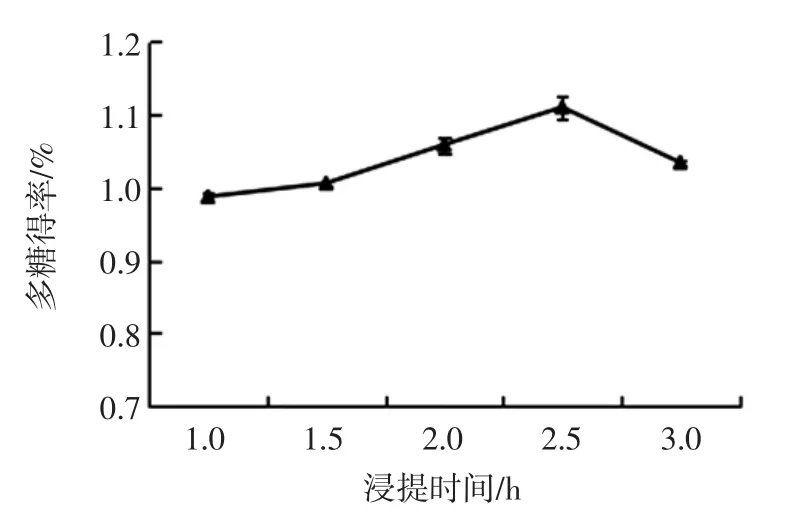
图2 水浴浸提时间对多糖得率的影响Fig.2 Effect of waterbath extraction time on the yield of polysaccharide
由图2可知,在1.0 h~2.5 h内,菠萝皮渣多糖得率随着水浴时间的延长显著增加,当水浴时间为2.5 h时,多糖得率达到最大。2.5 h后,随着时间的延长,多糖得率略有降低。水浴时间过短,达不到分离提取效果,进而影响多糖得率;水浴时间过长,溶出的多糖长时间暴露在外,导致多糖分解或结构发生变化[19],最终影响多糖得率,因此选取水浴浸提时间为2.0 h~3.0 h为宜。
2.1.3 料液比对菠萝皮渣多糖得率的影响
料液比对菠萝皮渣多糖得率的影响见图3。

图3 料液比对多糖得率的影响Fig.3 Effect of solid-to-liquid ratio on the yield of polysaccharide
由图 3 可知,料液比在 1 ∶20(g/mL)~1∶50(g/mL)范围内,菠萝皮渣多糖得率随着溶剂体积的增大而增大,在料液比为1∶50(g/mL)时多糖得率达到最大,此后继续增大料液比,多糖得率增大不显著。这可能是因为样品质量一定时,料液比过小,物料黏度大,导致多糖溶出受阻;随着溶剂量的增加多糖浸提越完全,当多糖完全溶出时,继续增加溶剂量对提取率影响不大。综合考虑溶剂用量及后续浓缩能耗等问题,选择料液比为 1∶40(g/mL)~1∶60(g/mL)为宜。
2.1.4 超声功率对菠萝皮渣多糖得率的影响
超声功率对菠萝皮渣多糖得率的影响见图4。

图4 超声功率对多糖得率的影响Fig.4 Effect of ultrasonic power on the yield of polysaccharide
由图4可知,菠萝皮渣多糖得率在40 W~120 W范围内随着超声功率的增大而增大,当超声功率为120 W时,多糖得率达到最大,此后继续增加超声功率,多糖得率逐渐降低。这可能是因为随着超声功率的增加,超声波产生的空化效应和振动加强,对细胞壁的破碎作用不断增大,有利于多糖的扩散溶出。当功率达到一定程度后,溶出的多糖在高功率的超声波作用下糖苷键被打断,结构遭破坏,进而导致多糖得率降低[20]。因此,选择超声功率在80W~160 W为宜。
2.1.5 超声水浴温度对菠萝皮渣多糖得率的影响
超声水浴温度对菠萝皮渣多糖得率的影响见图5。

图5 超声水浴温度对多糖得率的影响Fig.5 Effect of ultrasonic-waterbath temperature on the yield of polysaccharide
由图5可知,在40℃~60℃范围内,升高温度能提高菠萝皮渣多糖的得率,当温度超过60℃时,多糖得率逐渐降低。这可能是因为高温会引起细胞膜结构的变化[21],有利于多糖溶出到溶剂中,但过高的温度又会引起多糖结构发生变化[22],最终影响多糖得率。所以,选取超声水浴温度为50℃~70℃为宜。
2.1.6 超声时间对菠萝皮渣多糖得率的影响
超声时间对菠萝皮渣多糖得率的影响见图6。

图6 超声时间对菠萝皮渣多糖得率的影响Fig.6 Effect of ultrasonic time on the yield of polysaccharide
由图6可知,在20 min~40 min范围内,菠萝皮渣多糖得率随着超声时间的延长逐渐增大,当超声40min时,多糖得率达到最大。40 min后,随着时间的延长,多糖得率逐渐下降。由Fick扩散定律可知得率与提取时间呈正比,在一定的条件下,超声时间越长多糖得率越高[21];但时间太长会使扩散次数降低,反而影响多糖得率。故选择超声时间为20 min~60 min为宜。
2.2 Plackett-Burman试验设计对关键影响因素的确定
Plackett-Burman试验设计及结果见表3。利用Mintab 17软件对试验结果进行方差分析,结果见表4。

表3 Plackett-Burman试验设计与结果Table 3 Plackett-Burman experiment design and results

表4 偏回归系数及显著性检验Table 4 Partial regression coefficients and their significance test
由表4可知,决定系数R2=0.987 1,校正系数R2Adj=0.928 8,说明与多糖得率相关的因素中,由此模型解释的已经超过92%,试验设计可靠。其中X1(水浴浸提温度)、X4(料液比)、X8(超声时间)是影响菠萝皮渣多糖得率的主要因素,且对多糖得率的影响在0.05水平上存在显著差异。所以在下一步的响应面分析中,重点考察这3个因素的最优水平范围。对于其余的因素,在后续试验中均选择单因素试验中的最优水平,具体取值为:水浴浸提时间2.5 h、超声功率120 W、超声水浴温度60℃。
2.3 最陡爬坡试验结果
最陡爬坡试验结果见表5。
由表5可知,随着水浴浸提温度和料液比的减小,超声时间的增加,多糖得率呈先增大后减小趋势,在水浴浸提温度为90℃、料液比为1∶50 g/mL、超声时间为40 min时,多糖得率达到最大,即把第2组试验的3个因素的变量值设为中心点进行后续响应面优化试验。

表5 最陡爬坡试验设计及结果Table 5 Steepest ascent experimental design and results
2.4 响应面分析结果
响应面试验方案及结果见表6。

表6 Box-Benhnken试验设计及结果Table 6 Box-Benhnken design and results
利用Design-Expert 8.0.6软件对表6数据进行二次回归分析,得到二次多项回归方程为:

式中:Y为菠萝皮渣多糖得率;A为水浴浸提温度;B为料液比;C为超声时间。对二元回归方程的模型进行显著性检验及方差分析,结果见表7。
由表7可知,回归模型P<0.000 1,达到极显著(P<0.01),在统计学上有意义。失拟项的P>0.05,因此可用该回归方程代替试验真实点对试验结果进行分析。模型的校正决定系数R2=0.976 7,说明模型拟合程度较好,能够准确可靠地预测和分析多糖得率的大小。方程的一次项 A、B,二次项 A2、B2、C2对多糖得率影响极显著,一次项C对多糖得率影响显著,交互项AB、AC、BC对多糖得率均无显著影响。3个因素对多糖得率的影响主次顺序为A>B>C,即水浴浸提温度>料液比>超声时间。
各因素交互作用对菠萝皮渣多糖得率影响的响应面图见图7。

表7 回归方程方差分析Table 7 Variance analysis for the established regression model


图7 各因素交互作用对菠萝皮渣多糖得率影响的响应面图Fig.7 Response surface polts showing the interactive effects of three extraction parameters on the extraction yield of pineapple pomace polysaccharide
由图7a可知,在料液比一定的条件下,多糖得率随着水浴浸提温度的升高而增大,且变化较为明显。在水浴浸提温度一定的条件下,多糖得率随着料液比的增大呈先增大后减小趋势,其变化不明显。由等高线图可知沿水浴浸提温度方向等高线密集,说明水浴温度对多糖得率的影响比料液比大,等高线非椭圆形,说明两个因素的交互作用不显著。由图7b可知,当超声时间一定时,多糖得率随着水浴浸提温度的升高不断增大,变化较明显。而在水浴浸提温度一定的情况下,多糖得率随着超声时间的延长先增大后减小,变化不明显,说明水浴温度对多糖得率的影响比超声时间大。由等高线可知两个因素的交互作用不显著。由图7c可知,在超声时间一定时,多糖得率随着料液比的增加先增大后减小,在料液比一定时,多糖得率随着超声时间的增加也呈现先增大后减小趋势,当二者均处于中间水平时多糖得率达到最大,但两个因素的交互作用不显著。
通过Design Expert 8.0.6软件求解回归方程得到菠萝皮渣多糖的最佳提取工艺条件为:水浴浸提温度98℃,料液比 1∶53(g/mL),超声时间 42 min,预测多糖得率为1.67%;但考虑到实际操作的局限性,将菠萝皮渣多糖的提取工艺参数修正为:水浴浸提温度98℃,料液比1∶50(g/mL),超声时间40 min;为了验证模型的可靠性,采用上述预测最佳工艺条件进行提取试验,重复3次,测得多糖得率为1.62%,与模型预测值相近,证明模型有效,所得的菠萝皮渣多糖的提取条件具有实际应用价值。
3 结论
Plackett-Burman试验设计可以快速、有效地通过较少的试验从众多影响菠萝皮渣多糖得率的因素中筛选出主要的影响因素,避免了非主要因素可能造成的浪费时间和资源的缺陷。而响应面分析法是一种优化多变量系统的有效试验工具,它能够找出整个区域上因素的最佳组合和响应值的最优值,克服了传统正交试验的缺陷。目前,对菠萝皮渣多糖的提取工艺报道研究多采用正交设计法优化,这在实际应用中受到诸多限制。本试验通过Plackett-Burman试验设计、最陡爬坡试验以及在此基础上的三因素三水平响应面优化试验,建立了菠萝皮渣多糖得率与各影响因素间的数学模型,并依此模型预测了菠萝皮渣多糖的得率,同时结合实际条件确定出菠萝皮渣多糖的最佳提取工艺参数为:水浴浸提温度98℃、水浴浸提时间2.5 h、料液比 1∶50(g/mL)、超声功率 120 W、超声水浴温度60℃、超声时间40 min,在此条件下,菠萝皮渣多糖理论得率为1.67%,实际得率为1.62%,相差2.99%,说明所建立的数学模型预测的菠萝皮渣多糖得率与实际多糖得率偏差较小,吻合度好,可作为菠萝皮渣多糖的提取工艺。
[1]吴靖.菠萝皮渣中纤维素成分的提取和作为染料吸附剂的改性研究[D].广州:华南理工大学,2010:14-15
[2]Smith B G,Harris P J.Polysaccharide composition of unlignified cell walls of pineapple[Ananas comosus(L.)Merr]fruit[J].Plant Physiology,1995,107(4):1399-1409
[3]Bartolome A P,Ruperez P.Polysaccharides from the cell walls of pineapple fruit[J].Journal of Agricultural&Food Chemistry,1995,43(3):608-612
[4]Bhaduri S K,Sen S K,Dasgupta P C.Structural studies of an acidic polysaccharide isolated from the leaf fibre of pineapple(Ananas comosus,MERR)[J].Carbohydrate Research,1983,121(121):211-220
[5]Mohammad G A,Andres D H,Klaus D K,et al.Isolation of polysaccharides from pineapple fruit pulp and their enzymatic liquifaction[J].International Food Research Journal,2010,17:193-203
[6]Wu J,Huang H.Extraction,Purification and properties researches of hemi-cellulose polysaccharides from pineapple peel[J].Food&Fermentation Industries,2009,35(9):142-146
[7]Guo Q,Xie J,Yang X,et al.Study on the functional activity of pineapple polysaccharide in vitro[J].Journal of Agriculture,2012,2(3):50-53
[8]罗建平,徐学玲,潘利华,等.菠萝皮渣多糖的提取与体外抗氧化活性研究[J].食品科学,2009,30(18):172-175
[9]Guo Q,Zhang L.Study on polysaccharides extraction and ability to scavenge hydroxyl radicals from pineapple[J].Chinese Agricultural Science Bulletin,2009,25(24):122-125.
[10]覃筱燕,云妙英,刘春兰,等.菠萝多糖分离提取及其抗脂质过氧化作用[J].中国公共卫生,2009,25(1):108-109
[11]Wang L,Tang D Q,Kuang Y,et al.Structural characteristics of pineapple pulp polysaccharides and their antitumor cell proliferationactivities[J].Journal of the Science of Food&Agriculture,2015,95(12):2254-2261
[12]郭巧玲.菠萝多糖的提取及其生物学活性的研究[D].福州:福建农林大学,2010:23-50
[13]Yan L,Tian H J,Zhang S M,et al.Extraction,Purification and immunobiological activity of pineapple hemicellulose polysaccharide[J].Food Science,2008,29(2):35-38
[14]Wang Z B,Jia-Jia H E,Chen J M.Effect of pineapple polysaccharides on performance in weaned piglets[J].China Animal Husbandry&Veterinary Medicine,2009,36(10):25-27.
[15]王标诗,吴艺华,周泽捷,等.超声波辅助提取菠萝皮渣多糖及其抗氧化活性研究[J].食品工业科技,2017(15):207-211
[16]王文平,郭祀远,李琳,等.苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007,28(4):276-279
[17]周建良,徐中文,李浩,等.唾液乳杆菌LB-2P发酵培养基的响应面分析优化[J].中国食品学报,2015,15(7):147-153
[18]邓梦琴,何夏怡,何慕怡,等.响应面法优化菠萝蜜果皮黄酮提取工艺[J].食品工业科技,2016,37(5):222-228
[19]吴宪玲,于晓红,刘涛,等.响应面法优化西洋参多糖的酶解辅助提取工艺[J].食品工业,2016(1):118-122
[20]孟雅红,李辉.Plackett-Burman设计和响应面法优化超声协同酶法提取鸡油菌多糖工艺[J].食品工业科技,2015,36(21):242-249
[21]李梅青,张瑜,代蕾莉,等.Plackett-Burman试验设计及响应面法优化超声辅助提取明绿豆SOD工艺[J].食品科学,2015,36(2):69-74
[22]黎英,陈雪梅,严月萍,等.超声波辅助酶法提取红腰豆多糖工艺优化[J].农业工程学报,2015,31(15):293-301

