小麦对纳米银的吸收及毒性响应
王 琪,李 敏,王 睿,宋吟玲*,党 菲*,周东美
小麦对纳米银的吸收及毒性响应
王 琪1,李 敏2,王 睿2,宋吟玲1*,党 菲2*,周东美2
(1.苏州科技大学环境科学与工程学院, 江苏 苏州 215009;2.中国科学院南京土壤研究所土壤环境与污染修复重点实验室, 江苏 南京 210008)
以纳米银(AgNPs)为研究对象,Ag+(AgNO3)为对照,通过添加半胱氨酸(L-cysteine)探讨小麦对AgNPs的吸收累积和毒性响应.小麦幼苗于不同浓度的AgNPs悬浮液中培养4h后,根系出现氧化应激反应和细胞膜损伤,丙二醛(MDA)和过氧化氢酶(CAT)含量分别由对照组的(2.9±0.5)nmol/L/mgprot和(8.6±1.2)U/mgprot增加至(4.9±1.5)nmol/L/mgprot和(12.4±1.2)U/mgprot.半胱氨酸缓解了AgNO3对小麦的毒性并使小麦对AgNO3的吸收速率常数从(275.4±12.3)L/(kg×h)降低到(210.8±11.2)L/(kg×h).然而,半胱氨酸并没有缓解AgNPs对小麦的毒性,且AgNPs的吸收速率常数没有显著性变化[(12.6±0.8)和(11.2±0.6)L/(kg×h)].这说明AgNPs对小麦的有效性和毒性不仅来源于其释放的Ag+,还来源于纳米颗粒本身.通过进一步计算AgNPs暴露液中不同形态Ag的吸收速率常数,发现Ag+吸收速率常数最高[(275.4±12.3)L/(kg×h)],Ag-cysteine络合物吸收速率常数次之[(210.8±11.2)L/(kg×h)],纳米颗粒吸收速率常数最低[1.6L/(kg×h)].实验中建立了吸收速率常数预测方程,该方程预测结果与实验观测结果一致,说明该方程能够较好地描述小麦吸收AgNPs的具体过程.
纳米银;银离子;小麦;累积;毒性;吸收速率常数
纳米银(AgNPs)因具有良好的抗菌性而广泛应用于医疗、纺织和日常消费品中[1].在大规模商业化应用的同时,AgNPs不可避免地进入环境,通过生活污水进入污水处理厂,并在污泥中富集,达到57mg Ag/kg[2],最终通过污泥农用的方式进入土壤[3].目前关于AgNPs的毒性研究主要集中在哺乳动物和水生生物[4-5],对农田生态系统尤其是对人们赖以生存的农作物的影响尚不清楚.因此,研究AgNPs和植物相互作用具有重要的意义.AgNPs能够降低黑麦草和生菜的发芽率[6]以及西葫芦的生物量[7].由于AgNPs能够溶出Ag+,导致AgNPs对植物的有效性和致毒机制较为复杂[8],纳米颗粒本身能否对植物产生毒性目前仍有争议[9-11].因此植物对AgNPs的吸收和毒性响应值得进一步研究.本研究以小麦为试材,探究小麦对AgNPs的吸收及毒性响应,以期为准确评估AgNPs的生态风险提供基础数据.
1 材料与方法
1.1 材料
聚乙烯吡咯烷酮(PVP)包被的AgNPs购自南京先丰纳米材料有限公司.PVP-AgNPs母液4℃避光保存,实验前在45kHz下超声分散15min.用透射电子显微镜(TEM,JEM-2100,日本)表征纳米颗粒的形貌和尺寸,动态光散射仪(DLS, NanoBrook 90Plus PALS,Brookhaven,美国)测定纳米颗粒的水合粒径.受试小麦(L.,扬麦16)由扬州农科院提供.测试小麦根系氧化应激反应(过氧化氢酶)、细胞膜完整性(丙二醛)和蛋白质含量的试剂盒购自南京建成生物工程研究所.实验所用试剂均为分析纯.
1.2 小麦幼苗
挑选颗粒饱满的小麦种子,在0.5%的次氯酸钠溶液中浸泡10min消毒,超纯水(18.2MΩ)反复冲洗干净后,将种子平铺在有湿润滤纸的培养皿中,(25±1)℃黑暗条件下催芽48h.挑选根长为1.5cm的健康小麦苗移至营养液中(280μmol/L Ca(NO3)2.4H2O,120μmol/L NH4NO3,100μmol/L CaSO4.2H2O,150μmol/L K2SO4,100μmol/L MgSO4.7H2O, 5μmol/L KH2PO4,10μmol/L Fe(Ⅲ)-EDTA, 1μmol/L MnSO4.H2O,3μmol/L H3BO3,1μmol/L ZnSO4.7H2O, 0.05μmol/L CuSO4.5H2O,0.02μmol/ L Na2MoO4,pH=5.6±0.2)[12],置于(25±1)℃、16h光照8h黑暗和80%相对湿度的人工气候箱(PRX-600D,宁波赛福,中国)中培养.15d后选取根长约23cm,株高约25cm,长势均一的小麦幼苗备用.
1.3 暴露实验
实验设置7个处理组,分别为对照组、纳米银组(AgNPs)、硝酸银组(AgNO3)、纳米银-半胱氨酸组(AgNPs-cysteine)、硝酸银-半胱氨酸组(AgNO3-cysteine)、硝酸钠组(NaNO3)和半胱氨酸组(L-cysteine),每个浓度的处理组设置5个重复.实验以营养液为稀释基体,采用逐级稀释法获得各处理组的不同浓度梯度AgNPs及AgNPs-cysteine组中Ag的浓度梯度为1、5、15和25mg/L,AgNO3及AgNO3-cysteine组中Ag浓度依据AgNPs组中溶解态的Ag设定,依次为0.04、0.2、0.6和1.2mg/L.本研究中Ag与半胱氨酸的摩尔比为1:10,以尽可能降低溶液中Ag+浓度[13].为消除暴露液中硝酸根和半胱氨酸对Ag的有效性及毒性的影响,设置NaNO3组(NO3-浓度0.69mg/L)和L-cysteine组(13.4mg/L).所有处理组均用稀硝酸和氢氧化钠调节pH值至(5.6±0.2),一方面小麦生长最适pH值为5~8[14],另一方面pH值在(5.6±0.2)的情况下,不会影响AgNPs的溶出和沉淀[15],能够排除营养液对AgNPs稳定性的影响.
小麦幼苗移植到上述暴露液中分别暴露1h和4h((25±1)℃,80%相对湿度),暴露过程中根部避光.在1~4h的短期暴露中,植物对于AgNPs的吸收呈线性增加[16],而且短期暴露可以准确测定Ag的吸收速率而降低排出速率的干扰[17]
1.4 分析与测定
在0h、1h和4h时移取暴露液,65%浓硝酸常温消解24h后用电感耦合等离子质谱仪(ICP- MS,iCAP QC,Thermofisher,美国)测定溶液中总Ag浓度.0h暴露液用3kDa超滤管(Amicon Ultra- 4,Millipore,美国)4000g离心15min后,滤液中Ag含量视为暴露液中溶解态Ag含量(包括自由态Ag+以及多种络合态Ag)[18].
小麦幼苗用超纯水清洗干净后将根和地上部分离开.根部依次用超纯水浸泡10min, 10mmol/L稀硝酸冲洗,现配的10mmol/L半胱氨酸溶液浸泡20min后,超纯水洗净.该方法可除去根表吸附的AgNPs或者Ag+,清洗效率为82.6%[18].一部分样品在105℃杀青0.5h,70℃烘干至恒重.根据EPA2001b方法,微波消解(Ethos one, Milestone,意大利)样品并用ICP-MS测定总Ag浓度[16].同时消解空白与标准物质(柑橘叶,GBW10020),标准物质回收率为(102±6)%,满足实验精度的要求.另一部分样品用于小麦根系生理代谢指标的测定.
取对照组、AgNPs组(25mg/L)、AgNO3组(1.2mg/L)、AgNPs-cysteine组(25mg/L)、AgNO3- cysteine组(1.2mg/L)、NaNO3组和L-cysteine组小麦根部鲜样,用4℃生理盐水(0.86% NaCl)冲洗后,按1:9重量体积比加入预冷生理盐水,在冰水浴下通过机械匀浆器(DY89-1,宁波新芝生物科技股份有限公司,中国)将样品制备成10%植物匀浆,4℃下1600g离心10min后取上清液用于蛋白质、过氧化氢酶和丙二醛含量的测定.采用G-250考马斯亮蓝法测定蛋白质含量[19];钼酸铵反应法测定根系过氧化氢酶(CAT)含量[20];硫代巴比妥酸(TBA)反应法测定根系丙二醛(MDA)含量[19].每个指标设5个重复.
1.5 小麦对Ag的吸收速率常数

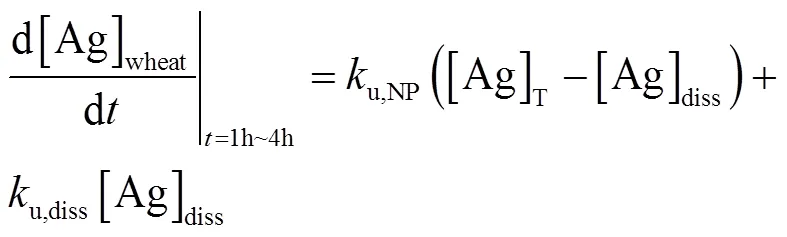
式中:u,diss和u,NP分别代表小麦对溶解态Ag和纳米颗粒的吸收速率常数,L/(kg.h);[Ag]T和[Ag]diss分别代表溶液中总Ag浓度和溶解态Ag浓度,mg/L.

因此,公式(1)可改写为
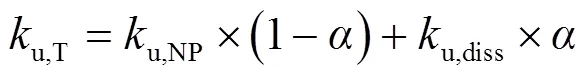
式中:为AgNPs的溶出率,%;u,T为小麦对Ag的总吸收速率常数,L/(kg×h).
当暴露液中同时存在AgNPs和半胱氨酸时,溶液中的总Ag浓度可用下式表示[21]:

则公式(3)可改写为

式中:[Ag]Ag-cysteine为暴露液中Ag-cysteine的浓度,mg/L;u,Ag-cysteine为小麦对Ag-cysteine的吸收速率常数,mg/L.
对于AgNO3组,小麦对溶解态Ag的吸收速率常数(u,diss,L/(kg×h))是小麦的吸收速率(即单位时间内小麦累积Ag的量,mg/(kg×h)与暴露液Ag浓度(mg/L)线性拟合后的斜率[22];通过公式(3)和AgNPs组数据可进一步推导出u,NP;通过AgNO3-cysteine组可计算出u,Ag-cysteine.最终,通过上述计算的u,diss、u,NP、u,Ag-cysteine和公式(5)计算AgNPs-cysteine组Ag的吸收速率常数u,T,并用实验测得的数据验证该结果.
1.6 统计分析
实验数据以平均值±标准偏差表示,采用单因子方差分析方法(one-way ANOVA)的Tukey检验进行显著性差异分析(SPSS 24.0,<0.05),并用Origin 9.0软件绘图.
2 结果与讨论
2.1 AgNPs的表征
TEM图显示AgNPs在营养液中呈圆球状,分散效果良好.经Nanomeasure软件统计,颗粒的平均粒径约为(10.8±4.4)nm(图1A-C)[23].DLS结果表明AgNPs的水合粒径为(73.0±4.2)nm(图1D).通过ICP-MS测得母液中总Ag浓度为(81.2±1.2)mg/L,超滤离心测得其溶解态Ag浓度为(3.3±1.4)mg/L.
2.2 AgNPs对小麦生理代谢的影响
AgNPs、AgNO3或者 AgNPs-cysteine处理的小麦根部MDA和CAT含量都显著高于对照组(<0.05,图2),MDA含量分别增加了69.2%、130.6%和82.5%,CAT含量分别增加了44.5%、57.8%和73.4%.这说明AgNPs、AgNO3和AgNPs- cysteine组小麦幼苗根部产生了氧化应激反应和细胞膜损伤,而且半胱氨酸没有缓解AgNPs对小麦的毒性.然而,AgNO3-cysteine处理的小麦根内MDA和CAT含量与对照组相近(>0.05),说明半胱氨酸有效缓解了AgNO3对小麦的毒性.此外, NaNO3和半胱氨酸处理的小麦根内MDA和CAT含量与对照组没有显著性差异,表明外源的NO3-及半胱氨酸没有对小麦产生不良胁迫.

图1 营养液中AgNPs的微观形貌特征及表征
AgNPs的TEM图(A),颗粒晶格图(B),粒径分布(C),及水合粒径分布(D)

图2 各处理组暴露4h后小麦幼苗根内MDA(A)和CAT(B)含量
实验结果用平均值±标准偏差表示(=5),图中字母表示不同处理组之间的显著性差异分析结果
同样地,Li等[18]研究发现AgNPs和Ag+在水稻体内诱导产生了MDA和过氧化氢,而半光氨酸的加入可以缓解Ag+的毒性[24].因此,以往研究用半胱氨酸络合AgNPs释放出的Ag+,从而达到区分暴露液中纳米颗粒和Ag+的目的[25].但是,本研究结果表明,半胱氨酸不能完全缓解AgNPs对小麦的毒性,说明AgNPs致毒机理不仅与其释放出的Ag+相关,而且与其纳米颗粒本身也有关系.
2.3 小麦对AgNPs的吸收
为了进一步研究AgNPs的毒性机理,本研究测定了小麦对AgNPs的吸收.高浓度AgNPs(15和25mg/L)处理下,小麦地上部累积的Ag浓度显著高于对照组(0mg/L,图3A),说明AgNPs能被小麦吸收并向地上部运输.为进一步研究小麦吸收AgNPs的机制,本文通过计算获得小麦对AgNPs和AgNO3的吸收速率常数分别为(12.6±0.8)和(275.4±12.3)L/(kg×h)(图4).吸收速率的显著差异表明小麦对AgNPs和AgNO3的吸收机制不同.这说明小麦除了吸收AgNPs释放出的Ag+外,也会吸收纳米颗粒.

图3 AgNPs (A)和AgNO3 (B)处理的小麦幼苗地上部和根部Ag浓度
实验结果用平均值±标准偏差表示(n=5),图中字母表示同一处理组不同浓度之间的显著性差异分析结果
本文采用半胱氨酸络合暴露液中Ag+的方法研究小麦吸收AgNPs的内在机制.在5~25mg/ L AgNPs范围内,AgNPs-cysteine处理组的小麦根部Ag浓度为相应的AgNPs组(0.2~1.2mg/L)的39.8%~64.9%,表明小麦可能吸收纳米颗粒.进一步比较发现,AgNPs-cysteine组的吸收速率显著高于其对应的AgNO3-cysteine组(<0.05,图4),说明纳米颗粒能够被小麦吸收.例如:15mg/L AgNPs-cysteine组的吸收速率是0.6mg/L AgNO3-cysteine组的1.7倍[(235.3±36.5)和(140.7±8.1)mg/(kg×h)].而且,AgNO3-cysteine组和AgNPs-cysteine组Ag的吸收速率常数分别为(210.8±11.2)和(11.2±0.6)L/(kg×h).值得注意的是,鉴于半胱氨酸的含量为Ag+的10倍,可认为AgNO3-cysteine组中Ag的主要形态为Ag- cysteine,而其吸收速率常数远大于0,说明Ag- cysteine络合物仍具有生物有效性.半胱氨酸显著降低了AgNO3的吸收速率常数[从(275.4±12.3)降到(210.8±11.2)L/(kg×h)],但不影响AgNPs的吸收速率常数[(12.6±0.8)和(11.2±0.6)L/(kg×h)].可见,溶解态Ag不能完全解释AgNPs的生物有效性,纳米颗粒对AgNPs生物有效性也有贡献.
Geisler-Lee等[26]研究发现拟南芥能够吸收AgNPs和AgNO3溶液中的Ag,并在根部细胞内检测到了AgNPs颗粒,说明Ag+和AgNPs能够被植物吸收.并且L-cysteine的加入会显著降低了植物对AgNPs和AgNO3的吸收量[24].Khans等[27]发现蜗牛对AgNO3的吸收速率是对应浓度下AgNPs吸收速率的两倍.同样的,本研究发现小麦对AgNO3的吸收速率常数显著高于AgNPs的吸收速率常数,且L-cysteine的加入能够有效降低AgNO3的吸收速率常数,但不影响AgNPs的吸收速率常数.
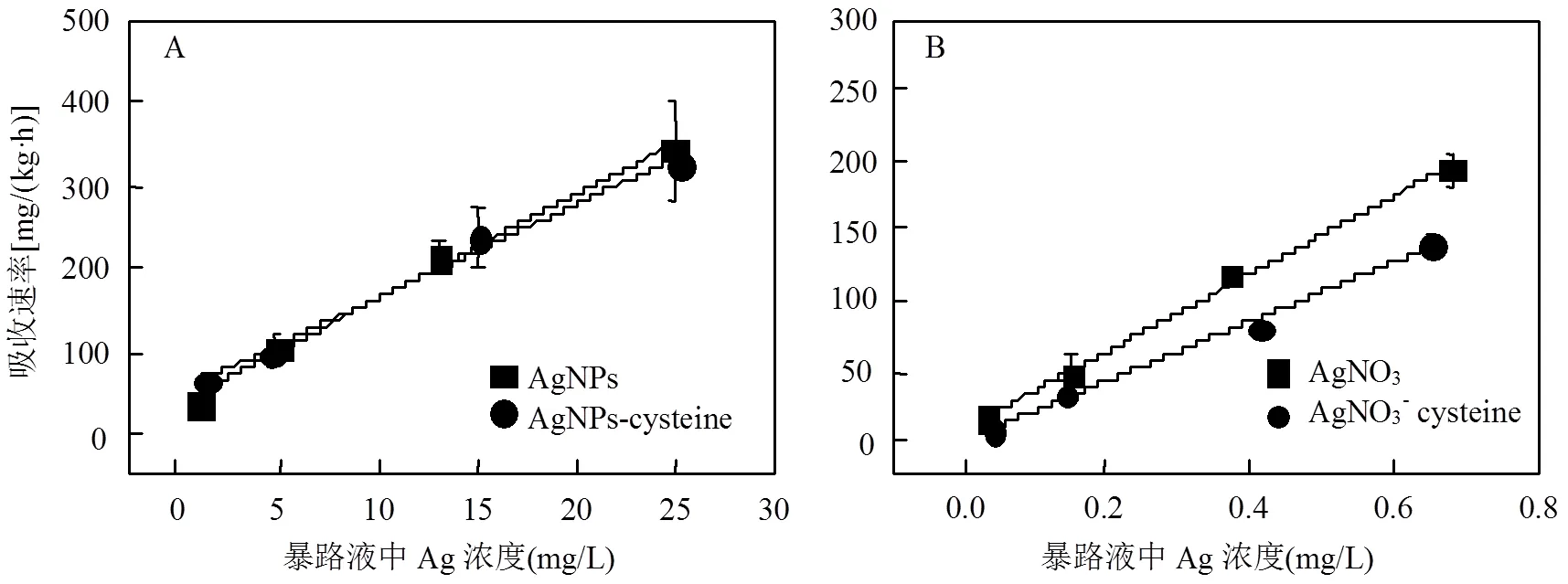
图4 半胱氨酸对小麦幼苗吸收AgNPs(A)或者AgNO3(B)的影响
实验结果用平均值±标准偏差表示(=5)
2.4 吸收速率模型
基于生物动力学模型,吸收速率方程是预测重金属生物累积的有力工具,能够得到与实际测定值相近的预测值.目前该模型被成功应用于研究水生生物[21]及动物胚胎[19]对纳米材料的吸收积累.基于AgNO3组的数据计算得到u,diss= 275.4L/(kg×h)(图4B).对于AgNPs组,由于Ag+不断被小麦吸收,打破了Ag+和纳米颗粒间的动态平衡,从而导致纳米颗粒不断地溶出Ag+[28],因此假设实验条件下AgNPs溶出率(α)保持不变,即为0h的溶出率(4.1±0.6)%.根据公式(3)计算纳米颗粒的吸收速率常数u,NP为1.6L/(kg×h).可见,小麦仍然能够以较低的吸收速率常数吸收纳米颗粒.加入半胱氨酸后,根据AgNO3-cysteine组数据计算得到u,Ag-cysteine=210.8L/(kg×h)(图4B).对于AgNPs-cysteine组,运用式(4)和(5)计算得到u,T为(10.3±2.0)L/(kg×h).通过实验观测到小麦的吸收速率常数为(11.2±0.6)L/(kg×h)(图4A),与计算结果相近,说明该吸收速率方程能够较好的描述小麦吸收AgNPs的过程.
同样的,许多研究基于生物动力学模型计算纳米材料生物积累过程.例如,Jiang等[17]将纳米氧化铜和铜离子的吸收叠加,能够较好的估算鱼类胚胎在纳米氧化铜溶液中对铜的吸收过程.对于AgNPs的积累过程,Luoma等[21]研究发现蜗牛对Ag+的吸收速率常数[1.9L/(g×d)]显著高于AgNPs的吸收速率常数[0.6L/(g×d)],研究最终得到了较好的AgNPs吸收模型.本研究通过吸收速率常数建立的AgNPs吸收速率方程经过实验的检验,能够较好的描述小麦吸收AgNPs的过程.
2.5 讨论
AgNO3可通过诱导产生氧自由基从而导致植物细胞损伤[29].AgNO3组实验结果表明,半胱氨酸不仅降低了小麦对AgNO3的吸收速率常数,而且缓解了AgNO3对小麦的毒性.这主要是由于半胱氨酸含有巯基,与Ag+有很强的结合能力[30].相反,在AgNPs组实验中,半胱氨酸并未显著降低小麦对AgNPs的吸收速率常数,也没有缓解AgNPs对小麦的毒性.这说明AgNPs对小麦有效性和毒性与纳米颗粒本身有关.此外,小麦对AgNPs和AgNO3的吸收速率常数的显著差异也进一步证明小麦吸收AgNPs和AgNO3的机制不同.一些研究也得出相同的结论.例如,Yin等[24]在研究发现,阿拉伯树胶包裹的纳米银(GA-AgNPs)和GA-AgNPs-cysteine同样对小麦的发芽产生了抑制作用,这可能是因为暴露液中纳米颗粒对小麦种子具有毒性效应.
AgNPs暴露液中不同形态Ag(即溶解态Ag、纳米颗粒和Ag-cysteine)的吸收速率常数不同:u,diss[275.4L/(kg.h)]>u,Ag-cysteine[210.8L/(kg.h)]>u,NP[1.6L/(kg.h)].由此可知,半胱氨酸可以降低植物吸收Ag+的速率,但是不能完全消除植物对Ag吸收,说明Ag-cysteine仍然具有一定的生物有效性,且其有效性显著高于纳米颗粒(<0.05).同样, Luoma等[22]也发现蜗牛对Ag-cysteine的吸收速率小于其对Ag+的吸收速率.因此,一些研究采用半胱氨酸络合AgNPs暴露液中的Ag+,并假设Ag-cysteine络合物不能被生物所吸收利用的方法仍有待商榷.
实验中建立的AgNPs吸收速率方程的一个重要假设是小麦对不同形态银的吸收具有累加性.事实上,该方程预测的AgNPs-cysteine体系中小麦对Ag的总吸收速率常数与实验测定结果一致,证明该假设合理且该方程较好地描述了小麦吸收AgNPs的具体过程,即小麦不仅可以吸收溶解态Ag,还可以吸收Ag-cysteine络合物以及纳米颗粒.
尽管纳米颗粒能被小麦吸收,但其吸收速率常数较低.这主要与纳米颗粒进入植物细胞的方式有关.植物细胞壁具有纤维素与木质素纤维交织的网络,其孔径的大小(5~20nm)[31]限制了纳米颗粒团聚体以及大颗粒的进入[32],而小粒径的纳米颗粒可能通过扩散作用进入细胞内[5].同时有研究表明,植物还可能通过内吞的方式吸收纳米颗粒[33].Wang等[34]研究超小型纳米二氧化钛(TiO2)对于拟南芥的影响时发现,其纳米颗粒可以通过孢间连丝(20~50nm)被拟南芥吸收和运输.但是,纳米颗粒进入细胞内的具体机制仍有待于进一步的研究.
3 结论
3.1 AgNPs对小麦的有效性和毒性来源于纳米颗粒及其释放的Ag+.一方面,AgNPs与Ag+的吸收速率常数存在显著差异[(12.6±0.8)和(275.4± 12.3)L/(kg×h)];另一方面,L-cysteine可以降低小麦对Ag+的吸收速率常数[(210.8±11.2)L/(kg×h)]甚至毒性,却没有减少对AgNPs的吸收速率常数[(11.2±0.6)L/(kg×h)]和毒性.
3.2 Ag-cysteine络合物仍然具有较高的生物有效性.小麦对该络合物的吸收速率常数为(210.8± 11.2)L/(kg×h),低于Ag+的吸收速率常数[(275.4± 12.3)L/(kg×h)],但是仍然高于纳米颗粒的吸收速率常数[1.6L/(kg×h)].
3.3 本研究所建立的AgNPs吸收速率方程能够较好的描述小麦吸收AgNPs的过程.通过该方程计算的AgNPs-cysteine的吸收速率常数为(10.3± 2.0)L/(kg×h),和实验测定的结果[(11.2±0.6)L/ (kg×h)]没有显著性差异.
[1] Chaloupka K, Malam Y, Seifalian A M. Nanosilver as a new generation of nanoproduct in biomedical applications [J]. Trends in Biotechnology, 2010,28(11):580-588.
[2] Peng W, Menzies N W, Dennis P G, et al. Silver nanoparticles entering soils via the wastewater-sludge-soil pathway pose low risk to plants but elevated Cl concentrations increase Ag bioavailability [J]. Environmental Science & Technology, 2016,50(15):82-74.
[3] Brunetti G, Donner E, Laera G, et al. Fate of zinc and silver engineered nanoparticles in sewerage networks [J]. Water Research, 2015,77(Supplement C):72-84.
[4] 周东美.纳米Ag粒子在我国主要类型土壤中的迁移转化过程与环境效应 [J]. 环境化学, 2015,34(4):605-613.
[5] 吕继涛,张淑贞.人工纳米材料与植物的相互作用:植物毒性、吸收和传输 [J]. 化学进展, 2013,1(1):156-163.
[6] Barrena R, Casals E, Colón J, et al. Evaluation of the ecotoxicity of model nanoparticles [J]. Chemosphere, 2009,75(7):850-857.
[7] Stampoulis D, Sinha S K, White J C. Assay-dependent phytotoxicity of nanoparticles to plants [J]. Environmental Science & Technology, 2009,43(24):9473.
[8] 林道辉,冀 静,田小利,等.纳米材料的环境行为与生物毒性 [J]. 科学通报, 2009,54(23):3590-3604.
[9] Navarro E, Piccapietra F, Wagner B, et al. Toxicity of silver nanoparticles to Chlamydomonas reinhardtii [J]. Environmental Science & Technology, 2008,42(23):8959-8964.
[10] Beer C, Foldbjerg R, Hayashi Y, et al. Toxicity of silver nanoparticles-nanoparticle or silver ion? [J]. Toxicology Letters, 2012,208(3):286-292.
[11] Milić M, Leitinger G, Pavičić I, et al. Cellular uptake and toxicity effects of silver nanoparticles in mammalian kidney cells: Cellular uptake and toxicity of nanosilver in mammalian kidney cells [J]. Journal of Applied Toxicology, 2015,35(6):581-592.
[12] Wang P, Menzies N W, Lombi E, et al. Silver sulfide nanoparticles (Ag2S-NPs) are taken up by plants and are phytotoxic [J]. Nanotoxicology, 2015,9(8):1041-1049.
[13] He D, Dorantes-Aranda J J, Waite T D. Silver nanoparticle-algae interactions: oxidative dissolution, reactive oxygen species generation and synergistic toxic effects [J]. Environmental Science & Technology, 2012,46(16):8731-8738.
[14] 何文寿,李生秀,李辉桃.营养液pH对小麦生长及吸收铵、硝态氮的影响 [J]. 土壤, 1998,30(3):143-146.
[15] Molleman B, Hiemstra T. Time, pH, and size dependency of silver nanoparticle dissolution: the road to equilibrium [J]. Environmental Science-Nano, 2017,4(6):1314-1327.
[16] 李 敏,宋吟玲,党 菲,等.水稻秸秆腐解液对水稻根部吸收纳米银(AgNP)速率的影响 [J]. 生态与农村环境学报, 2016, 32(4):675-681.
[17] Jiang C, Castellon B T, Matson C W, et al. Relative Contributions of Copper Oxide Nanoparticles and Dissolved Copper to Cu Uptake Kinetics of Gulf Killifish (Fundulus grandis) Embryos [J]. Environmental Science & Technology, 2017,51(3):1395-1404.
[18] Li C C, Dang F, Li M, et al. Effects of exposure pathways on the accumulation and phytotoxicity of silver nanoparticles in soybean and rice [J]. Nanotoxicology, 2017,11(5):699-709.
[19] Deng Y, Wang W, Yu P, et al. Comparison of taurine, GABA, Glu, and Asp as scavengers of malondialdehydein vitroandin vivo [J]. Nanoscale Research Letters, 2013,8(1):190.
[20] Zhang J Q, Shen M, Zhu C C, et al. 3-Nitropropionic acid induces ovarian oxidative stress and impairs follicle in mouse [J]. PloS One, 2014,9(2):e86589.
[21] Luoma S N, Stoiber T, Croteau M N, et al. Effect of cysteine and humic acids on bioavailability of Ag from Ag nanoparticles to a freshwater snail [J]. NanoImpact, 2016,2(Supplement C):61-69.
[22] Croteau M N, Luoma S N. A Biodynamic Understanding of Dietborne Metal Uptake by a Freshwater Invertebrate [J]. Environmental Science & Technology, 2008,42(5):1801-1806.
[23] Li C C, Wang Y J, Dang F, et al. Mechanistic understanding of reduced AgNP phytotoxicity induced by extracellular polymeric substances [J]. Journal of Hazardous materials, 2016,308 (Supplement C):21-28.
[24] Yin L, Cheng Y, Espinasse B, et al. More than the ions: the effects of silver nanoparticles on Lolium multiflorum [J]. Environmental Science & Technology, 2011,45(6):2360-2367.
[25] Larue C, Castillo-Michel H, Sobanska S, et al. Foliar exposure of the crop Lactuca sativa to silver nanoparticles: Evidence for internalization and changes in Ag speciation [J]. Journal of Hazardous materials, 2014,264(Supplement C):98-106.
[26] Geisler-Lee J, Wang Q, Yao Y, et al. Phytotoxicity, accumulation and transport of silver nanoparticles by Arabidopsis thaliana [J]. Nanotoxicology, 2013,7(3):323-337.
[27] Khan F R, Misra S K, Garcia-Alonso J, et al. Bioaccumulation dynamics and modeling in an estuarine invertebrate following aqueous exposure to nanosized and dissolved silver [J]. Environmental Science & Technology, 2012,46(14):7621-7628.
[28] Zhou W, Liu Y L, Stallworth A M, et al. Effects of pH, Electrolyte, Humic Acid, and Light Exposure on the Long-Term Fate of Silver Nanoparticles [J]. Environmental Science & Technology, 2016,50(22):12214-12224.
[29] Cvjetko P, Milosic A, Domijan A M, et al. Toxicity of silver ions and differently coated silver nanoparticles in Allium cepa roots [J]. Ecotoxicology and Environmental Safety, 2017,137(Supplement C):18-28.
[30] Toh H S, Batchelor-Mcauley C, Tschulik K, et al. Chemical interactions between silver nanoparticles and thiols: a comparison of mercaptohexanol against cysteine [J]. 中国科学:化学, 2014,57(9):1199-1210.
[31] Carpita N, Sabularse D, Montezinos D, et al. Determination of the pore size of cell walls of living plant cells [J]. Science, 1979, 205(4411):1144-1147.
[32] Deng Y Q, White J C, Xing B S. Interactions between engineered nanomaterials and agricultural crops: implications for food safety [J]. Journal of Zhejiang University-Science A (Applied Physics & Engineering), 2014,15(8):552-572.
[33] Miralles P, Church T L, Harris A T. Toxicity, Uptake, and Translocation of Engineered Nanomaterials in Vascular plants [J]. Environmental Science & Technology, 2012,46(17):9224-9239.
[34] Wang S, Kurepa J, Smalle J A. Ultra‐small TiO2nanoparticles disrupt microtubular networks in Arabidopsis thaliana [J]. Plant Cell & Environment, 2011,34(5):811-820.
The uptake and toxicity of silver nanoparticles to wheat.
WANG Qi1, LI Min2, WANG Rui2, SONG Ying-ling1*, DANG Fei2*, ZHOU Dong-mei2
(1.School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 515009, China;2.Key Laboratory of Soil Environment and Pollution remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)., 2018,38(3):1149~1156
The uptake and toxicity of silver nanoparticles (AgNPs) to wheat were investigated. The wheat seedlings were exposed to different concentrations of AgNPs suspension in 4h. Oxidative stress and cell membrane damage were observed in roots. The content of malondialdehyde (MDA) and catalase (CAT) increased from (2.9±0.5)nmol/L/mgprot and (8.6±1.2)U/mgprot to (4.9±1.5)nmol/L/mgprot and (12.4±1.2)U/mgprot. The addition of L-cysteine reduced the toxicity of AgNO3to wheat and decreased the dissolved uptake rate constant of AgNO3from (275.4±12.3)L/(kg×h) to (210.8±11.2)L/(kg×h). In contrast, L-cysteine did not affect the toxicity of AgNPs to wheat, and the dissolved uptake rate constant did not differ significantly before and after the addition of L-cysteine [i.e., (12.6±0.8) vs (11.2±0.6)L/(kg×h)]. The results suggested that not only the released Ag+from AgNPs, but also the particles themselves contributed to the bioavailability and toxicity of AgNPs. Furthermore, the dissolved uptake rate constants from different species of Ag in the presence of L-cysteine (i.e., dissolved Ag+, AgNP particles, and Ag-cysteine) were calculated, and dissolved Ag+exhibited the highest bioavailability [(275.4±12.3)L/(kg×h)], followed by Ag-cysteine complex [(210.8±11.2)L/(kg×h)] and finally the nanoparticles [1.6L/(kg×h)]. A model described the uptake process of AgNPs were thus established. The predicted overall uptake rate constants were comparable to that observed in the experiment, which validated the success of the model in describing the uptake of AgNPs.
silver nanoparticles;Ag+;wheat;accumulation;toxicity;uptake rate constant
X131
A
1000-6923(2018)03-1149-08
王 琪(1993-),男,江苏常州人,苏州科技大学环境科学与工程学院硕士研究生,主要从事植物与纳米金属材料毒性研究.发表论文1篇.
2017-07-28
国家自然科学基金重点项目(41430752)
* 责任作者, 宋吟玲, 副教授, 807118983@qq.com; 党 菲, 副研究员, fdang@issas.ac.cn

