下调miR-21抑制PI3K/AKT信号通路对白血病细胞增殖凋亡的影响①
严匡华 陈 龙 严风梦
(河南大学第一附属医院血液科,开封 475001)
白血病又称血癌是一种常见儿童期好发性的血液系统恶性肿瘤,是我国主要肿瘤死亡因素之一,其主要特征为造血干细胞异常增殖、分化、凋亡和造成正常血细胞减少[1,2]。从2002年~2014年的研究发现,部分地区白血病的发病率和死亡率有明显上升的趋势,严重威胁着人们的健康[3,4]。目前化疗是白血病临床治疗的主要手段,但其往往伴有较大的副作用,寻找安全有效的治疗手段一直是研究的热点[5,6]。微小RNA(miRNA)是一种小分子RNA,在白血病中发挥着癌基因或抑癌基因的重要作用,研究特定的miRNA可作为白血病诊断和治疗的有效靶点[7,8]。研究发现miR-21在多种肿瘤中呈现异常表达,干扰其表达可达到抑制肿瘤细胞生长的目的[9,10]。目前,关于miR-21在白血病中的作用机制尚不明确,本实验通过下调miR-21的表达,观察其对白血病K562细胞增殖凋亡的影响,及其对PI3K/AKT信号通路的调控作用,探讨miR-21在白血病细胞中可能的作用机制,为白血病的靶向治疗提供依据。
1 材料与方法
1.1材料 RPMI1640培养基和胰蛋白酶购于美国Hyclone公司;胎牛血清购于浙江四季青公司;白血病细胞系K562购于上海中国科学院细胞库,miR-21和内参U6的引物由上海生工生物工程股份有限公司合成;miR-21 inhibitor和miR-21 negative control购于广州锐博生物科技有限公司,脂质体LipofectamineTM2000、BCA蛋白定量试剂盒、实时荧光定量PCR试剂盒、总RNA提取试剂盒和逆转录试剂盒购于美国Invitrogen公司;噻唑蓝MTT、Annexin V-FITC/PI凋亡检测试剂盒和聚偏二氟乙烯(PVDF)膜购于美国Sigma公司;兔抗PI3K、p-AKT、AKT、β-actin抗体和羊抗兔HRP酶标记的IgG购于美国Santa Cruz公司;流式细胞仪和酶标仪均购于美国Bio-Rad公司;PCR扩增仪购于美国Gibco公司。
1.2方法
1.2.1细胞培养、分组和转染 将K562细胞培养中含有10%胎牛血清和青链酶双抗(100 U/ml青霉素+100 μg/ml 链霉素)的RPMI1640培养基上,置于37℃、5%CO2的恒温培养箱中常规培养。取对数生长期细胞,分为对照组(不做任何处理)和miR-21 NC组(加入120 nmol/L miR-21 negative control+脂质体)和miR-21干扰组(120 nmol/L miR-21 inhibitor+脂质体)3组。按照脂质体转染的说明书将上述各组细胞进行转染,转染后继续培养6 h,更换成完全培养基,在常规条件下继续培养,待培养48 h后收集细胞进行后续实验。
1.2.2qRT-PCR检测miR-21 mRNA的表达 收集上述转染48 h的各组K562细胞,按照总RNA提取试剂盒的说明书提取各组细胞的总RNA,BCA法检测其浓度和纯度后,再按照逆转录试剂盒说明书将总RNA逆转录为cDNA,参照GenBank中miR-21序列,利用Primer premier 5.0软件设计目的基因miR-21及内参基因U6的RT-PCR引物,以cDNA为模板进行PCR扩增。反应程序为:94℃预变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸2 min,35个循环,72℃总延伸5 min。反应体系为20 μl,以U6为内参,采用2-ΔΔCt法计算各组细胞中miR-21 mRNA表达水平。
1.2.3MTT法检测K562细胞增殖 取转染48 h后的各组K562细胞,以3×105个/ml浓度接种至96孔板中,每孔加入100 μl细胞悬液后在条件为37℃、5%CO2的二氧化碳培养箱中培养48 h。其中每组实验均设5个复孔,每孔加入新鲜噻唑蓝MTT溶液(浓度为5 mg/ml)20 μl,孵育4 h后加入二甲基亚砜DMSO 200 μl,待充分溶解后用酶标仪于570 nm检测各组细胞的吸光值(OD)。根据公式:细胞增殖率=(转染组细胞OD/对照组细胞OD)×100%,计算各组细胞的细胞增殖率。
1.2.4流式细胞仪检测细胞周期和细胞凋亡 取转染48 h的各组细胞经胰蛋白酶消化后,调整细胞浓度为3×104个/ml,经离心、PBS洗涤和75%乙醇处理后,加入200 μl结合缓冲液Binding Buffer重悬细胞,再加入膜联蛋白-V-异硫氰酸荧光素(Annexin-V-FITC) 5 μl和碘化丙啶(PI)10 μl,避光处理30 min后,上流式细胞仪检测各组细胞的细胞周期和细胞凋亡率。
1.2.5Western blot检测信号通路PI3K/AKT中相关蛋白的表达 收集转染48 h后的各组细胞,加裂解液提取总蛋白,并采用BCA法检验其浓度。取100 μg上清蛋白量进行十二烷基硫酸钠聚丙烯酰胺凝胶(12%)电泳,转聚偏二氟乙烯(PVDF)膜,经脱脂奶粉(5%)封闭2 h后加入兔抗PI3K、p-AKT、AKT和β-actin抗体(稀释1∶1 000),孵育4℃过夜,再加入稀释1∶1 000的二抗羊抗兔HRP酶标记的IgG(IgG-HRP),孵育2 h后,以化学发光法显色,用凝胶电泳成像仪采集图像。以β-actin为内参,采用Quantity One软件分析条带。
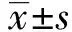
2 结果
2.1转染后各组细胞中miR-21的相对表达水平 qRT-PCR检测转染后各组K562细胞中miR-21的表达结果见图1,对照组、miR-21 NC组和miR-21干扰组细胞中miR-21的相对表达水平分别为(1.00±0.03)、(0.98±0.05)和(0.32±0.05)。与对照组相比,miR-21 NC组细胞中miR-21的表达水平无明显变化(P>0.05),而miR-21干扰组细胞中miR-21的表达水平明显降低,差异具有统计学意义(P<0.05)。
2.2下调miR-21对白血病细胞增殖的影响 转染48 h后,对照组、miR-21 NC组和miR-21干扰组K562细胞的存活率分别为(100.18±2.15)%、(97.32±3.62)%和(52.45±5.25)%。结果如图2表明,与对照组相比,miR-21 NC组中细胞存活率的差异无显著统计学意义(P>0.05),而miR-21干扰组中细胞的存活率显著降低(P<0.05),表明下调miR-21的表达后明显抑制了K562细胞的增殖。
2.3下调miR-21对白血病细胞周期的影响 表1显示,与对照组相比,转染48 h后miR-21干扰组细胞中G0/G1期所占细胞比例显著升高(P<0.05),S期细胞所占比例显著下降(P<0.05),而miR-21 NC组细胞中各细胞周期变化不明显(P>0.05)。结果说明下调miR-21的表达可将细胞周期阻滞在G0/G1期。
2.4下调miR-21对白血病细胞凋亡的影响 流式细胞仪检测转染48 h后各组细胞的凋亡结果见图3对照组、miR-21 NC组和miR-21干扰组中细胞的凋亡率分别为(6.78±2.25)%、(7.36±3.22)%和(35.42±2.25)%。miR-21 NC组细胞的凋亡率与对照组相比差异无显著统计学意义(P>0.05),而miR-21干扰组细胞的凋亡率较对照组明显升高(P<0.05)。说明下调miR-21能够促进K562细胞凋亡。
2.5下调miR-21抑制PI3K/AKT信号通路 转染miR-21 48 h后,检测各组K562细胞中PI3K/AKT信号通路中PI3K、AKT和磷酸化AKT蛋白的表达情况,结果见表2、图4。与对照组相比,miR-21NC组细胞中PI3K、t-AKT和p-AKT蛋白的相对表达水平差异均无显著统计学意义(P>0.05),而miR-21干扰组中PI3K和t-AKT的表达水平差异无统计学意义(P>0.05),但p-AKT的表达水平明显下降(P<0.05)。
图1 转染后各组细胞中miR-21的相对表达水平Fig.1 Relative expression levels of miR-21 in cells after transfectionNote:Compared with control,*.P<0.05.

图2 下调miR-21对白血病K562细胞增殖的影响Fig.2 Effect of down regulation of miR-21 expression on proliferation of leukemic K562 cellsNote:Compared with control,*.P<0.05.

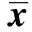

GroupsG0/G1SG2/MControl56 08±1 8632 25±1 0611 88±1 25miR⁃21NC57 16±2 352)31 52±2 552)11 76±1 122)miR⁃21interference69 86±2 111)20 21±1 121)10 02±2 021)
Note:Compared with control,1)P<0.05;compared with control,2)P>0.05.
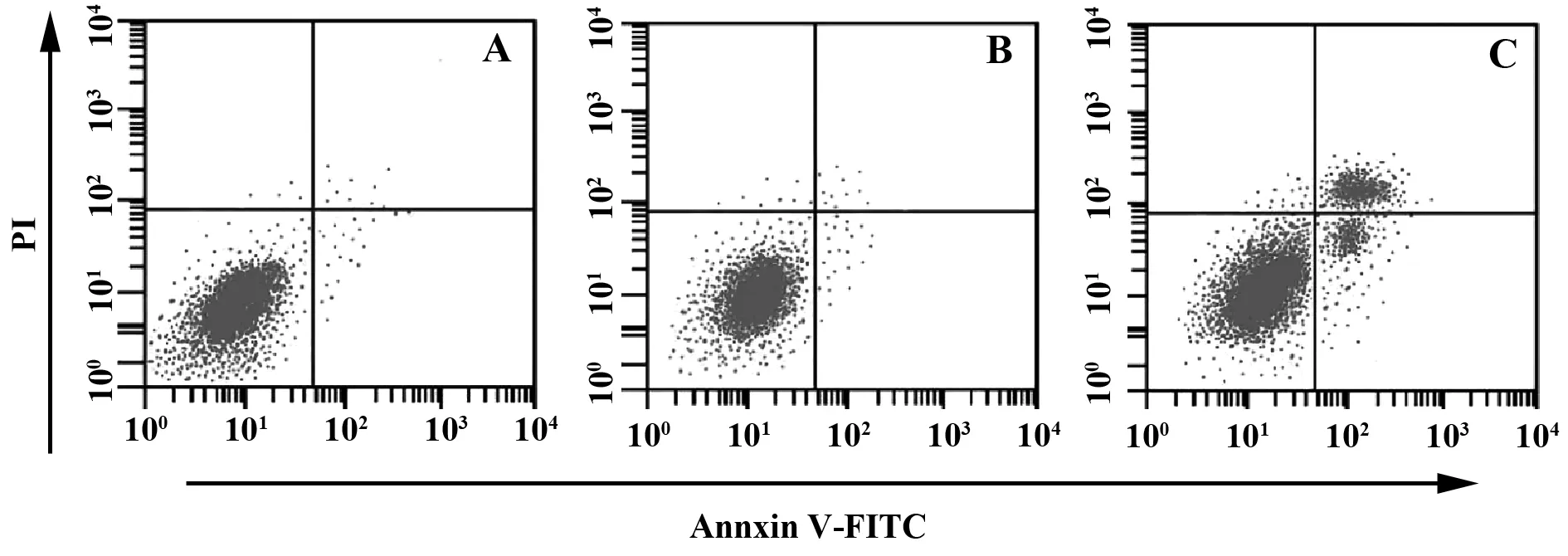
图3 下调miR-21表达对K562细胞凋亡的影响Fig.3 Effect of down regulation of miR-21 expression on apoptosis of K562 cellsNote:A.Control group;B.miR-21 NC group;C.miR-21 interference group.
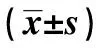

GroupsPI3Kp⁃AKTt⁃AKTControl0 41±0 030 18±0 020 52±0 03miR⁃21NC0 42±0 052)0 16±0 032)0 51±0 042)miR⁃21interference0 38±0 051)0 07±0 031)0 49±0 051)
Note:Compared with control,1)P<0.05;compared with control,2)P>0.05.

图4 下调miR-21表达对PI3K/AKT信号通路的影响Fig.4 Effect of down regulation of miR-21 expression on PI3K/AKT signaling pathway
3 讨论
miR-21是一种广泛存在的定位于17q23.2染色体中FRA17B常见脆性区域上的miRNA[11]。研究发现,miR-21在胶质瘤、乳腺癌和宫颈癌等多种肿瘤中出现高表达,与肿瘤的发生发展密切相关,作为肿瘤标志物对肿瘤的诊断、治疗及预后评估具有很大的临床应用价值[12-14]。如Zhang等[15]研究发现过表达miR-21作为致癌基因在多发性骨髓瘤细胞增殖中发挥作用,并认为miR-21可能作为判断患者预后不良的指标;Bao等[16]检测miR-21在结肠癌及其相应癌旁正常组织的表达发现,miR-21在结肠癌中的表达水平较其癌旁正常组织明显上调,并认为其表达与结肠癌的发病位置、临床分期和淋巴转移密切相关。白血病是一种严重威胁儿童生命的恶性肿瘤,其发病机理仍不清晰,有研究发现miR-21在急性B淋巴细胞白血病中异常表达,与白血病的发生发展关系密切[17],但关于miR-21与白血病的作用机制尚不明确,研究miR-21在白血病中的作用机制对白血病的诊断和治疗具有重要意义。
周克兵等[18]发现下调鼻咽癌中高表达的miR-21后,可有效抑制鼻咽癌CNE2细胞增殖和侵袭。Yu等[19]在miR-21对肾癌细胞凋亡和侵袭力的影响研究中发现沉默miR-21可抑制肾癌的恶性发展。为了探讨miR-21在白血病中的作用机制,本实验通过脂质体法下调miR-21的表达,观察其对白血病K562细胞增殖凋亡的影响,发现下调miR-21的表达能够明显抑制K562细胞的增殖,同时使细胞周期阻滞在G0/G1期,并促进细胞凋亡。此结果进一步证明了Wu等[20]得出抑制miR-21表达能够抑制白血病细胞增殖的实验结果,但本研究也发现 miR-21的表达可调控白血病K562细胞周期,此结果与Xiong等[21]研究抑制miR-21的表达可影响结肠癌HCT116细胞周期的结果相吻合。
磷酯酰肌醇-3激酶/蛋白激酶B(PI3K/AKT)信号通路在肿瘤的发生发展过程中发挥着重要作用,磷酯酰肌醇-3激酶(PI3K)的激活能够促进细胞增殖和抑制细胞凋亡,蛋白激酶B(PKB又称AKT)是PI3K下游重要的靶激酶,两者均为PI3K/AKT信号通路的重要组成部分,在多种肿瘤疾病中发挥着重要作用[22,23]。PI3K/AKT在白血病中发挥着重要的调控机制,与白血病的发生发展密切相关[24,25]。Mu等[26]研究发现,下调miR-21的表达可以抑制人增生性瘢痕成纤维细胞中PI3K/AKt信号通路;Wang等[27]也发现沉默miR-21通过阻断PI3K/AKT信号通路来诱导白血病干细胞凋亡。为了进一步了探讨下调miR-21对白血病细胞凋亡的机制,观察其对白血病细胞中PI3K/AKT信号通路的影响,Western blot检测发现p-AKT的表达水平较对照组和miR-21 NC组明显下降,但PI3K和AKT蛋白的表达水平变化不大。
综上所述,下调miR-21能够抑制白血病K562细胞的增殖,使细胞周期阻滞在G0/G1期,促进其凋亡,其作用机制可以与抑制PI3K/AKT信号通路有关,本研究为以miR-21为分子靶点治疗白血病的实验研究提供了理论参考。
[1] Zhang QX,Cai WL,Yan PK,etal.Research progress of traditional chinese medicine in the treatment of leukemia[J].J Liaoning Uni TCM,2015,17(9):110-113.
[2] Chen WQ,Zhang SW,Zheng RS.Report of cancer incidence and mortality in China,2012[J].China Cancer,2016,25(1):1-8.
[3] Wang LH,Zheng WU,Yan B.Incidence and mortality of leukemia in shanghai pudong new area,2002-2012[J].Chin J Public Health,2016,32(11):1547-1550.
[4] Hu WB,Zhang T,Qin W,etal.Trend of leukemia incidence and mortality in kunshan city,jiangsu province,2006~2014[J].China Cancer,2017,26(1):38-43.
[5] Shi YY,Ma CY,Miao YJ,etal.Mechanisms of Chinese materia medica multi-target to reverse MDR of leukemia[J].Chin Traditional Herbal Drugs,2016,47(7):1230-1235.
[6] Wang F,Chen H.Overview of the treatment of leukemia with genetic engineering drugs[J].J Modern Oncol,2013,21(5) :1158-1162.
[7] 金爱琴,倪红兵,孙宝兰,等.microRNA-218在急性淋巴细胞白血病细胞CCRF-CEM中的作用及机制研究[J].中国免疫学杂志,2015,31(1):103-108.
Jin AQ,Ni HB,Sun BL,etal.Roles and regulation mechanism of microRNA-218 in acute lymphocytic leukemia cell CCRF-CEM[J].Chin J Immunl,2015,31(1):103-108.
[8] Wang P,Zhang X,Pediatrics DO.The clinical significance of detection of miR-223 and miR-99a in children with acute myeloid leukemia[J].Hebei Med J,2016,38(16):2416-2418.
[9] Wan RQ,Fu XJ,Zhang XH,etal.Expression of miR-21 in nasopharyngeal carcinoma and its effect on proliferation and apoptosis of nasopharyngeal carcinoma cells[J].Chin J Otorhinolaryngology-Skull Base Surg,2015,21(5):377-382.
[10] Tian M,Wang YS,Miao LY,etal.Effects of miR-21 inhibition on A549/DDP cisplatin resistant cell proliferation and apoptosis in non-small cell lung cancer[J].Acta Universitatis Medicianlis nanjing(Natural Science),2014,34(5):543-547.
[11] Liang Y.Research advances of miR-21 and tumor[J].Chin J Cancer Prevention Treatment,2012,9(12):949-952.
[12] Li QL,Song YW,Hui LI,etal.The latest progress in research and therapy of miR-21 in glioma[J].Med Recapitulate,2015,2013(1):295-300.
[13] Zhang H,Zhang Y,Zou L.Advances in research on miR-21 and breast cancer[J].J Biomedical Engineer,2015,32(3):712-716.
[14] Liu J,Wang YL,Huang LM.Research progress on the relationship between miR-21 and cervical cancer[J].Hainan Med J,2015,26(19):2885-2888.
[15] Zhang TL,Sun L,Wang SM,etal.Expression of miR-21 in multiple myeloma and its clinical significance[J].J Exp Hematol,2012,20(3):616-619.
[16] Bao X,Yang YM,Liu N,etal.Expressions of miR-21 in colon cancer and cancer-adjacent colorectal tissues and their clinical significances[J].J Jilin Uni Med Edition,2013,39(2):318-321.
[17] Liu X,Shuhong YU,Sun L,etal.The expression and its significance of miR-21 in children with acute B-lymphocytic lekemia[J].Med J Qilu,2014,29(1):1-3.
[18] 周克兵,谷 刚,曹 昕.下调miR-21表达抑制鼻咽癌CNE2细胞增殖和侵袭[J].中国癌症杂志,2013,23(11):863-867.
Zhou KB,Gu G,Cao X. miR-21 downregulation attenuates cell proliferation,migration and invasion in nasopharyngeal carcinoma[J]. China Oncol,2013,23(11):863-867.
[19] Yu NW,Zhang AM,Hao JW,etal.Impact of MiR-21 on apoptosis and invasion in renal cell carcinoma[J].Progress Modern Biomed,2013,13(4):636-638.
[20] Wu GF,Huang QT,Zeng YT,etal.miR-21 inhibits migration and proliferation of leukemic K562 cells via the PTEN/AKT pathway[J].J Med Postgraduates,2013,26(10):1037-1040.
[21] Xiong BH,Ma L,Cheng Y,etal.Impact of inhibition of miRNA-21 on biological functions of colorectal cancer cells[J].Chin J Cancer Biother,2014,21(1):49-54.
[22] Wei LT,Feng J,Mo SR.Progress in correlation of PI3K-akt signal pathway with tumor[J].J Chin Oncol,2014,20(4):331-336.
[23] 段友强,刘义锋,李 巍.奥沙利铂调控PI3K/Akt信号通路抑制脑胶质瘤细胞株U87生长的作用研究[J].中国免疫学杂志,2017,33(3):328-332.
Duan YQ,Liu YF,Li W. Research of oxaliplatin inhibit growth in glioma U87 cells by regulating PI3K/ Akt signal pathway[J].Chin J Immunl,2017,33(3):328-332.
[24] Wang WL,Zhang YC,Zeng HM,etal.Regulatory mechanisms of PI3K/AKT signaling pathway in acute leukemia[J].J Exp Hematol,2012,20(1):18-21.
[25] Hu C,Xu M,Qin R,etal.Wogonin induces apoptosis and endoplasmic reticulum stress in HL-60 leukemia cells through inhibition of the PI3K-AKT signaling pathway[J].Oncol Rep,2015,33(6):3146-3154.
[26] Mu SZ,Sun YW,Wang GD.Down-regulation of miR-21 inhibits the HSF cells proliferation and the PI3K/Akt pathways via PDCD4[J].Chin J Aesthetic Med,2015,24(23):39-43.
[27] Wang WZ,Pu QH,Lin XH,etal.Silencing of miR-21 sensitizes CML CD34+,stem/progenitor cells to imatinib-induced apoptosis by blocking PI3K/AKT pathway[J].Leukemia Res,2015,39(10):1117-1124.

