黄芪多糖抑制小鼠EAE及调控BV-2神经小胶质细胞活化的实验研究①
马金昀 王金英 孙 宇 李国陵 程晓东
(上海中医药大学附属岳阳中西医结合医院临床免疫研究所,上海 200437)
多发性硬化(Multiple sclerosis,MS)是一种由自身免疫反应所介导的慢性中枢神经系统疾病,其最经典和最成熟的动物模型是实验性自身免疫性脑脊髓膜炎(Experimental autoimmune encephalomyelitis,EAE)[1]。MS/EAE以自身反应性T细胞活化、炎症、髓鞘脱失及神经元损伤和缺失为主要病变特点[2]。MS/EAE的发病机制极其复杂,近年来研究发现,神经小胶质细胞(Microglia,MG)活化释放大量前炎症因子和毒性介质,发起炎症反应并进一步扩大炎症范围和神经损伤程度,在MS/EAE的发生发展中发挥了至关重要的作用[3,4]。程序性细胞死亡配体(Programmed death ligands,PD-Ls)为B7-CD28超家族的新成员,表达于抗原提呈细胞上,与表达在T细胞上的受体——程序性细胞死亡分子-1(Programmed death-1,PD-1)相互结合并作用,发挥负向免疫调控作用,对调控机体自身免疫反应至关重要[5]。中枢神经系统(Central nervous system,CNS)中的神经小胶质细胞作为抗原提呈细胞,炎症反应时其表面的PD-L1表达升高,说明其在CNS炎症反应中发挥重要作用[6]。中药黄芪具有补中益气、升阳举陷、固表止汗等功效,临床上运用黄芪治疗神经退行性疾病有着悠久的历史,长期以来已进行了许多富有成效的探索[7-9]。本实验室已发现并报道,黄芪对小鼠EAE具有明显的治疗作用,可以明显改善EAE症状,抑制MOG诱导的脾脏T细胞增殖,降低促炎细胞因子TNF-α、IFN-γ、IL-17水平,增加抗炎细胞因子IL-4水平,减轻小鼠CNS炎性细胞的浸润和髓鞘脱失[10]。黄芪多糖(Astragals polysaccharides,APS)作为黄芪的主要有效成分,既有免疫增强作用,同时也存在免疫抑制作用,能双向调节免疫系统功能[11]。因此,为了进一步探索黄芪治疗EAE的神经免疫调控机制,在前期工作基础上,本研究将观察黄芪有效成分APS对小鼠EAE的治疗作用,以及对BV-2神经小胶质细胞活化的分子调控机制,以揭示APS的中枢神经免疫药理学机制,探寻其治疗多发性硬化的新靶点,为治疗神经退行性疾病提供科学实验依据。
1 材料与方法
1.1材料 SPF级雌性C57BL/6小鼠,8~9周龄,体重18~20 g,购于中国科学院上海实验动物中心,生产单位许可证号SCSK(沪2007-0005);饲养于同济大学实验动物中心,动物使用许可证号SYSK(沪2009-0022)。BV-2小鼠小脑胶质瘤细胞,购于上海复祥生物科技有限公司;LPS购于Sigma公司;APS购于西安鸿生生物技术有限公司,纯度70%(批号111013);髓鞘少突胶质细胞糖蛋白MOG35-55多肽由上海吉尔生化有限公司合成Met-Glu-Val-Gly-Trp-Tyr-Arg-Ser-Pro-Phe-Ser-Arg-Val-Val-His-Leu-Tyr-Arg-Asn-Gly-Lys,缩写MEVGWYRSPFSRVVHLYRN-GK,纯度>98%;完全弗氏佐剂CFA购于Sigma公司;结核分枝杆菌H37Ra(TB)购于BD公司;百日咳毒素(PT)购于Calbiochem公司;RPMI1640培养基、DMEM培养基、胎牛血清、胰蛋白酶购自HyClone公司;TNF-α检测试剂盒、IFN-γ检测试剂盒购自R&D公司;PD-L1检测试剂盒购自上海嘉硕生物科技有限公司;全蛋白提取试剂盒、Broadford法蛋白质浓度测定试剂盒购自生工生物工程有限公司;SDS-PAGE上样缓冲液、广谱彩虹预染Marker、eECL高灵敏度化学发光检测试剂盒购自康为世纪公司;FastQuant cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂(增强版)购自天根生化科技有限公司;抗小鼠PD-L1单克隆抗体、抗小鼠β-actin抗体购自上海睿迪生物科技有限公司;噻唑蓝MTT、DMSO 购自Sigma公司;青霉素-链霉素双抗购自HyClone公司;75%酒精购自国药集团化学试剂有限公司。
1.2方法
1.2.1动物造模、分组及给药观察 小鼠造模:MOG35-55溶于PBS缓冲液,终浓度2 mg/ml;在CFA中加入TB至终浓度5 mg/ml;MOG35-55溶液与CFA按体积1∶1 进行乳化,PT溶液的配制:将0.2 mg/ml PT用PBS缓冲液稀释至1 000 ng/ml;在免疫当日(d 0)乙醚麻醉小鼠,于背部脊柱两侧分两点注射MOG35-55乳化剂200 μg/只,腹腔注射PTX溶液200 ng/只,并观察小鼠麻醉后苏醒状态是否良好;在免疫后第2天(d 2)再次腹腔注射PT 200 ng/只。EAE小鼠症状评分标准根据国际通用的5级评分法[12]:无异常表现0分;部分尾部瘫痪0.5分;尾部完全瘫痪1分;后肢轻度瘫痪或步态不稳2分;后肢完全瘫痪3分;双后肢完全瘫痪,前肢轻度瘫痪3.5分;四肢完全瘫痪4分;濒死状态4.5分;死亡5分。小鼠分组及给药:实验前将所有小鼠称重,以g为单位根据体重分层,按顺序随机抽取各层小鼠,分为3组:a.正常组,蒸馏水0.2 ml/d灌胃,n=5;b.EAE组,蒸馏水0.2 ml/d灌胃,n=15;c. APS组,予APS 500 mg/(kg·d)灌胃,从免疫当日起直至观察终点,n=15。根据EAE小鼠症状评分观察APS的药效。
1.2.2BV-2神经小胶质细胞培养及活化模型的建立 BV-2细胞培养采用完全培养基:79%RPMI1640+20%灭活血清+1%青-链霉素双抗,培养条件:37℃、5%CO2。活化模型建立:取对数生长期的BV-2细胞,离心后弃上清,重悬细胞,稀释,调整细胞密度为104个/ml。取出6孔板,每孔加入2 ml细胞悬液,放入培养箱中培养24 h后,取出后加入不同浓度的LPS(用PBS溶液配备),同时设置对照组,然后将细胞放入培养箱继续培养24 h后取出,放在倒置显微镜下观察细胞形态。MTT法检测细胞活性及毒性:活细胞数目与生成的蓝色结晶物甲瓒数量呈正比例关系,甲瓒在二甲基亚砜(DMSO)中溶解显色,根据显色程度可知甲瓒的数量,从而反应活细胞的数目,进而了解细胞增殖的情况。
1.2.3细胞分组及给药 设置对照组、LPS组、APS组、LPS+APS组,APS设置不同浓度。APS溶液的配置:称取1 g APS,溶解于50 ml PBS溶液中,制成20 mg/ml的APS母液,经滤器过滤除菌后保存于4℃冰箱。使用前用无菌PBS稀释至指定浓度。
1.2.4ELISA法检测BV-2神经小胶质细胞TNF-α、IFN-γ表达水平 按照ELISA试剂盒说明书操作。
1.2.5Western blot法检测BV-2神经小胶质细胞PD-L1的蛋白表达 采用考马斯亮蓝法常规测定样品蛋白浓度。经SDS PAGE凝胶电泳分离蛋白组份后,将蛋白转印于PVDF 膜上,经5% 脱脂奶粉封闭过夜后,分别加入不同一抗室温孵育2 h,再加入HRP 标记的二抗室温孵育2 h,显色后在成像系统中扫描并分析结果。
1.2.6Real-time PCR方法检测BV-2神经小胶质细胞PD-L1的mRNA表达 按照试剂盒说明书提取总RNA,反转录为cDNA。所用基因引物合成及扩增片段:β-actin:Sense:5′-AGAAGGTGGTGAAGCAGGCATC-3′,Antisense:5′-CGAAGGTGGAAGAGTGGGAGTTG-3′;PD-L1:Sense:5′-TTGGGAAATGGA-GGATAAGA-3′,Antisense:5′-GGATGTGCCAGAGGTAGTTCT-3′。采用20 μl 体系,按照试剂盒推荐方案于ABI7500 Real-time PCR仪中进行Real-time PCR 反应,结果采用相对定量法进行分析。
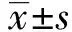
2 结果
2.1APS对EAE小鼠症状的影响 经MOG35-55诱导,EAE模型组小鼠发病起始于造模后第11天,发病高峰出现于造模后第16天,16 d后病情逐渐进入缓解期;EAE 组小鼠临床症状评分最高为3.5分,小鼠相继出现少食、少动、精神萎靡、皮毛干枯、尾部瘫痪、后肢无力、后肢瘫痪、前肢无力等症状;APS组小鼠发病时间及发病高峰期基本与EAE组无明显差异,但其高峰期临床症状评分为1.8分,较未治疗组明显减轻。说明APS对于EAE小鼠的临床症状具有明显的缓解作用,提示APS可以有效治疗EAE(图1)。

图1 APS对EAE小鼠临床症状的抑制作用Fig.1 Inhibitory effect of APS on clinical symptom of EAE mouse
2.2APS对BV-2细胞活化作用的影响 通过文献资料的查阅,在本研究中选择了3个LPS刺激浓度,分别为0.1、1、10 μg/ml,通过与正常组相比较发现,在不同浓度的LPS的刺激下,神经小胶质细胞的形态都发生了显著变化。正常组神经小胶质细胞呈分枝状,胞体小,多为三角形或扁椭圆形,突起长而纤细。LPS刺激后的神经小胶质细胞呈圆形,突起数量减少且短粗,为阿米巴样神经小胶质细胞,其中0.1 μg/ml的LPS刺激后,活化的神经小胶质细胞生存率较高。如图2所示,因此在后面的刺激活化实验中均采取0.1 μg/ml的LPS。

图2 不同浓度的LPS对BV-2细胞的活化作用Fig.2 Effect of different concertration of LPS on activation of BV-2 cellsNote:A-D.The morphology of the microglia after the intervention of LPS in different concentrations.A.Normal BV-2 cells;B.0.1 μg/ml LPS;C.1.0 μg/ml LPS;D.10 μg/ml LPS.
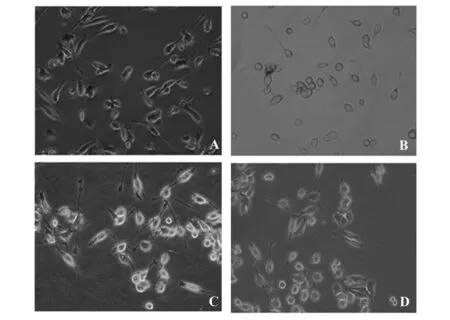
图3 APS抑制BV-2细胞活化Fig.3 APS inhibited BV-2 cell activationNote:A-D.The morphology of the microglia after treatment with APS.A.Normal BV-2 cells;B.0.1 μg/ml LPS;C.0.2 mg/ml APS;D.0.1 μg/ml LPS and 0.2 mg/ml APS.
APS对活化的神经小胶质细胞影响, 图3A为未经LPS活化BV-2细胞,图3B为0.1 μg/ml LPS活化BV-2细胞,图3C为0.2 mg/ml 的APS直接干预BV-2细胞,观察APS对未经LPS活化的神经小胶质细胞影响,图3D为0.1 μg/ml LPS活化BV-2细胞后,加入0.2 mg/ml 的APS观察BV-2细胞的形态学变化。结果显示,APS组与对照组相比,细胞形态没有明显的变化,LPS+APS组与对照组相比,呈圆形,突起数量少且短而粗的阿米巴样神经小胶质细胞数量增多,但是与LPS组相比较,阿米巴样神经小胶质细胞的数量明显减少。由此提示,一定浓度的APS对于LPS诱导的BV-2细胞的活化具有明显的抑制作用,见图3。
2.3APS对活化的BV-2细胞生存活性的影响 如图2可以看出,3个LPS刺激浓度都均可以活化神经小胶质细胞,从细胞形态学上可以初步判断,LPS浓度为0.1 μg/ml时,细胞生存活性较高,为了精确验证不同浓度的LPS对BV-2细胞生存活性的影响,我们通过MTT法进行检测,结果显示,在LPS浓度高于0.1 μg/ml时,细胞生存活性明显下降,差异有统计学意义(P<0.01)。因此,LPS的诱导浓度为0.1 μg/ml更适合本研究,如图4A、表1。
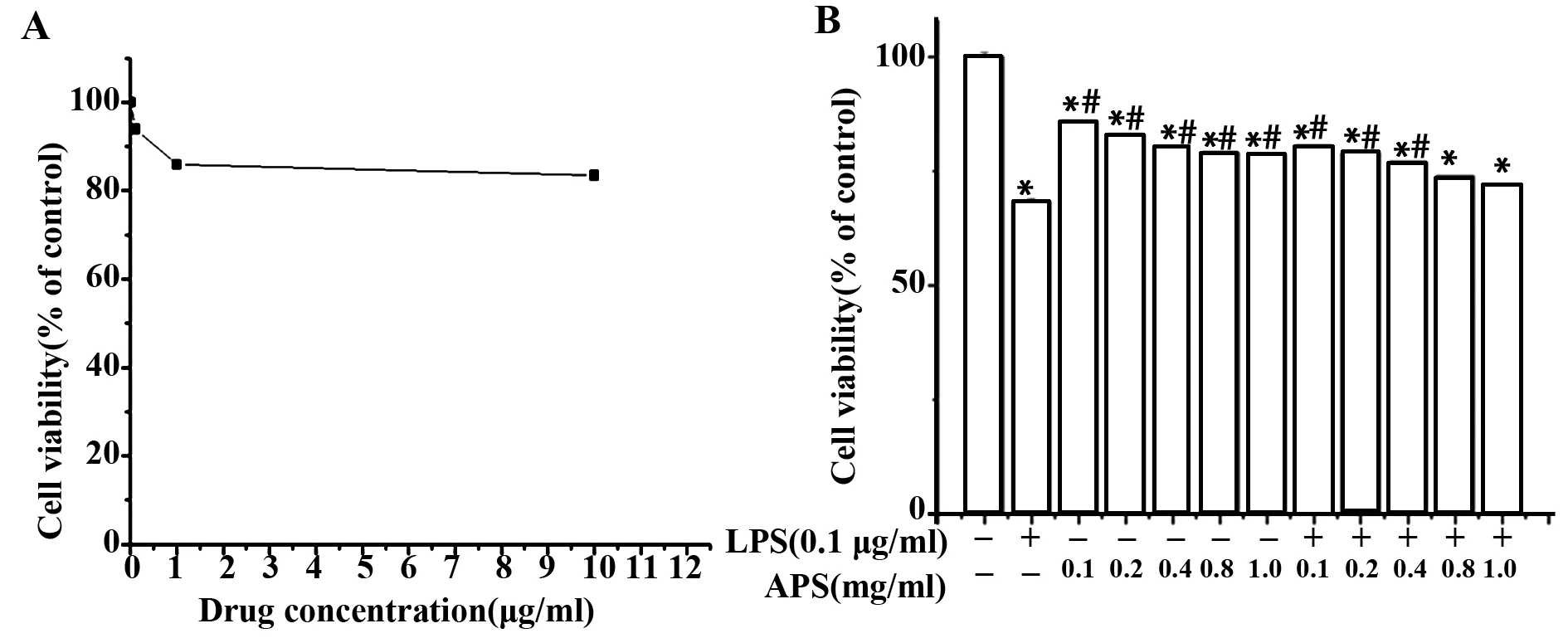
图4 APS提高活化的BV-2细胞的生存活性Fig.4 APS increased viability of active BV-2 cellNote:A.The viability of BV-2 cell after the intervention of LPS in different concentrations by MTT;B.The viability of BV-2 cell after the treatment with APS in different concentrations by MTT.Compared with control group,*.P<0.01;compared with LPS group, # .P<0.01.
表1不同浓度LPS对BV-2细胞生存活性的影响
Tab.1InfluenceofdifferentconcertrationofLPSonviabilityofBV-2cells

Drugconcentration(μg/ml)2hcellviability(%ofcontrol)BV⁃2cell0100 00±0 00580 193 92±0 02421)1 085 85±0 03002)10 083 44±0 04262)
Note:Compared with control group,1)P<0.05;compared with LPS group,2)P<0.01.
表2LPS刺激BV-2神经小胶质细胞后其分泌的TNF-α、IFN-γ的水平增加
Tab.2LPSinducedlevelofTNF-αandIFN-γincreasedinBV-2cells

GroupsTNF⁃α(pg/ml)IFN⁃γ(pg/ml)Controlgroup218 11±1 95147 75±1 77LPSgroup1028 40±14 681)250 61±2 761)
Note:Compared with control group, 1)P<0.01.
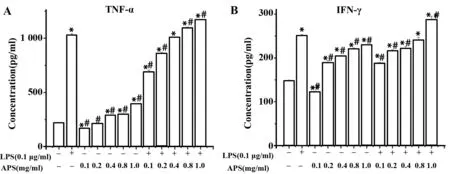
图5 APS对活化的BV-2细胞TNF-α、IFN-γ的分泌水平的影响Fig.5 Influence of APS on expression of TNF-α and IFN-γ in active BV-2 cellsNote:Compared with control group,*.P<0.01;compared with LPS group, #.P<0.01.
通过文献查阅和预实验结果,将APS的作用浓度设置为0.1、0.2、0.4、0.8、1.0 mg/ml。实验分为对照组、LPS组、APS组、实验组(LPS+APS组),结果显示,在BV-2细胞中加入LPS后,细胞活性明显下降(P<0.01),与LPS组相比,实验组加入APS后有效提升了BV-2细胞的生存活性(P<0.01)。当APS浓度大于0.8 mg/ml时,实验组与阳性对照组相比,差异无统计学意义(P>0.05)。结果表明,低浓度的APS可以有效提高LPS诱导活化的BV-2细胞活性,高浓度的APS则不能起到有效地保护作用。结果如图4B所示。
2.4APS对活化的BV-2细胞TNF-α、IFN-γ水平的影响 根据不同浓度的LPS对BV-2细胞生存活性的影响实验,选取LPS的诱导浓度为0.1 μg/ml,干预BV-2神经小胶质细胞24 h后,检测细胞培养上清液中TNF-α、IFN-γ分泌含量,发现经LPS刺激后,LPS组的两种细胞因子分泌水平较对照组明显升高,如表2所示。用5个浓度的APS干预活化后的神经小胶质细胞,如图5所示。结果显示,当APS浓度小于等于0.4 mg/ml时,APS有效地降低了BV-2活化后释放的TNF-α、IFN-γ水平(P<0.01),当APS浓度大于0.4 mg/ml时,将不能降低TNF-α、IFN-γ含量,而且当APS浓度大于等于1.0 mg/ml时,BV-2细胞上清中TNF-α、IFN-γ含量高于阳性对照组(P<0.01)。单独用APS干预的BV-2细胞上清中,2个细胞因子水平无明显变化。综上可得,低浓度的APS能有效地降低LPS活化的BV-2细胞炎性因子TNF-α、IFN-γ的分泌,对正常的BV-2起到抗炎保护作用。高浓度的APS则不具有这种作用,相反,当其浓度高到一定程度时会增加细胞炎性因子TNF-α、IFN-γ的分泌。
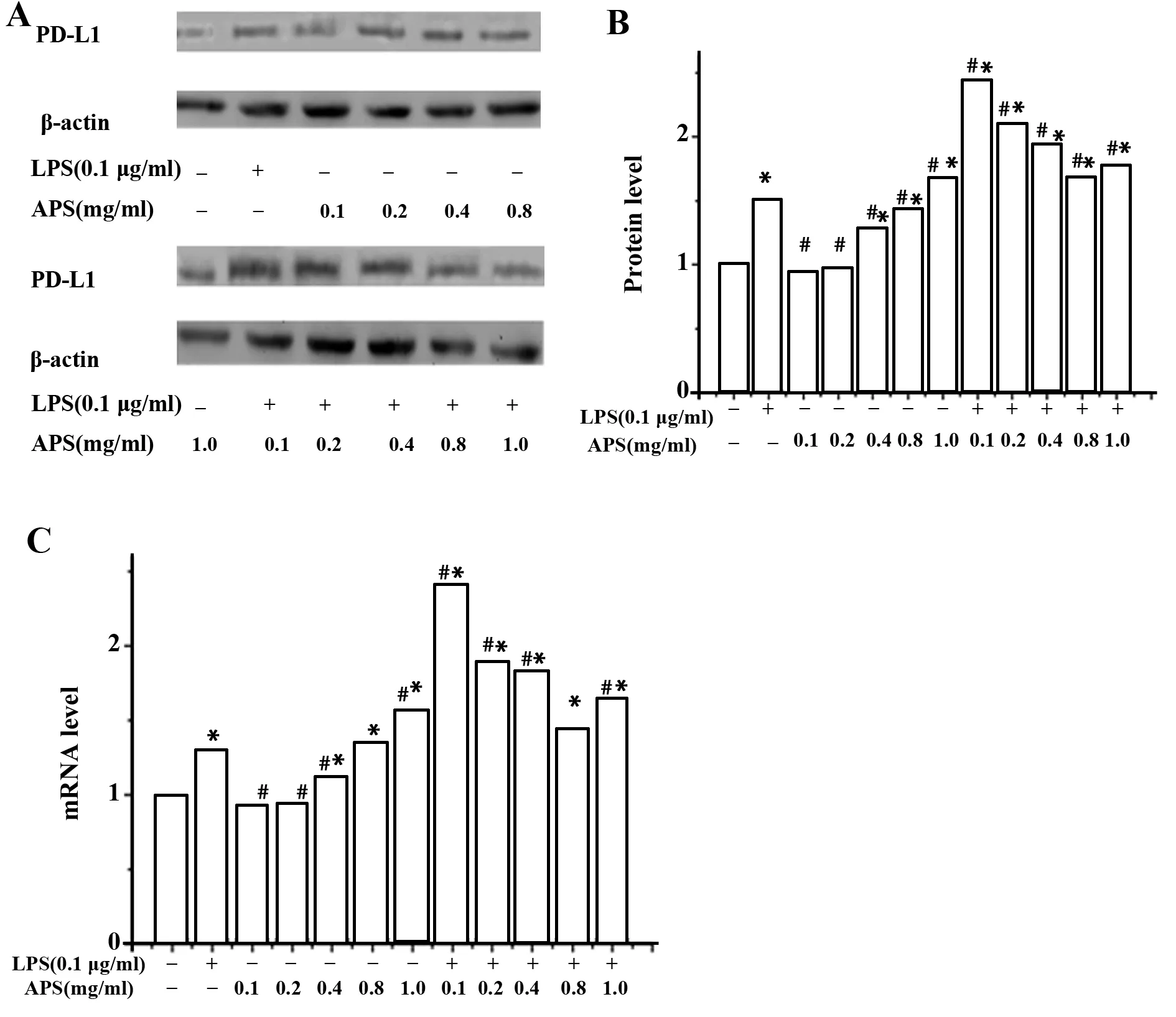
图6 APS对活化的BV-2细胞PD-L1蛋白水平和mRNA水平表达的影响Fig.6 Influence of APS on expression of protein and mRNA of PD-L1 in active BV-2 cellsNote:A.PD-L1 protein expression level in active BV-2 cells treated with APS by Western blot;B.Relative PD-L1 protein level;C.Relative PD-L1 mRNA level by Real-time PCR.Compared with control group,*.P<0.05;compared with LPS group,#.P<0.05.
2.5APS对BV-2神经小胶质细胞的表面共刺激分子PD-L1 mRNA和蛋白表达变化的影响 结果显示,LPS刺激BV-2神经小胶质细胞后,其表面PD-L1蛋白表达及mRNA转录水平略升高,用一定浓度的APS干预后,其表面PD-L1蛋白表达及mRNA转录水平进一步升高,与对照组和LPS组相比,有显著差异。研究结果如图6。
3 讨论
本研究团队在前期工作中观察了中药黄芪对EAE 小鼠的治疗作用,发现,与未治疗的EAE对照组相比较[10],黄芪治疗组小鼠EAE的发病起始及发病高峰时间均有所延迟,且发病高峰期症状评分明显低于EAE组,表明黄芪对EAE 小鼠的临床症状具有缓解作用,实验证实了中药黄芪对EAE具有肯定的治疗效果。在此基础上,发现黄芪能减轻中枢神经系统的炎性反应,抑制MOG35-55特异性T 细胞增殖及IFN-γ、TNF-α、IL-17的分泌,促进IL-4 的分泌。提示黄芪在EAE 发病过程中的治疗通过抑制Th1 和Th17 细胞、促进Th2 细胞功能而发挥作用。为了进一步揭示黄芪治疗EAE的药理机制[10],本实验观察了黄芪的有效成分APS对小鼠EAE临床症状的影响,发现其能够明显改善小鼠EAE的临床症状评分,较黄芪改善作用更为明显,提示APS对小鼠EAE具有肯定的治疗作用。
在证实APS对EAE治疗作用的基础上,本研究进一步探索了APS对小鼠EAE发挥治疗作用的分子机制。近几年来,随着众多学者对MS临床和实验研究的不断深入,发现神经小胶质细胞活化后介导的神经炎性反应在MS/EAE的病理过程中扮演重要角色,抑制神经小胶质细胞的过度活化以及抑制炎性因子的产生成为治疗MS的新策略,因此,本研究团队进一步探索了APS对神经小胶质细胞的调控作用,并从PD-1/PD-L1信号通路探究了体外条件下APS对PD-L1蛋白及基因表达的影响。研究发现,一定浓度的APS可以明显抑制LPS诱导的BV-2神经小胶质细胞分泌的细胞因子TNF-α、IFN-γ,抑制神经小胶质细胞的活化,同时诱导PD-L1 mRNA和蛋白表达上调。众所周知,PD-1/PD-L1信号通路为负性调控信号,所以,APS诱导PD-L1表达增加后,可以抑制神经小胶质细胞的活化,从而抑制炎症因子分泌及对髓鞘的损伤。
神经小胶质细胞广泛分布在CNS,占中枢神经系统整个胶质细胞数目的5%~20%,生理状态时,神经小胶质细胞处于静息态,其表面非常多的细胞突起在不断地伸缩从而探索周围的环境[13],其主要作用是清除死亡的细胞以及轴突碎片,诱导神经元和血管内皮细胞的凋亡,分泌神经营养因子以支持神经元和胶质细胞的正常功能,在神经突起的发育中起引导作用,亦能促进星型胶质细胞的增生,增加髓鞘的形成,刺激中枢神经系统血管形成[14]。当发生感染、损伤或神经元电活动紊乱等病理过程时,静息态的神经小胶质细胞会发生一系列形态、基因表达和功能方面的变化,导致神经小胶质细胞的活化[15]。活化后的神经小胶质细胞在神经系统病理过程中发挥双刃剑的作用,一方面,神经小胶质细胞活化后能够分泌多种炎性介质,如IL-6、IL-23、IL-1β和TNF-α、NO、氧自由基、蛋白水解酶等,对神经元产生毒害作用[16];另一方面,活化后的神经小胶质细胞能够通过抗兴奋毒、抗氧化酶、释放神经营养因子和抗炎因子及免疫吞噬等作用发挥神经保护作用,促进神经再生[17,18]。
APS为中药黄芪的主要活性成分,是黄芪中重要的天然有效成分,具有多重免疫活性,可体现在因剂量不同,作用不同方面,Zhang等[19]发现低剂量的APS对小鼠的CD40、CD86有轻微抑制作用,而高剂量时则表现促进作用,而大多数研究结果也显示APS的作用效果在适当范围内呈现一定的剂量反应关系[20,21]。本研究的结果也呈现为低浓度APS抑制神经小胶质细胞的活化,高浓度则减轻了对神经小胶质细胞活化的抑制作用,剂量与功效有依存关系。本实验研究证实了APS能够抑制LPS诱导的BV-2神经小胶质细胞的活化,提高活化后的细胞生存率,降低活化后BV-2细胞TNF-α、IFN-γ等炎性因子的分泌,以明确APS对EAE的治疗作用和免疫机制。
PD-1/PD-Ls信号通路主要介导中枢和外周T细胞的免疫耐受和调节自身免疫反应,研究发现,PD-1/PD-L1信号通路在EAE的发病机制中具有明显的调控作用[22]。PD-1/PD-L1作为负性免疫调节信号通路,合理的增强或抑制其信号通路已被广泛用于肿瘤免疫治疗、病毒和微生物感染、器官移植和自身免疫性疾病等实验性治疗,并且取得了良好的疗效,美国已有公司研发出重组人类PD-1、PD-L1 抗体,且已被FDA 批准,主要用于某些肿瘤的治疗[23]。本文发现,APS对BV-2神经小胶质细胞PD-L1的mRNA转录水平和蛋白质翻译水平均具有明显的上调作用,从而激活了PD-1/PD-L1分子信号的负调控作用,抑制了炎性细胞因子 TNF-α、IFN-γ分泌,因此,抑制神经系统的炎性反应,最终治疗中枢神经系统炎症性脱髓鞘疾病。
3 结论
APS对小鼠EAE的临床症状有明显的抑制作用,其发挥作用的机制可能是由于APS上调了神经小胶质细胞PD-L1的基因和蛋白表达,进而抑制了神经小胶质细胞的活化,减少了炎性细胞因子IFN-γ、TNF-α的分泌,这为临床应用APS治疗MS等神经系统退行性疾病提供了新的思路和方法。
[1] Lovett-Racke AE.Contribution of EAE to understanding and treating multiple sclerosis[J].J Neuroimmunol,2017,304(5):40-42.
[2] Kurschus FC.T cell mediated pathogenesis in EAE:Molecular mechanisms[J].Biomed J,2015,38(3):183-193.
[3] Wlodarczyk A,Cédile O,Jensen KN,etal.Pathologic and protective roles for microglial subsets and bone marrow and blood-derived myeloid cells in central nervous system inflammation[J].Front Immunol,2015,8(6):463-463.
[4] Colonna M,Butovsky O.Microglia function in the central nervous system during health and neurodegeneration[J].Annu Rev Immunol,2017,35(4):441-468.
[5] Sharpe AH,Wherry EJ,Ahmed R,etal.The function of programmed cell death 1and its ligands in regulating autoimmunity and infection[J].Nat Immunol,2007,3(8):239-245.
[6] Ishida Y,Agata Y,Shibahara K,etal.Induced expression of PD-1,a novel member of the immunoglobulin gene superfamily,upon programmed cell death[J].EMBO J,1992,11(11):3887-3895.
[7] 马俊勇.郑绍周教授治疗多发性硬化经验简介[J].四川中医,2008,26(11):5-6.
Ma JY.Professor Zheng Shaozhou′s experience in treatment of multiple sclerosis[J].J Sichuan Traditional Chin Med,2008,26(11):5-6.
[8] 孙林娟,宁 侠,周绍华.周绍华治疗帕金森病经验[J].中医杂志,2015,56(3):193-194,197.
Sun LJ,Ning X,Zhou SH.ZHOU Shaohua′s Experience in Treating Parkinson′s Disease[J].J Traditional Chin Med,2015,56(3):193-194,197.
[9] 吕海兵.中医药分型论治老年痴呆症疗效观察[J].现代中西医结合杂志,2013,22(11):1209-1210.
Lv HB.Curative effect observation of TCM syndrome differentiation of alzheimer′s disease[J].Modern J Integrated Traditional Chin Western Med,2013,22(11):1209-1210.
[10] 孙 宇,王水英,黄梦汶,等.黄芪对实验性自身免疫性脑脊髓膜炎小鼠的治疗作用及机制研究[J].上海中医药大学学报,2013,27(4):56-62.
Sun Y,Wang SY,Huang MW,etal.Therapeutic effect and immunomodulatory mechanism of radix astragali seu hedysari on experimental autoimmune encephalomyelitis mouse[J].Acta Uni Traditionis Medicalis Sinensis Pharmacologiaeque Shanghai,2013,27(4):56-62.
[11] 安松兰,张善玉,朴惠顺.年生黄芪中黄芪多糖对小鼠免疫器官指数的影响[J].延边大学医学学报,2007,30(1):20-22.
An SL,Zhang SY,Piao HS.Effects of polysaccharides from the annual Astragalus on immuno-organs coefficients on mice[J].J Med Sci Yanbian Uni,2007,30(1):20-22.
[12] Stromnesk IM,Goverman JM.Active induction of experimental allergic encephalomyelitis[J].Nat Protocols,2006,1(4):1810-1819.
[13] Davalos D,Grutzendler J,Yang G,etal.ATP mediates rapid microglial response to local brain injury in vivo[J].Nat Neurosci,2005,8(6):752-758.
[14] Sasaki A.Microglia and brain macrophages:An update[J].Neuropathology,2017,37(5):452-464.
[15] 李小媚,李爱萍.小胶质细胞的发育和功能[J].解剖学研究,2010,32(3):213-217.
Li XM,Li AP.The development and function of microglial cells[J].Anatomy Res,2010,32(3):213-217.
[16] Prinz,M,Priller J.Microglia and brain macrophages in the molecular age:from origin to neuropsychiatric disease[J].Nat Rev Neurosci,2014,15(5):300-312.
[17] Yang X,Asakawa T,Han S,etal.Neuroserpin protects rat neurons and microglia-mediated inflammatory response against oxygen-glucose deprivation-and reoxygenation treatments in an in vitro study[J].Cell Physiol Biochem,2016,38(4):1472-1482.
[18] Schafer DP,Lehrman EK,Kautzman AG,etal.Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner[J].Neuron,2012,74(4):691-705.
[19] Zhang NW,Li JF,Hu YX,etal.Effects of astragalus polysaccharide on the immune response to foot-and-mouth disease vaccine in mice[J].Carbohydrate Polymers,2010,82(3):680-686.
[20] Zhang CL,Ren HJ,Liu MM,etal.Modulation of intestinal epithelial cell proliferation,migration and differentiation by astragalus polysaccharides on lipopolysaccharide-induced TNF-α and IL-1β[J].PLoS One,2014,9(8):e106674.
[21] He XJ,Shu J,Xu L,etal.Inhibitory effect of astragalus polysacc-harides on lipopolysaccharide-induced TNF-α and IL-1β production in THP-1 cells[J].Molecules,2012,17(3):3155-3164.
[22] Cheng X,Zhao Z,Ventura E,etal.The PD-1PD-L pathway is up-regulated during IL-12 induced suppression of EAE mediated by IFN-gamma[J].J Neuroimmunol,2007,185(1-2):75-86.
[23] Okazaki T,Honjo T.PD-1 and PD-1 ligands:from discovery to clinical application[J].Int Immunol,2007,19(7):813-824.

