颅脑损伤后血清IL-1β IL6的变化及临床意义
钟 宝 万 野 邹 敏 熊小军
荆门市第二人民医院神经外二科,湖北 荆门 448000
随着工业和交通的不断发展,各种创伤事故的发生率逐年攀升,其中致死率和致残率最高是颅脑损伤,占创伤总数的9%~21%[1]。颅脑损伤后,以炎症和免疫为主的应激反应损伤大脑神经元组织,致其变形进而死亡,但随着研究不断深入,有学者发现,创伤发生后机体释放的许多细胞因子均可引起机体更大范围的炎性反应,对脑组织造成二次损伤即继发性脑损伤,是导致患者病死率升高及不良预后的主要原因[2]。细胞因子IL-1β、IL-6的表达能够促进炎症细胞的生成以及嗜中性粒细胞的聚集从而破坏大脑血脑屏障,是引起颅脑损伤后早期损伤的主要因素[3]。本研究通过测定炎症因子IL-1β、IL-6在颅脑损伤患者血清中的含量变化,探讨IL-1、IL-6与颅脑损伤程度、预后的关系及临床意义。
1 资料与方法
1.1临床资料选取2012-01—2015-12荆门市第二人民医院收治的256例颅脑损伤患者为研究对象(观察组),男172例,女84例,平均年龄45岁。同期本院门诊体检正常者(对照组)50例,男34例,女16例,平均年龄42岁。2组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。观察组按格拉斯哥昏迷评分(GCS)[4]分为颅脑损伤重度组65例,中度组93例,轻度组98例,各组患者年龄、性别、受伤原因以及病变部位比较差异均无统计学意义(P>0.05)。见表1。
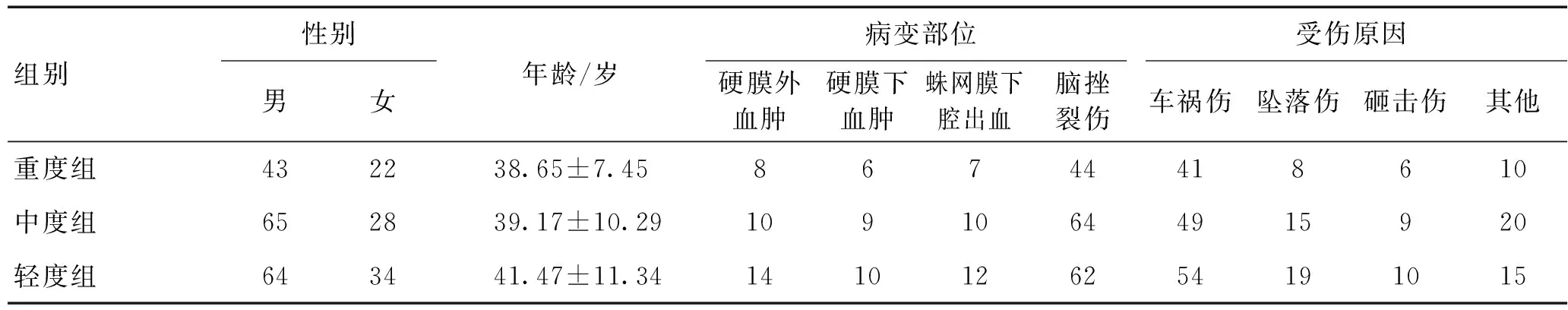
表1 不同颅脑损伤患者基本资料比较
1.2方法所有颅脑损伤患者均在颅脑受伤后第1、3、5、7、10、14天测量血清IL-1β、IL-6。检测方法:早晨空腹状态下,取外周静脉血5 mL,置于抗凝管中,1 500 r/min速度进行离心20 min,充分离心后取上清液置于-20 ℃冰箱中备用。本研究应用的试剂盒为人白介素-1β ELISA试剂盒、人白介素-6 ELISA试剂盒以及中性缓冲液(PBS),所有试剂盒均由武汉博士德公司提供,采用酶联免疫吸附剂测定方法(ELISA),严格按照试剂盒要求进行操作。
2 结果
2.1 IL-1β测定结果4组之间IL-1β含量两两比较,轻度组、中度组以及重度组在受伤后每个时间点IL-1β含量均显著高于对照组(P<0.05);轻度组与中度组IL-1β含量无明显差异(P>0.05);但轻度组、中度组分别与重度组比较,差异均有统计学意义(P<0.05)。见表2。
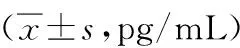
表2 各组每个时间点测量IL-1β含量比较
注:与颅脑损伤重、中、轻度组比较,*P<0.05;与轻度组、中度组比较,&P<0.05
2.2 IL-6测定结果4组IL-6含量两两比较,轻度组、中度组及重度组在受伤后每个时间点IL-6含量均显著高于对照组(P<0.05);轻度组与中度组IL-6含量比较无明显差异(P>0.05);但轻度组、中度组分别与重度组比较,差异均有统计学意义(P<0.05)。见表4。
2.3不同预后患者IL-1β测定结果死亡组IL-1β含量显著高于重残、中残,良好组,植物状态组IL-1β含量显著高于重残、中残,良好组,重残组IL-1β含量显著高于中残、良好组(P<0.05);死亡组与植物状态组间IL-1β含量无明显差异(P>0.05);中残组与良好组间无明显差异(P>0.05)。见表5。
2.4不同预后患者IL-6测定结果死亡组IL-6含量显著高于重残、中残,良好组,植物状态组IL-6含量显著高于重残、中残、良好组,重残组IL-6含量显著高于中残、良好组(P<0.05);死亡组与植物生存组间IL-6含量无明显差异(P>0.05);中残组与良好组间无明显差异(P>0.05)。见表6。
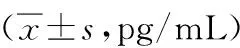
表4 各组每个时间点测量IL-6含量比较
注:与颅脑损伤重、中、轻度组比较,*P<0.05;与轻度组、中度组比较,&P<0.05
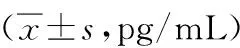
表5 不同预后患者组IL-1β含量比较
注:与预后良好,中残组比较,*P<0.05;与预后重残组比较,&P<0.05
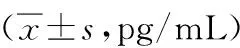
表6 不同预后患者组IL-6含量比较
注:与预后良好,中残组比较,*P<0.05;与预后重残组比较,&P<0.05
3 讨论
颅脑损伤是临床致死率和致残率较高的创伤急症,是当前神经外科需要攻克的难点、重点[5-6]。研究表明,颅脑损伤包括创伤引起的原发性伤害以及炎症反应引起的脑组织继发性损伤,其中继发性损伤是导致病死率、致残率较高的主要原因。创伤引起的脑组织缺血缺氧可诱发以炎症细胞生成、嗜中性粒细胞聚集为特点的炎症反应,破坏大脑血脑屏障改变脑组织环境,引起脑组织继发损伤[7]。目前临床试验、动物实验均发现,白细胞介素IL-1β、IL-6在颅脑损伤继发炎症反应中发挥至关重要的作用,人体颅脑损伤后IL-1β、IL-6在脑脊液及血清中均呈高水平表达,而二者水平的高低与脑组织的损伤程度存在一定关系[8-9]。
IL-6是参与调剂免疫功能的重要细胞因子;IL-1β是IL-1中家族中与颅脑损伤关系最为密切的炎症因子,主要由神经胶质细胞分泌,具有促进神经胶质细胞生长的作用,参与神经的创伤与修复过程[10]。IL-6和IL-1β在正常脑组织中含量也极少,缺血、缺氧状态下迅速大量表达,引起脑组织继发水肿,是脑缺氧的病理生理学基础,机制是IL-1β、IL-6高水平表达可以聚集大量炎症细胞,如中性粒细胞,嗜酸性粒细胞,单核细胞等,炎症细胞的大量聚集和激活一方面使体内某些免疫反应增强,另一方面改变血管内外的渗透压,引起血管结构变化,破坏血脑屏障,导致脑组织二次损伤[11]。同时IL-1β、IL-6高水平表达对于炎症反应具有“瀑布效应”,可以促进炎性反应上下游的反应通路,引发大范围的炎症反应,导致脑组织继发性损伤[12]。
本研究中,颅脑损伤组第1、3、5、7、10、14天IL-1β、IL-6含量显著高于对照组,重度组各时间点IL-1β、IL-6含量显著高于轻度组、中度组。可见,IL-1β、IL-6在血清中的含量可以做为反应颅脑损伤程度的重要指标。KOSSMANN等[13]通过实验得出IL-6的含量升高与颅脑损伤程度存在正相关关系,并且认为IL-6可以作为颅脑损伤程度的重要指标。Hayakata等[14]发现,颅脑损伤患者1L-1β的含量明显高于正常人,与颅脑损伤程度呈正相关。本研究发现,死亡组IL-1β、IL-6含量比重残、中残,良好组高,植物状态组含量高于重残、中残、良好组,重残组含量高于中残、良好组,可见IL-6、IL-1β的含量与颅脑损伤患者的预后也存在一定关系,含量越高预后越差。安模[15]等通过对颅脑损伤患者的严重程度以及不同预后情况进行分组,测量脑脊液、血清中IL-6、IL-1β含量,分析结果得出IL-6、IL-1β含量高低不仅与颅脑损伤程度存在正比例关系,同样与预后的严重程度也存在正比例关系。综上所述,检测颅脑损伤患者血清中IL-6、IL-1β水平,为临床颅脑损伤的诊治工作提供了一条新思路,有助于医师能够尽快对患者作出准确的临床诊断,从而及时有效制定相关的治疗方针。
[1] 费舟,屈延.颅脑创伤的循证医学思考[J].中华神经医学杂志,2014,13(5):433-437.
[2] KEEL M,TRENTZ O.Pathophysiology of polytrauma[J].Injury,2005,36(6):691-709.
[3] 张中原.颅脑损伤后血清、脑脊液IL1β,IL6的变化及临床意义[D].天津:天津医科大学,2012.
[4] 王忠诚.王忠诚神经外科学[M].武汉:湖北科学技术出版社,2005:284.
[5] JOHNSON V E,MEANEY D F,D KACY C,et al.Animal models of traumatic brain injury[J].Handbook of Clinical Neurology,2015,127(1):115-139.
[6] MENG X,ZHANG Y,LI N,et al.Effect of hyperbaric oxygen therapy on Akt signaling pathway in secondary injury associated with brain trauma[J].Int J Clin Exp Med,2016,9(3):6 539-6 544.
[7] 张为丹,赵敬,翟瑄.脑创伤后炎症反应与免疫抑制[J].重庆医科大学学报,2016,41(1):1-4.
[8] HOLMIN S,MATHIESEN T.Intracerebra administra-tion of interleukin-1beta and induction of inflammation.Apoptosis and vasogenicedema[J].J Neurosurg,2000,92(1):108-120.
[9] 唐芳芳.TLR4、NF-κB及IL-1β在创伤性脑损伤大鼠脑组织中的表达[D].郑州:郑州大学,2015.
[10] WOODROOFE M N.Cytokine production in the central n-ervous system[J].Neurology,1995,45(6):6-10.
[11] REINSFELT B,RICKSTEN S E,ZETTERBERG H,et al.Cerebrospinalfluid markers of brain injury,inflammation,and blood-brain barrier dysfunction in cardiac surgery[J].Ann Thorac Surg,2012,94(2):549-555.
[12] LEE S H,KIM B J,KIM Y B,et al.IL-1 β induction and IL-6 suppression are associated with aggravated neuro-nal damage ina lipopolysaccharide-pretreated kainic acid-induced rat pupseizure model[J].Neuroimmunomodulation,2012,19(5):319-325.
[13] KOSSMANN T,HANS V H,IMHOF H G.Intrathe-cal and serum interleukin-6 and the acute-phase response in patients with severe traumatic brain injury[J].Shock,2000,17(3):308-315.
[14] HAYAKATA T,SHIOZAKI T,TASAKI O,et al.Change in CSFS100B and cytokine concentration in early-phase severe traumatic brain injury[J].Shock,2004,22(2):102-107.
[15] 安模,苗露,黄春云,等.急性颅脑损伤患者血清及脑脊液中炎性因子的变化及临床意义[J].国际神经病学神经外科学杂志,2013,40(5/6):408-411.

