布地奈德联合肺泡表面活性物质气管内滴入治疗早产儿重症呼吸窘迫综合症的疗效研究
,,
(南华大学附属郴州市第一人民医院儿童医院新生儿科,湖南 郴州 423000)
早产儿肺发育未成熟,肺泡表面活性物质(Pulmonary surfactant,PS)分泌不足或尚未分泌,导致肺泡不能完全膨胀,肺通气及换气功能出现障碍,可进展为呼吸窘迫综合症(Respiratory distress syndrome,RDS)。RDS可引起严重并发症,一旦确诊,需积极治疗。PS为抢救早产儿RDS的临床指南用药,布地奈德(Budesonide)为一种新型吸入型的非卤化激素,同时具备较强的水溶性和脂溶性,可充分与激素受体相结合,起效较快、抗炎效果较显著,还可促进肺泡Ⅱ型细胞合成及分泌PS,进一步改善临床症状,且布地奈德很少进入循环系统,不容易引发全身副反应。理论上,以PS联合布地奈德气管内滴入更有利于抑制肺部炎症,改善RDS病情。
1 资料与方法
1.1一般资料选择2014年1月~2015年12月郴州市第一人民医院儿童医院NICU收治的体重小于1 500 g早产儿。入选标准:①出生后8 h内首次入院,出生体重<1 500 g;②按标准[1]诊断为:RDS III至IV级;③适于胎龄儿。 排除:①严重先天遗传代谢性疾病,致死性的先天性心脏病,严重的神经系统异常及先天畸形;②入院时已合并有大量肺出血、颅内出血、休克的危重患儿;③入院前出生已经超过8 h的患儿;④治疗过程中死亡或家属要求放弃治疗者。
1.2分组本研究征得医院伦理委员会、药事委员会及所有纳入患儿家属的同意后,随机采用PS+布地奈德或PS治疗,将纳入患儿分为研究组(PS+布地奈德组)和对照组(PS组)。共56例患儿入选,通过随机分配,研究组入选20例,1例20天时因败血症家属要求放弃治疗,1例因为经济原因,住院10天放弃治疗,均予以排除,最终研究组共纳入18例。对照组入选36例,8例由于不同原因家属要求放弃治疗,予以排除,最终对照组共纳入28例,两组在性别、胎龄、体重、分娩方式、产前使用激素等情况比较,差异均无统计学意义(P>0.05)。
1.3给药方法及途径两组患儿首次给药的时间均控制在出生8 h以内。将PS预热至37 ℃左右,采用无菌注射器抽吸出药物,研究组将布地奈德(用量:0.25 mg/kg)加入预温好的PS溶液(用量:150 mg/kg)注射器中,轻轻转动充分混匀,接头皮针刺入气管导管中上1/3处,将患儿上身抬高30°,按仰卧位给药,缓慢推注注射器使药物缓慢滴入气管内,于5 min内完成,滴入时进行复苏囊加压给氧,完毕后继续加压给氧5 min,有助于液体药物均匀分布于肺内,完毕后再次接呼吸机辅助通气,参数仍为给药前状态。给药后6 h内禁止气管内吸痰。根据病情需要(即复查胸片提示RDS征象未明显好转或呼吸机参数未明显下降,考虑肺内仍缺乏PS),每8~12 h,可再次使用PS 1次,再次使用时不再加布地奈德。对照组采取相同的给药方法,使用PS(用量:150 mg/kg))时不加入布地奈德,根据病情需要(同上),每8~12 h可再次使用PS 1次。
1.4药品及来源布地奈德:吸入用布地奈德混悬液,商品名:普米克令舒,英文名:Budesonide Suspension for Inhalation),1 mg:2 mL/支,澳大利亚AstraZeneca公司生产。PS的通用名:猪肺磷脂注射液,商品名:固尔苏,英文名:Poractant Alfa injection),240 mg/支,意大利凯西制药公司(Chiesi Farmaceutici S.p.A)生产。
1.5机械通气方案无创呼吸机:美国鸟牌公司(BIRD)产,型号:SIPAP呼吸机;有创呼吸机有:美国熊牌公司(Bear Medical Systems)产,型号:CUB 750 PSV,德国斯蒂芬公司(STEPHAN)产,型号:科迪娜(Christina)小儿呼吸机。 血气分析仪:丹麦雷度公司(Radiometer)产,型号:ABL800FLEX。使用呼吸机时,采用肺保护通气模式,尽量避免过高的呼吸机参数对患儿肺组织造成损伤。当吸入气中的氧浓度分数(Fraction of inspired oxygen,FiO2)>30%,血气分析示:动脉血氧分压(Partial pressure of oxygen,PaO2)<50 mmHg或者反复呼吸暂停给予经鼻持续性正压通气(Continuous Positive Airway Pressure,CPAP);当CPAP治疗失败或CPAP通气:FiO2>60% 、PO2<50 mmHg或二氧化碳分压(Partial Pressure of Carbon Dioxide,PCO2)>60 mmHg时给予气管插管有创呼吸机辅助通气,并根据临床表现、血气分析、血氧饱和度(Oxygen saturation,SPO2)等情况,调整呼吸机参数。当吸气峰压(Peak Inspiratory Pressure,PIP)降至25 cmH2O以下时,根据病情每次下降5%的吸入氧浓度,直至40%;然后酌情降低通气频率(Breathing rate,RR)、PIP及FiO2,至PIP≤16 cmH2O,RR≤30次/分,FiO2≤30%时,能维持血气结果在正常范围,吸痰时短暂脱离呼吸机无呼吸窘迫和(或)血氧饱和度明显下降,患儿疾病处于恢复期,感染基本控制,一般情况良好,予以拔除气管导管,改用无创呼吸机,行CPAP辅助通气。
1.6观察指标记录用药前、用药后24、48 h两组间呼吸机主要参数PIP、RR、FiO2的变化情况;分别于用药前10 min、用药后24、48 h抽取0.5 mL动脉血,立即送检,记录血气分析: PaO2、肺泡-动脉血氧分压差(Alveolar-arterial PO2difference,PA-aO2),并计算相应时间点的氧合指数(Oxygenation index,OI)值;记录有创呼吸机通气时间、撤机时间、住院天数等情况,记录患儿脑室内出血(intraventricular hemorrhage ,IVH)、肺出血、早产儿视网膜病(retinopathy of prematurity,ROP)、小肠结肠坏死性炎症(necrotizing enterocolitis,NEC)、呼吸机相关性肺炎(Ventilator associated pneumonia,VAP)等住院期间的相关并发症例数。
1.7统计学处理采用 SPSS 19.0 软件进行统计分析。定性资料以例数及百分比表示,采用RxC列联表资料的χ2检验或Fisher确切概率分析;计量资料进行组间比较前,首先对两组定量质量行正态性检验及方差齐性检验,符合正态分布的定量资料以均数±标准差表示,对两组进行均数比较,采用独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1再次使用PS情况研究组中无患儿再次使用PS,对照组中有2例患儿再次使用了1次PS。
2.2呼吸机主要调节参数比较用药前、用药后24、48 h两组患儿的呼吸机参数:PIP、RR以及FiO2比较。用药前,两组间呼吸机参数3项指标的差异均无统计学意义;用药前与用药后24 h比较,三项指标间的差异均有统计学意义(PPIP=0.01,PRR、PFIO2<0.001);用药后24 h,两组间3项指标的均值差异比较,差异无统计学意义(P>0.05);用药后48 h,两组间的PIP、FiO2比较,研究组小于对照组,差异有统计学意义(P<0.05)。详见表1。
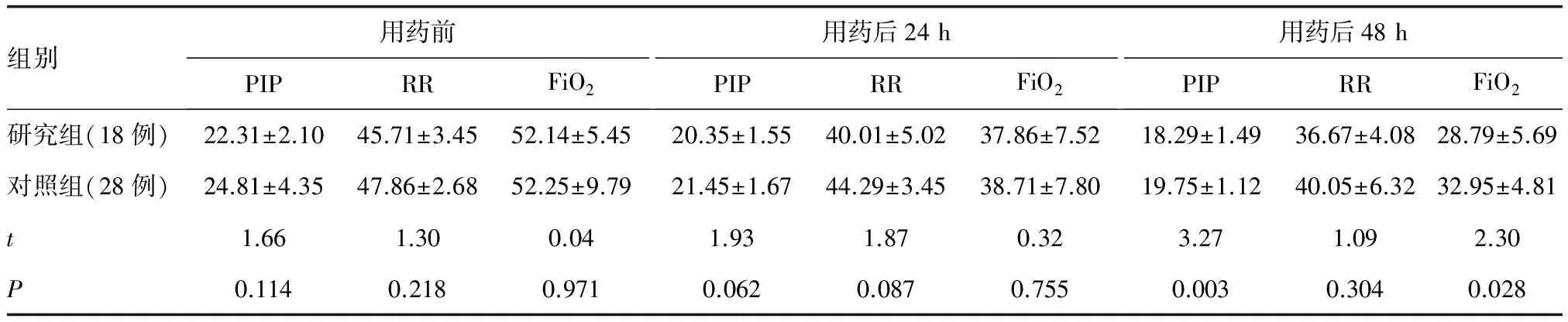
表1 用药前后两组间PIP、RR、FiO2均值变化比较
注: PIP单位为:cmH2O,RR单位为:次/分,FiO2=(21+氧流量*4)/100
2.3肺氧合功能参数比较用药前两组间PaO2值、PA-aO2值、OI值的差异均无统计学意义;用药前与用药后24h比较,三项指标间的差异均有统计学意义(PPaO2、PPA-aO2、POI<0.001);用药后24、48h比较:研究组3项指标的均值均小于对照组,通过两独立样本t检验分析,差异无统计学意义(P>0.05)。详见表2。
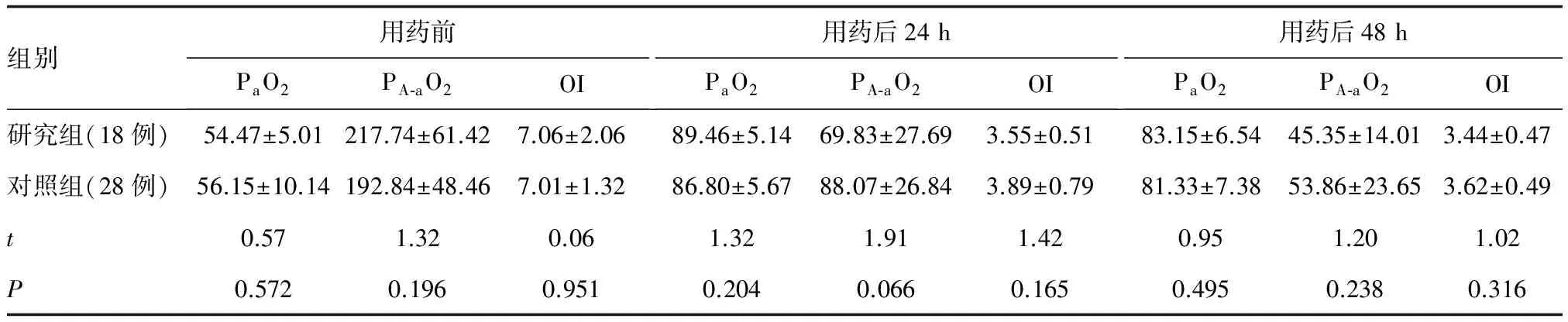
表2 用药前后两组间PaO2、PA-aO2、OI均值变化比较
注:①PA-aO2=(PiO2-PaCO2×1/R)-PaO2,PiO2为吸入气氧分压,PiO2=FiO2×(大气压-47),R为呼吸商,单位为:mmHg。②OI值由公式:MAP×FiO2×100/PaO2计算得出;MAP(Mean Airway Pressure)为平均气道压。MAP值由公式:(PIP×Ti+PEEP×Te)/(Ti+Te)计算得出,Ti(Inspiration time)为吸气时间,Te(Expiration time)为呼气时间
2.4有创呼吸机使用时间、撤机时间、住院时间比较:研究组与对照组平均有创呼吸机使用时间、撤机时间(有创呼吸机+CPAP)、住院时间分别为:3.55±1.35天vs4.78±1.52天、26.98±12.56天vs35.67±12.39天、44.38±12.84天vs54.12±12.92天,两两比较,差异有统计学意义(P<0.05)。见表3。

表3 平均有创呼吸机使用时间、撤机时间、住院时间两两比较
2.5住院期间并发症发生比较研究组和对照组IVH、ROP、肺出血、败血症、NEC、VAP发生率间差异均无统计学意义(P>0.05)。
3 讨 论
肾上腺糖皮质激素(glucocorticoids,GCs)已广泛应用于婴幼儿哮喘及其他炎性或免疫疾病,但婴幼儿全身静脉应用糖皮质激素可能造成严重的并发症:如高血糖、高血压、胃肠道出血、NEC等,以及远期的脑瘫、神经功能障碍等[2],其在新生儿疾病中的应用受到极大限制。而布地奈德是一种新型的糖皮质激素,以PS为载体加入布地奈德一同气管内滴入肺内,可达到肺内局部抗炎的作用[3],其在肺部使用的安全性及疗效性,已得到了部分研究[4,5]的证实。
本组资料显示,两组患儿用药后24 h肺氧合功能参数PA-aO2、OI均值明显低于用药前(P<0.001),PaO2均值大于用药前(P<0.001),呼吸机参数PIP、RR、FiO2均值较用药前明显下降(P<0.001),提示两组患儿肺氧合功能和RDS的症状均较治疗前明显改善。研究组和对照组于用药后24、48 h相互比较,研究组PA-aO2、PaO2高于对照组,OI低于对照组,但差异无统计学意义,与晏路标等[6]的研究一致,其报道布地奈德联合PS与单用PS治疗RDS患儿相比,患儿肺功能指标及血气指标的改善,在2天后才出现疗效差异(P<0.05),而本研究只进行48 h的短期疗效对比研究。研究组用药后24 h、48 hPIP、FiO2、RR均较对照组低,但用药后24 h两组间比较差异无统计学意义(P>0.05),用药后48 h,研究组PIP及FiO2与对照组比较,差异有统计学意义,表明联合用药较单纯使用PS治疗重症RDS能更有效改善患儿的缺氧症状,与杜凤玲等[5]研究报道相似。在用药后24 h,呼吸机参数下降最为明显,考虑主要为PS起了作用。PS进入肺泡后,分布于肺泡表面,萎陷的肺泡得以复张,建立了有效的气体交换平面,迅速改善RDS患儿的缺氧症状,呼吸机参数明显降低,OI明显好转。用药48 h后,研究组呼吸机PIP、FiO2均值低于对照组(P<0.05),提示布地奈德抗炎反应起了一定作用。究其原因,气管插管、密闭吸痰、机械性通气难免对尚未成熟的肺造成了机械性及高氧损伤,肺组织损伤后病原菌容易入侵,早期可发生由细胞因子介导的瀑布式炎性反应,而加入布地奈德后有助于控制肺内炎性反应,降低PS的消耗,提高PS浓度,减少肺泡萎陷,能改善肺部通气,有益于患儿的治疗和病情恢复[7]。有研究[8]显示,早产儿肺发育不成熟,GCs缺乏和其受体反应功能低下,外源性加入GCs提高了肺内GCs水平,同时也增加了受体的敏感性。
研究组平均有创呼吸机使用天数、撤机天数、住院天数均低于对照组,差异有统计学意义(P<0.05),表明对于重症RDS患儿,布地奈德联合PS可更快改善肺功能、降低患儿需氧浓度,有利于呼吸机早期撤离并减少肺损伤,优于单纯使用PS的临床疗效,研究结果与近期相关报道[9,10]相似。
患儿住院治疗期间,两组主要并发症,如:NEC、ROP、肺出血、VAP、PVL的发生率无统计学差异(P>0.05),提示气管内滴入布地奈德肺内局部使用相对安全。
本研究的不足之处,研究所收集的样本量有限,可能存在一定的误差。目前有关PS联合布地奈德气管内滴入治疗重症RDS的临床研究报道较少,没有具体的使用次数、剂量等临床经验供参考,因此,不同剂量、不同剂型的布地奈德、PS组合对RDS的临床疗效是否产生影响,尚待进一步研究和总结。此外,如何更科学合理地使用布地奈德值得进一步深入探讨。
[1] 邵肖梅,叶鸿瑁,丘小汕.等 实用新生儿学[M].北京:人民卫生出版社,2011:396.
[2] 杜立中.早产儿支气管肺发育不良防治新理念[J].中国实用儿科杂志,2014,29(1):12-5.
[3] Chia-Feng Y,Chih-Hsueh L,Shr-Yun C,et al.Intratracheal budesonide supplementation in addition to surfactant improves pulmonary outcome in surfactant-depleted newborn piglets[J].Pediatric Pulmonology,2013,48 (2):151-9.
[4] 刘静,万俊.布地耐德、肺表面活性物质气管内滴入防治早产儿呼吸窘迫综合征[J].临床肺科杂志,2011,16(8):1255-6.
[5] 杜凤玲,董文斌,赵帅,等.布地奈德联合猪肺磷脂注射液预防早产儿支气管肺发育不良[J].中华实用儿科临床杂志,2016,31(11):846-50.
[6] 晏路标,韩树萍,储晓彬,等.肺表面活性物质联合布地奈德对急性呼吸窘迫综合征极低出生体质量儿肺功能的影响[J].实用儿科临床杂志,2011,26(18):1400-2,1457.
[7] Wu S Y,Chen C M,Kuo Y T,et al.Budesonide therapy in preterm infants to prevent bronchopulmonary dysplasia[J].Neoreviews,2012,13(8):467- 75.
[8] 阎锡新,李宏林,刘丽娟,等.糖皮质激素对不同诱因急性肺损伤大鼠炎症反应、激素受体水平的影响[J].国际呼吸杂志,2006,26(10):724- 7.
[9] 储晓彬,晏路标,韩树萍,等.肺表面活性物质联合布地奈德干预治疗对伴呼吸窘迫综合征的低出生体质量儿心功能的保护作用[J].实用儿科临床杂志,2012,27(14):1116- 8,1126.
[10] Venkataraman R,Kamaluddeen M,Hasan S U,et al.Intratracheal administration of budesonide-surfactant in prevention of bronchopulmonary pysplasia in very low birth weight infants:a systematic review and meta-analysis[J].Pediatric Pulmonology,2017,52(7):968-75.

