1株芘降解酵母菌HXY-5的筛选鉴定及对芘的降解研究
邓 超, 周振宇, 张家傲, 徐梦婷, 张陈齐, 卜 宁
(沈阳师范大学 生命科学学院,辽宁 沈阳 110034)
多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)是一类含有两个或两个以上苯环或杂环的有机化学污染物[1-2],广泛分布于空气、水体、土壤以及植物等环境中,许多PAHs具有持久性、生物积累性以及高生物毒性等特点,可致畸、致癌和致突变,对人类健康和生态环境造成巨大危害[3]。芘是高分子量PAHs的典型代表,具有稳定的分子结构和不易降解性,是检测环境PAHs污染的指示物[4-5]。微生物种类多样且代谢速率高效,是修复治理环境PAHs等有机污染物的有效途径之一[6]。已有的研究表明,许多细菌、真菌等对PAHs都具有降解作用[7],目前已分离出的PAHs降解菌主要包括假单胞菌属(Pseudomonas)[8]、红球菌属(Rhodococcus)[9]、气单胞菌属 (Aeromonas)[10]、 芽胞杆菌属(Bacillus)[11]、伯克氏菌属(Burkholderia)[12]和分支杆菌属 (Mycobacterium)[13]等。相对于细菌来说,真菌降解PAHs的效率虽然通常高于细菌,在降解高环PAHs方面表现突出,但种类并不多,特别是有关芘降解的酵母菌方面的研究较少。本研究以分离得到的酵母菌为研究对象,探究其对芘的降解情况,为其在环境修复中的实际应用提供参考。
1 材料与方法
1.1 材料
1.1.1 污染土壤样品 供试土样采自沈抚污灌渠三宝屯区段的污灌底泥。随机选取5个采样点,用抓斗式采泥器分别采集灌渠底泥,将采集的5份土样混匀、分装,于无菌纸袋中4 ℃冰箱保存,备用。
1.1.2 培养基(g/L) 无机盐液体培养基:MgSO4·7H2O 0.5,CaCl20.02,KH2PO41.0,NH4NO31.0,FeCl30.05, pH 6.0;含芘母液:称取芘溶于甲醇溶液中,摇匀使其终浓度为1 g/L;芘无机盐培养基:将用0.22 μm滤膜除菌的含芘母液置于无机盐液体培养基;牛肉膏蛋白胨固体培养基:牛肉膏 3,蛋白胨 10,NaCl 5,琼脂 20,pH 6.0;PDA培养基:马铃薯 200,蔗糖 20,琼脂 20,pH自然;PDB培养基:马铃薯 200,蔗糖 20,pH自然。
1.1.3 主要试剂 芘,纯度98%,Aldrich公司。
1.2 方法
1.2.1 污染土壤悬液的制备 将供试土壤样品1 g加入装有玻璃珠并含有99 mL无菌水的250 mL锥形瓶中,25 ℃、175 r/min振荡2 h制成土壤悬液,待静止沉淀2 h后,取上清液作为菌源。
1.2.2 芘降解菌的富集、分离纯化 将制备的菌源接入到50 mL以芘为唯一碳源的无机盐液体培养基中,芘初始质量浓度为50 mg/L,25 ℃、175 r/min富集培养7 d,取第一次富集培养液以10%体积比转接到新的含芘无机盐液体培养基中,进行第二次富集培养,如此反复4次,每转接1次,芘质量浓度依次调整为50、100、150、200、300 mg/L。将经5次富集后的培养液稀释并分别涂布于牛肉膏蛋白胨培养基和PDA培养基上,25 ℃培养,挑取不同菌落形态的单菌落,采用平板划线法进行分离纯化。将分离纯化的菌株分别转接于相应的斜面培养基,培养后于4 ℃冰箱保存、备用。
1.2.3 HXY-5菌株的鉴定 ①HXY-5菌株的形态学鉴定:a.细胞个体形态观察:光学显微镜下观察细胞个体形态。b.菌落形态观察:将筛选出的HXY-5菌种接种于50 mL的PDB培养基中25 ℃、175 r/min摇床培养,活化24 h。接种活化后的HXY-5菌株于PDA培养基中涂布,25 ℃倒置培养数天,观察菌落形态。②HXY-5菌株的分子生物学鉴定:用真菌基因组快速提取试剂盒提取HXY-5菌株的基因组DNA。以菌株HXY-5的基因组为模板,以18S-ITS1和18S-ITS4为引物,采用20 μL PCR反应体系进行PCR扩增。扩增产物由生工生物工程(上海)股份有限公司进行同源性序列分析与比对。根据测序结果构建系统发育树。
1.2.4 HXY-5菌株的培养条件优化 ①不同培养时间对菌株生长的影响:将1 mL活化后的菌液,分别加入到含有50 mL PDB培养基的100 mL锥形瓶中,25 ℃、175 r/min摇床培养,间隔4 h取出一组,0~40 h共11组。每组做3个平行。②初始 pH对菌株生长的影响:将1 mL活化后的菌液,分别加入到含有50 mL PDB培养基的100 mL锥形瓶中,PDB培养基的初始pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0,25 ℃、175 r/min摇床培养24 h,每组3个平行。③不同碳、氮源对菌株生长的影响:在无机盐培养基中分别加入2%的葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖,以不加碳源为对照,接种0.5 mL HXY-5菌株母液,25 ℃、175 r/min培养24 h,测定菌体浓度,每组处理设3个重复,以筛选最佳碳源;用相同方法在无机盐培养基中加入2%的牛肉膏、蛋白胨、氯化铵、硫酸铵、硝酸钠为供试氮源,以不加氮源的培养基为对照,筛选最佳氮源。④正交试验设计:以最佳碳源(蔗糖和甘露醇)、最佳氮源(酵母浸粉)、MgSO4·7H2O、CaCl2、KH2PO4和FeCl3七个因素设计7因素4水平正交试验,测定HXY-5菌株的最优培养条件。
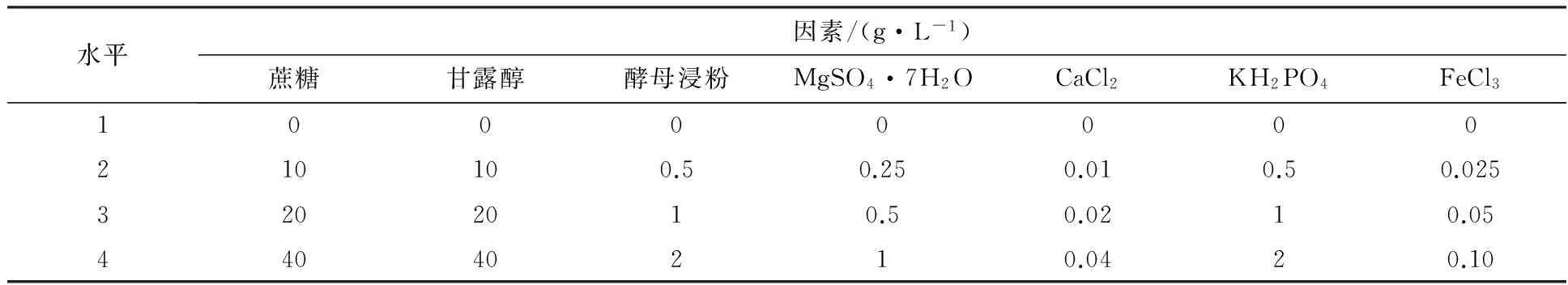
表1 正交试验因素与水平
1.2.5 HXY-5菌株对芘降解的研究 ①芘标准曲线的测定:取0.1 g芘溶于甲醇中,定容至100 mL,利用分光光度计在270~600 nm范围内测定芘标准溶液的最高吸收峰。取0.2 g芘溶于甲醇中,定容至250 mL,再取配制好的溶液分别稀释2、4、8倍,配制浓度分别为0.8、0.4、0.2、0.1 mg/mL,在紫外分光光度计下测定其OD600值[14]。②不同芘浓度对 HXY-5菌株降解芘的影响:将1 mL活化后的菌液,分别加入到含有50 mL 无机盐培养基的100 mL锥形瓶中,其初始芘浓度分别为0、50、100、200、400 mg/L,25 ℃、175 r/min摇床培养15 d。每组3个平行,以空白培养基对为照。③不同培养时间对 HXY菌株降解芘的影响:将1 mL活化后的菌液,加入芘浓度为100 mg/L的含有50 mL无机盐培养基的100 mL锥形瓶中,25 ℃、175 r/min摇床培养15 d,分别于第3、6、9、12和15天取出3瓶,用紫外分光光度计测定芘的浓度[8]。每组3个平行,以空白培养基为对照。
芘降解计算公式如下:

2 结果与分析
2.1 HXY-5菌株的形态学鉴定
HXY-5细胞形态见图1。由图1可见,光学显微镜下细胞呈圆形或椭圆形,细胞内可见明显的大液泡,细胞大小(1.0~4.7)μm×(0.8~4.0)μm,可出芽生殖。HXY-5菌落形态见图2。由图2可见,HXY-5菌株在PDA平板培养基上的菌落呈乳白色,不透明,菌落边缘整齐,表面光滑较粘稠,易挑取,菌落正反面颜色相同。
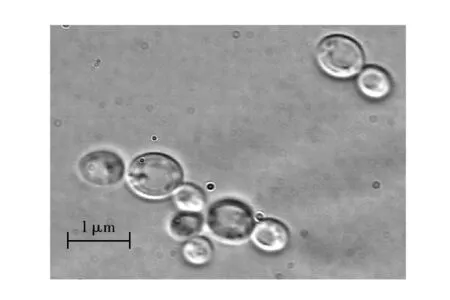
图1 HXY-5菌株的细胞形态Fig.1 Cell morphology of HXY-5 strain

图2 HXY-5菌落形态Fig.2 HXY-5 colonies morphology
2.2 HXY-5菌株的分子生物学鉴定
HXY-5菌株的18S rDNA序列经BLAST对比,可鉴定该菌株为间型假丝酵母(Candidaintermedia),基因同源性相似度达99%。MEGA6.0构建菌株的系统进化树见图3。
2.3 HXY-5菌株培养条件的优化
2.3.1 不同培养时间对菌株生长的影响 由图4可知,0~24 h内OD600值随培养时间的增加而加大,菌数呈指数增长,在24 h时达到最大;24 h以后,OD600值随培养时间的增加而减少,菌数不再增加,整个群体生长进入稳定期、衰亡期。
2.3.2 初始 pH对菌株生长的影响 由图5可知,pH为3.0~6.0时,菌体数量随着初始pH的增大而加大,菌数呈指数增长,pH为6.0时达到最大;pH 6.0~9.0时,菌体数量随着初始pH的增大而减少。
2.3.3 不同碳、氮源对HXY-5菌株生长的影响 由于酵母菌菌体较大,故采取光电比浊法计算该菌株的浓度。从图6、7中数据可以看出,该菌株在以蔗糖或甘露醇为碳源时生长情况相似,酵母浸粉为氮源时生长情况最好。
2.3.4 HXY-5菌株培养基优化 根据单因素试验结果,以蔗糖、甘露醇为碳源,酵母浸粉为氮源,同时选取MgSO4·7H2O、CaCl2、KH2PO4、FeCl3设计7因素4水平正交试验,结果见表2。

图3 基于18S rDNA序列构建的HXY-5系统进化树Fig.3 HXY-5 phylogenetic tree based on 18S rDNA sequences

试验号蔗糖/(g·L-1)甘露醇/(g·L-1)酵母浸粉/(g·L-1)MgSO4·7H2O/(g·L-1)CaCl2/(g·L-1)KH2PO4/(g·L-1)FeCl3/(g·L-1)OD60011040100.02200.7392102000.250.0210.10.55530100.500.0420.050.9294401000.250.01200.524520100.510.0100.10.9816402000.500.50.050.58971000.50.5020.11.1968040010.0110.050.54494010200.020.50.0251.133

续表2
根据R值大小可得各因素作用的主次顺序为氮源(酵母浸粉)>无机盐(硫酸镁)>无机盐(氯化钙)>碳源(蔗糖)>碳源(甘露醇)>无机盐(磷酸二氢钾)>无机盐(三氯化铁)。由上述无机盐培养基正交试验结果中的各列K值可知:碳源蔗糖的最适浓度为20 g/L,碳源甘露醇的最适浓度为20 g/L,氮源酵母浸粉的最适浓度为2 g/L,硫酸镁的最适浓度为0.5 g/L,氯化钙的最适浓度为0.01 g/L,磷酸二氢钾的最适浓度为0.5 g/L,三氯化铁的最适浓度为0.025 g/L。
由测定结果可知,HXY-5菌株最佳培养基的配方(g/L):蔗糖20, 酵母浸粉2, MgSO4·7H2O 0.5,CaCl20.01,KH2PO40.5。
2.4 HXY-5菌株对芘的降解作用
2.4.1 芘的标准曲线 用1.0、2.0、3.0 mg/L的芘标准溶液测定紫外吸收光谱,得到芘标准溶液在320 nm处有最高吸收峰。在波长320 nm处测得芘标准溶液在0.1~0.8 mg/L 的范围内呈良好线性关系,见图8。
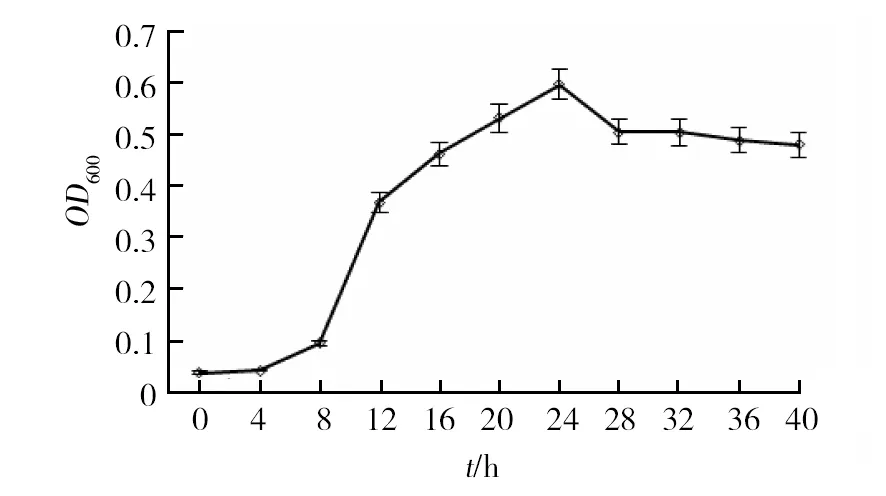
图4 HXY-5菌株生长曲线Fig.4 HXY-5 strain growth curve
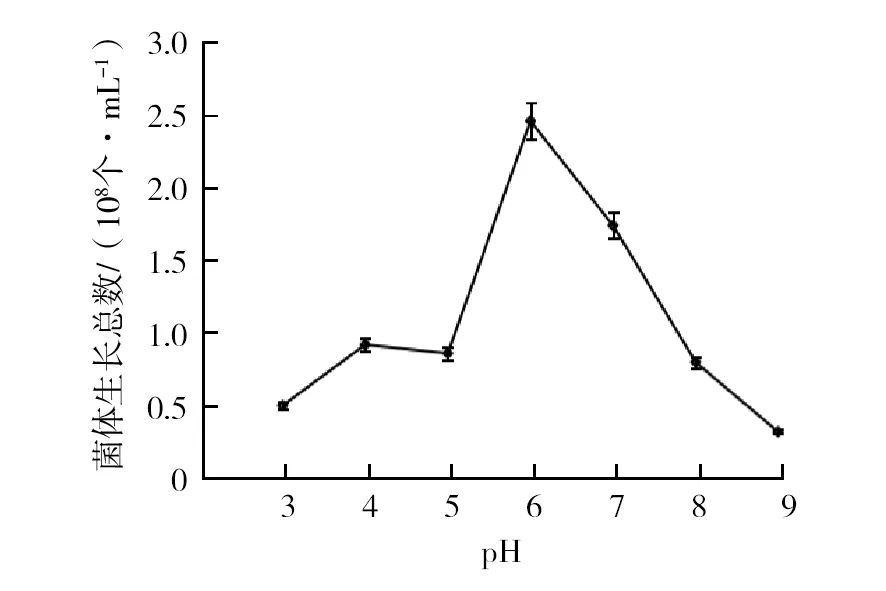
图5 初始pH对HXY-5菌株生长的影响Fig.5 Effect of initial pH on the growth of HXY-5 strain

图6 不同碳源对HXY-5菌株生长的影响Fig.6 Effect of different carbon sources on the growth of HXY-5 strain

图7 不同氮源对HXY-5菌株生长的影响Fig.7 Effect of different nitrogen sources on the growth of HXY-5 strain

图8 芘的标准曲线Fig.8 Standard curve of pyrene
2.4.2 HXY-5菌株对芘的降解 HXY-5菌株在芘浓度为0~400 mg/L时的生长状况见图9。由图9可知,当芘浓度为100 mg/L时,菌株的生长情况最好,芘在第3、6、9、12、15天降解率分别为8%、20%、32%、46%和63%。
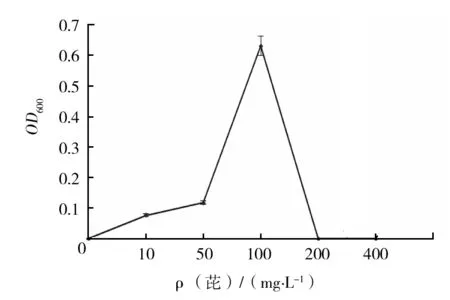
图9 不同芘浓度对HXY-5菌株生长的影响Fig.9 Effect of pyrene concentration on the growth of HXY-5 strain
3 讨 论
从被石油严重污染的污灌渠底泥中分离得到芘降解菌HXY-5,经形态学和分子生物学鉴定其为间型假丝酵母(Candidaintermedia)。该菌株的优化培养条件为蔗糖20 g,酵母浸粉2 g,MgSO4·7H2O 0.5 g,CaCl20.01 g,KH2PO40.5 g,初始pH 6.0, 25 ℃培养24 h。在芘浓度为100 mg/L时,该菌株对芘的降解效果明显,培养15 d时芘降解率可达63%。
对HXY-5酵母菌的光学显微镜观察显示,其细胞内具较大液泡,但其液泡内却具有一可见的杆状物质,且在活体细胞内呈较活跃的运动状,其对低浓度美蓝的着色情况与活体酵母菌相同。该杆状物是否与芘的降解有关,有待进一步的研究。
利用微生物修复自然环境中PAHs污染是污染治理的关键,因其具有费用低、二次污染少、修复彻底等优点,现已成为较高效、安全的生物修复技术[15-17]。本研究从HXY-5菌株生长条件入手,探究了HXY-5菌株对芘的降解作用。研究表明,该菌株对芘的降解效果良好。对HXY-5菌株的研究,有利于进一步探究该菌株的生物学价值,探究该菌株在石油污染环境下生存的意义,并为治理芘污染提供高效、低消耗的可能。
[1] 王涛,蓝慧,田云,等. 多环芳烃的微生物降解机制研究进展[J]. 化学与生物工程,2016,2:8-14.
[2] 田林双. 微生物降解多环芳烃研究[J]. 畜牧与饲料科学,2009,10:90-92.
[3] Bonfá MRL, Grossman MJ, Mellado E, et al. Biodegradation of aromatic hydrocarbons by Haloarchaea and their use for the reduction of the chemical oxygen demand of hypersaline petroleum produced water[J]. Chemosphere, 2011, 84(11):1671-1676.
[4] Chikere CB, Okpokwasili GC, Chikere BO. Monitoring of microbial hydrocarbon remediation in the soil[J]. Biotech, 2011, 1(3):117-138.
[5] Kanaly RA, Harayama S. Biodegradation of high-molecular-weight polycyclic aromatic hydrocarbons by bacteria[J]. Journal of Bacteriology, 2000, 182(8):2059.
[6] 陈志丹,晁群芳,杨滨银,等. 一株芘降解菌B2的降解条件优化及降解基因[J]. 环境工程学报,2012,10:3795-3800.
[7] 弓玉红,郝林,郭凯凯. 萃取-紫外分光光度法测定土壤中3,4-苯并芘含量[J]. 山西农业科学,2012,04:383-385.
[8] Lin M, Hu X, Chen W, et al. Biodegradation of phenanthrene byPseudomonassp. BZ-3, isolated from crude oil contaminated soil[J]. International Biodeterioration & Biodegradation, 2014, 94:176-181.
[9] Finkelstein ZI, Baskunov BP, Golovlev EL, et al. Fluorene Transformation by Bacteria of the Genus Rhodococcus[J]. Microbiology, 2003, 72(6):660-665.
[10] Sàágua MC, Baeta-Hall L, Anselmo AM. Microbiological characterization of a coke oven contaminated site and evaluation of its potential for bioremediation[J]. World Journal of Microbiology and Biotechnology, 2002, 18(9):841-845.
[12] Weissenfels WD, Beyer M, Klein J. Degradation of phenanthrene, fluorene and fluoranthene by pure bacterial cultures[J]. Applied Microbiology and Biotechnology, 1990, 32(4):479-484.
[13] 李全霞, 范丙全, 龚明波,等. 降解芘的分枝杆菌M11的分离鉴定和降解特性[J]. 环境科学, 2008, 29(3):763-768.
[14] 隋芝宇,张永惠,王梦迪,等. 紫外分光光度法测量柴油中芳烃含量[J]. 化工管理,2014,(8):69,71.
[15] 黄兴如,张彩文,张瑞杰,等. 多环芳烃降解菌的筛选、鉴定及降解特性[J]. 微生物学通报,2016,43(5):965-973.
[16] 杨辉,王海霞,李晓军,等. 多环芳烃污染土壤生物修复技术研究进展[J]. 安徽农业科学,2011,(3):1427-1429,1431
[17] Gibson DT, Mahadevan V, Jerina DM, et al. Oxidation of the carcinogens benzo [a] pyrene and benzo [a] anthracene to dihydrodiols by a bacterium[J]. Science, 1975, 189(4199):295-297.
——化工原料、农副产品

