核辐射污染区真菌的分布及多样性研究
张志东, 张丽娟, 朱 静, 唐琦勇, 王 玮, 顾美英, 宋素琴
(新疆农业科学院 微生物应用研究所,新疆 乌鲁木齐 830091)
自1956 年美国人首次发现耐辐射奇异球菌(Deinococcusradiodurans)以来[1],耐辐射微生物因其惊人的耐辐射能力,以及特殊的生命现象、生理机制和功能基因,为研究生物起源、物种进化等提供了重要研究材料和科学论据。同时,因其在环境工程、人类健康、生物技术乃至军事等方面具有极大的应用前景,已成为科学界关注、研究的热点[2-5]。耐辐射真菌的相关研究最早可追溯到1960年,Durrell等[6]首次对美国内华达核试验基地中真菌进行了调查研究。此后,国际上在不同环境下和样品中也分离到具有一定辐射耐受性的真菌[7-8]。目前,较为系统研究主要针对前苏联发生核事故的切诺贝尔利核电站周边的真菌的研究[9-11]。研究表明,该区域存在丰富的真菌多样性。通过与相应对照区域分离出的真菌相比,具有较强的抗氧化剂能力和较高的抗氧化酶酶活性,能吸收诸如137Cs、121Sr、152Eu、239Pu 和241Am等多种放射性核素,特别是部分菌株存在着不同程度的趋辐射性生长特性,部分菌株可以吸收辐射射线作为生长能源的能力,展现了辐射污染区真菌难以置信的辐射适应性[12-15]。中国核辐射污染区地处我国新疆自治区中东部,与切尔诺贝利核电站气候和生态环境完全不同,是典型的干旱荒漠地区,该区域先后开展了多次不同核素、不同剂量的相关核试验,成为我国独一无二、不可复制的人造特殊环境[16],由于该区域的特殊性,国内外少有科学研究者对该区域真菌群落进行研究。 因此,本研究以辐射污染区真菌为研究对象, 以中国辐射污染区某污染源为圆心,在其半径50 km范围内进行了样品采集,并采用多种样品预处理方法及多种培养基对辐射区内真菌进行分离筛选,初步分析了该区域真菌的分布和多样性。
1 材料与方法
1.1 材料
1.1.1 研究区域概况与样品 2013年9月, 以中国辐射污染区某污染源为圆心,在其半径50 km范围内进行样品采集,在各采样点除去5 cm的表层土后,取深5~30 cm 的土壤(混匀)装入无菌取样盒中,4 ℃冰箱保存。根据其辐射污染程度分为高(H)、中(AI)、低(L)污染样品,具体为高辐射污染 >10 000 Bq/kg,中辐射污染为1 000~2 000 Bq/kg,低辐射污染为100~200 Bq/kg,相关土样其他信息见表1。

表1 不同辐射污染程度下土壤样品测序数据统计
1.1.2 培养基 PDA培养基、MEA培养基、马丁氏-孟加拉红培养基以及查氏培养[17-18]。
1.2 方法
1.2.1 样品预处理 根据辐射采样区域和辐射剂量的不同,对所采集的样品进行相关合并,分别取出部分样品经3 kGy(剂量率为100 Gy/h)60Co辐射处理或0.01 mol/L H2O2浸泡1 h处理后,采用梯度稀释法涂布,对检出真菌数量进行分析,并以未处理样品为对照[11]。
1.2.2 菌种的分离筛选 采用稀释涂布平板法分离土壤中的真菌,每一处理设3个重复,涂布后置于25 ℃温箱内培养5 d,根据菌落形态,对每种土样及培养基中分离菌株进行单独编号、纯化保存,并进行相关统计。将纯化菌株接种PDA平板上, 主要参照中国真菌志[19-22],每隔24 h观察菌落形态、颜色、培养基颜色;用载片培养法,观察产孢结构及分生孢子形态,定期观察,并进行初步鉴定。
1.2.3 菌种ITS序列分析 真菌基因组DNA的提取采用Biospin Fungus Genomic DNA Extraction Kit(北京博大泰克公司生产)。ITS rDNA的PCR扩增采用真菌的通用引物,正向引物ITS1: TCCGTAGGTGAACCTGCGC,反向引物ITS4: TCCTCCGCTTATTGATATGC,由上海生工生物技术公司合成。扩增条件[18]:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环,最后72 ℃延伸8 min。扩增产物经DNA片段快速胶回收试剂盒(北京博大泰克公司生产)回收纯化后,由北京鼎国生物技术公司完成测序工作。经测序所得菌株完整的ITS序列(包括5.8S rDNA),与GenBank 数据库中进行相似性比对,并调取GenBank的相似序列进行多重序列比对后,使用MEGA 5.0的Neighbor-Joining算法构建系统进化树[23]。实验菌株ITS已在GenBank注册, Accession number分别为 KY931491~KY931517。
1.2.4 土壤真菌的多样性测度 根据鉴定的土壤真菌和各测试指数的特点及取样数据的类型,应用生态学评价方法[24],选用物种的丰富度指数:S=N; Shannon-Wiener多样性指数(H),Simpson优势度(D),PieLou均匀度指数(J)。
1.2.5 菌种耐辐射特性研究 将分离获得真菌菌株按分类选取部分代表菌株,接种于装有玻璃珠的PDA液体培养基中,28 ℃震荡培养3 d,用无菌试镜纸过滤去除菌球和大段菌丝,5 000 r/min离心收集菌体,用0.05 mol/L磷酸钾缓冲液(pH 7.2)洗涤菌体3次,并调整至浓度OD6001.0左右。取上述菌悬液 5 mL装至15 mm×150 mm无菌试管中,置于60Co γ射线(剂量率100 Gy/min)进行不同剂量照射后,分别稀释至10-2,取0.1 mL稀释液涂布于PDA培养基平板上,28 ℃恒温培养,观察存活菌落。
2 结果与分析
2.1 不同土样及处理对真菌检出的影响
采集的54份样品总体均为戈壁荒漠土,土壤pH 8.0以上。尽管样品周边存在不同的植被情况,但为了研究的可比性,本研究所用土样均为无植被覆盖区域,样品总有机质在0.21%~0.43%,根据其辐射污染程度样品进行了相关合并为9份,大至可以分为3类,即高(H)、中(M)、低(L)污染土样。
样品经3 kGy(剂量率为100 Gy/h)60Co辐射处理或0.01 mol/L H2O2浸泡1 h处理后,分别采用梯度稀释法涂布至各类分离平板上,统计各培养基中检出真菌数量,并以检出数量最高的培养基进行统计分析,并以未处理样品为对照,结果见图1。

图1 不同土样处理下真菌群落检出情况Fig.1 Effection of fungal colonies on different pretreatments
由图1可以看出,试验样品中的真菌数量随着离辐射源的距离而增加,由于辐射剂量率与辐射源的距离成反比,因此,菌落数也与辐射剂量成反比,即辐射剂量越高真菌的数量越少。通过对土样不同处理发现,低剂量辐射对中、高辐射污染区样品中真菌有明显的激活效应,真菌菌落最高检出可以提高2倍以上,但低辐射区样品真菌反而有所降低,其原因可能为部分非耐辐射真菌被辐射致死,进而总体菌落略有下降。H2O2浸泡1 h处理后,各样品中真菌检出均有所下降,可能与H2O2杀死部分菌种有关,但该处理据报道可以提高耐辐射真菌的筛选[11]。
同时,根据菌落形态对每种土样及培养基中分离的菌株进行单独编号、纯化保存,并进行相关统计,共获得209株各类真菌。对不同培养基在使用辐射处理和无辐射处理筛选出菌株情况进行分析发现,实验中使用的4种真菌筛选培养基中,PDA培养基中筛选的菌株种类最多,其次为查氏培养基,MEA培养基中分离的菌株最少(图2);而且通过辐射预处理土样,有利于提高辐射污染区中真菌的种类。
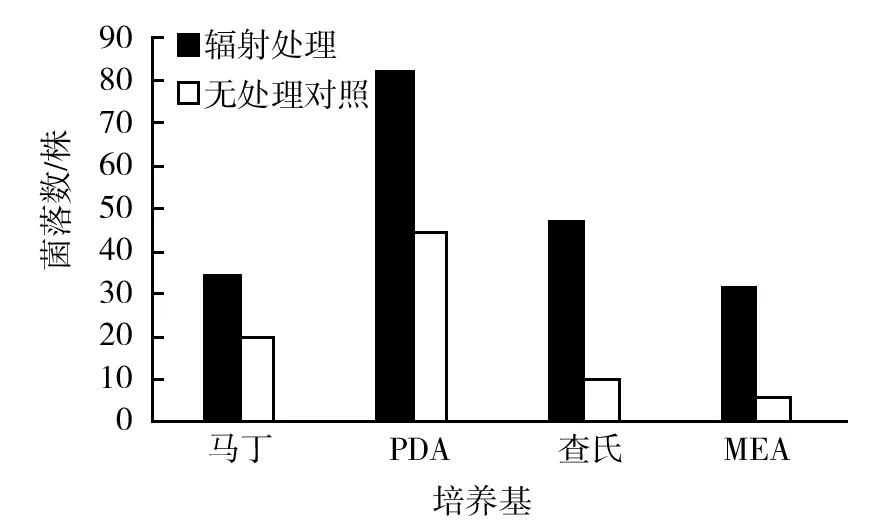
图2 不同处理下各培养基对分离菌株种类的影响Fig.2 Effection of isolate types on different screening media
2.2 ITS序列的系统发育树的构建及分析
本研究获得209株各类真菌,再次通过详细的菌落特征和显微形态观察后,选取具有代表性菌株52株,进行ITS rDNA序列测定。所得ITS rDNA序列长度为514~641 bp,序列经Blast与GenBank数据库进行比对,并调出相关菌株的有效序列,使用MEGA5.0软件进行序列比对、聚类分析和系统进化树构建(图3)。由图3可以看出,代表性菌株分别归属于真菌的交链孢霉(Alternaria)、离蠕孢属(Bipolaris)、茎点霉属(Phoma)、Westerdykella、短梗霉属(Aureobasidium)、曲霉属(Aspergillus)、青霉属(Penicillium)、根霉属(Rhizopus)、Kernia、毛壳属(Chaetomium)、葡萄穗霉属(Stachybotrys)、座孢霉属(Myrothecium)、镰孢属(Fusarium)、小克银汉霉属(Cunninghamella)、红酵母属(Rhodotorula)、隐球酵母属(Cryptococcus)等16属27个种,绝大部分菌株为已知菌。其中代表菌株Y521、PCK401与相关种属最近种的同源性在94%以下,通过28S LSU D1/D2 序列及翻译延长因子(translation elongation factor 1)、β微管蛋白(beta-tubulin)、磷酸透性酶(phosphate permease)多基因序列比对,初步确定其为潜在新种,相关研究将另行报道。
2.3 辐射区真菌群落的分布
对分离的16个属209株真菌统计分析发现,辐射污染程度对真菌的种群分布和组成有极大影响,辐射污染程度越高,其分离的菌株数量越少,其中高辐射污染土样分离株仅占9.6 %(表2)。在分离获得真菌中曲霉属、隐球酵母属、青霉属和镰孢霉属菌株最多,分别占所有分离株的22.5%、19.1%、17.2%和11.0%,合计近70%(表3)。在各组土样中,青霉属、茎点霉属、隐球酵母属、短梗霉属菌株均有发现,随着辐射污染程度逐步降低,土样中逐次开始检出镰孢霉属、交链孢霉属、毛壳霉属和曲霉属、Kernia属真菌,而根霉属、离蠕孢属、座孢霉属、红酵母属和小克银汉霉属仅在低污染程度中出现。而Westerdykella属和葡萄孢霉属仅分别在高污染土样和中污染土样中检出(表3),上述结果可能与各属真菌的耐辐射和生长耐性有关,相关研究正在开展。
通过对样品按高(H)、中(M)、低辐射污染土样(L)进行合并,分别使用菌属丰富度、香农指数(H)、辛普森指数(D)、Pielou指数(J)对样品多样性随着辐射的增加变化进行了统计学分析(表4)。结果显示,随着污染程度的增加,各个指数迅速降低,证明辐射污染程度对真菌的丰富度、多样性以及均匀度影响明显。

表2 不同辐射程度样品中真菌分离情况

图3 基于ITS序列构建的部分辐射污染区真菌分离株N-J进化树Fig.3 Neighbor-Joining tree of isolates and related species based on ITS sequences 节点上的数值基于1 000计算后的百分可信值,刻度尺为核酸序列差异0.05时的距离 Numbers on the nodes are the bootstrap values (percentages) based on 1 000 replicate. Bar, 0.05 substitutions per nucleotide position

种属HMLNo.0No.1No.2No.3No.4No.5No.6No.7No.8分离真菌/株所占比例/%Penicillium+++++++++3617.22Phoma+++++〛115.26Cryptococcus+++++++4019.14Aureobasidium+++++〛94.31Fusarium+++++2311.00Alternaria+++++83.83Chaetomium+++++115.26Aspergillus++++4622.01Rhizopus+++125.74Bipolaris+〛20.96Myrothecium+〛+20.96Rhodotorula++20.96Cunninghamella++31.44Westerdykella+〛10.48Kernia++〛20.96Stachybotrys+〛10.48
注:“+”为样品中分离出
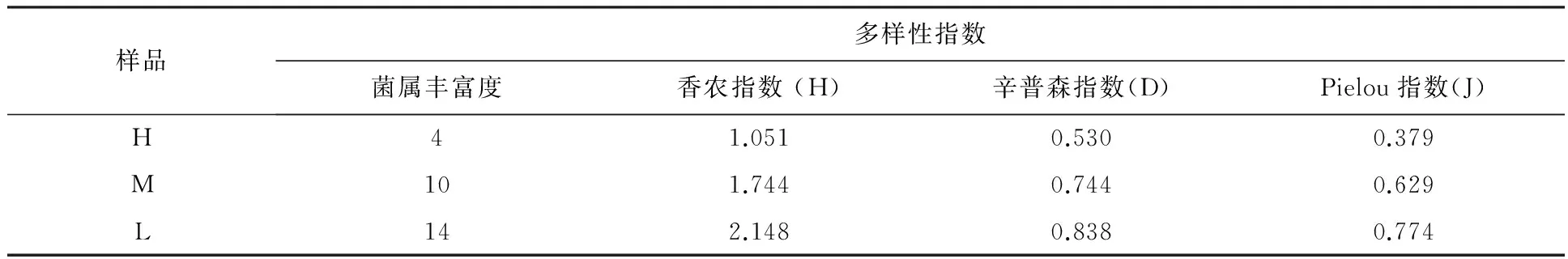
表4 不同辐射污染土样中真菌多样性指数
2.4 辐射污染区真菌菌株耐辐射特性
对实验获得部分真菌辐射耐受性进行初步分析,结果见表5。由表5可见,辐射污染区中分离的真菌存在耐辐射特性上的多样性,不仅属间存在辐射耐受性差异,且同属种间的耐受性也存在明显差异。总体来说,分布于中高辐射污染区的真菌如青霉属、曲霉属、短梗霉属、镰孢霉属、交链孢霉属等均具有较高的辐射耐受性。在同属间不同物种如青霉属的C701、P601和曲霉属的CCK301、M403、C312在辐射耐受性上也存在明显的差别。另外,在辐射污染区真菌同种间是否存在耐辐射特性间差异的现象,有待进一步验证。

表5 部分代表菌株辐射-存活特性

续表5
注:“+”每平板存活菌落大于100个;“-”未见生长;“W”每平板存活菌落小于100个
3 讨 论
前期研究中,本项目组已对辐射污染区分离获得的放线菌及细菌多样性以及短梗霉属菌株耐辐射特性进行了报道[24,27]。相关研究显示,辐射污染区存在着丰富的微生物资源和物种多样性,其中多数微生物呈现不同程度的耐辐射特性,并孕育着大量未知微生物属种。同时,辐射污染对该区域微生物分布有明显影响,随着辐射污染程度的增高菌株的检出率显著下降,不同辐射区域获得微生物耐辐射特性中存在明显差异。一般来说,污染程度越高的土样,高剂量辐射耐受性的微生物所占比例较高。本研究对辐射污染区真菌的分离筛选也得到类似的结果。
目前,有关辐射污染区真菌多样性研究最为系统的是切尔诺贝利核电站污染区,国外学者20余年的研究中,已从该区域分离出约2 000株真菌,涉及98个属的200余种,证明该区域存在着丰富的真菌多样性[12-14]。其中,Penicillium、Fusarium、Chrysosporium、Scopulariopsis、Hyalodendron、Verticillium、Mucor等菌属占分离到的耐辐射真菌的80%以上。本研究中,Penicillium和Fusarium同样为主要优势菌群,除此之外,Cryptococcus、Aspergillus也为主要优势菌群,四者合计占总筛选株的近70%。
在群落分布上,切尔诺贝利核电站污染区研究表明[13],Paecilomyceslilacinus和Chaetomiumaureum是土壤高剂量辐射((3.7×106)~(3.7×108)Bq/kg)的优势菌、Acremoniumstrictum和Arthriniumphaeospermum中剂量辐射((3.7×103)~(3.7×105)Bq/kg)的优势菌;Myrotheciumroridum和Metarhiziumanisopliae是低剂量辐射(<(3.7×102)Bq/kg)的指示菌株,上述菌株同时可以作为相应辐射剂量的指示菌。本研究结果表明,该区域真菌的菌属丰富度、多样性及均匀度明显受辐射污染影响,导致其不同污染程度下真菌种群分布和组成有明显的差异。同时发现,辐射污染区各组土样中真菌群落存在一定的分布特征,随着辐射污染程度逐步降低,土样中逐次开始检出镰孢霉属、交链孢霉属、毛壳霉属和曲霉属、Kernia属,而根霉属、离蠕孢属、座孢霉属、红酵母属和小克银汉霉属仅出现在低污染程度土样中。Westerdykella和葡萄孢霉属分别仅存在于高污染土样和中污染土样,上述结果可能与各属真菌的耐辐射和生长耐性有关,相关研究正在开展。
尽管本研究采用了多种真菌分离培养基,最大限度地分离和保存各土样中真菌资源,但由于可培养方法受多种因素限制,不能全面反映土壤微生物群落结构。因此,利用最新高通量测序技术的分子手段以及Biolog Eco技术的生态多样性研究进一步对本研究进行验证和补充非常必要,相关研究正在进行。
[1] Anderson A, Nordan H, Cain R, et al. Studies on a radoresistant micrococcus. I. Isolation, morphology, cultural charchteristoics, and resistance to gamma radiation[J]. Food Technol,1956,10:575-578.
[2] Adachi M, Hirayama H, Shimizu R, et al.Interaction of double-stranded DNA with polymerized PprA protein fromDeinococcusradiodurans[J] Protein Science, 2014, 23(10):1349-1358.
[3] 王玮, 朱静, 张志东,等. 原核耐辐射微生物资源研究及其应用前景[J]. 核农学报, 2013, 27(2):177-182.
[4] 王宏广. 中国的生物经济[M].北京: 中国农业科学技术出版社, 2010:741-752.
[5] 侯晓光, 李新娜, 张维, 等. 耐辐射异常球菌的微生物资源及其应用[J].中国农业科技导报, 2010, 12(4):18-23.
[6] Durrell LW, Lora MS. Fungi Isolated in Culture from Soils of the Nevada Test Site[J]. Mycologia, 1960, 52(4):636-641.
[7] Ito H, Iizuka H, Sato T. A new radio-resistant yeast ofTrichosporonoryzaenov. sp. isolated from rice[J]. Agricultural Biology and Chemistry, 1974, 38 (9):1597-1602.
[8] Singaravelan N, Grishkan I, Beharav A, et al. Adaptive melanin response of the soil fungusAspergillusnigerto UV radiation stress at ′Evolution Canyon′, Mount Carmel, Israel[J]. PLoS ONE, 2008, 8(3):e2993.
[9] Durrell LW, Lora MS. Fungi Isolated in Culture from Soils of the Nevada Test Site[J]. Mycologia, 1960, 52(4):636-641.
[10] Tugai T, Zhdanova NN, Zheltonozhskii VA, et al. Development of radioadaptive properties for microscopic fungi, long time located on terrains with a heightened background radiation after emergency on Chernobyl NPP [J]. Radiatsionnaia Biologiia Radioecologiia, 2007, 47(5):543-549.
[11] Mironenko NV, Alekhina IA, Zhdanova NN, et al. Intraspecific variation in gamma-radiation resistance and genomic structure in the filamentous fungusAlternariaalternata: a case study of strains inhabiting Chernobyl reactor no 4[J]. Ecotoxicol Environ Saf, 2000, 45(2):177-187.
[12] Ekaterina D, Arturo C. Ionizing radiation: how fungi cope,adapt, and exploit with the help of melanin[J].Current opinion in microbiology , 2008, 11(6):525-531.
[13] Dighton J, Tugay T, Zhdanova N. Fungi and ionizing radiation from radionuclides[J]. FEMS, 2008, 281(2):109-120.
[14] Henrik VW, Joern F, Patric B,et al. Consequences of nuclear accidents for biodiversity and ecosystem services[J]. Conservation Letters, 2012,5(2):81-89.
[15] Bunzl K, Schimmack W. Effect of microbial biomass reduction by gamma-irradiation on the sorption of137Cs,85Sr,139Ce,57Co,109Cd,65Zn,103Ru,95Tc and131I by soils[J]. Radiation and Environmental Biophysics, 1988, 27:165-176.
[16] Luan YX, Ma ZH, Pan LG. Establishion of radioactive contamination monitoring network and bioremediation of the soil around the nuclear facilities in China[J]. Advanced Materials Research, 2012,(353):512-521.
[17] Qayyum S, Khan I, Maqbool F, et al. Isolation and characterization of heavy metal resistant fungal isolates from industrial soil, China[J]. Pakistan Journal of Zoology, 2016, 48(5):1241-1247.
[18] Mohamed RM, Abo-Amer AE. Isolation and characterization of heavy-metal resistant microbes from roadside soil and phylloplane[J]. Journal of Basic Microbiology, 2012, 52(1):53-65.
[19] 齐祖同. 中国真菌志(第5卷)-曲霉属及其相关有性型[M].北京:科学出版社, 1997.
[20] 张天宇. 中国真菌志(第16卷)-链格孢属[M]. 北京:科学出版社, 2003.
[21] 孔华忠. 中国真菌志(第35卷)-青霉属及其相关有性型属[J].北京:科学出版社,2007.
[22] 戚佩坤, 姜子德, 向梅梅. 中国真菌志(第34卷)-拟茎点霉属[M].北京:科学出版社, 2007.
[23] Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood , evolutionary distance , and maximum parsimony methods[J]. Molecular Biology & Evolution, 2011, 28(10): 2731-2739.
[24] Gu MY, Zhang ZD, Wang W, et al. The Effects of radiation pollution on the population diversities and metabolic characteristics of soil microorganisms[J]. Water, Air, & Soil Pollution, 2014, 225(9): 2133.
[25] 张志东, 谢玉清, 王玮, 等. 耐辐射黑色酵母状真菌的筛选和特性研究[J]. 微生物学通报, 2012, 39(5): 724-731.
[26] 张志东, 茆军, 唐琦勇, 等. 辐射污染区土壤中放线菌的分离及多样性[J]. 微生物学通报, 2009, 32(9): 1329-1333.
[27] 张志东, 顾美英, 王玮,等. 基于高通量测序的辐射污染区细菌群落特征分析[J]. 微生物学通报, 2016, 43(6):1218-1226.

