不同浓缩方法对丹参提取液的影响△
刘铁军,孙胜斌,陈翔宇,王文鹏,周永妍,姜国志
(1.河北省中药注射液工程技术研究中心,河北 石家庄 051430;2.神威药业集团有限公司,河北 石家庄 051430;3.中药注射剂新药技术开发国家地方联合工程实验室,河北 石家庄 051430)
丹参注射液是由丹参经水提、醇沉、酸沉、碱沉制成的无菌水溶液,因此其主要有效成分为水溶性酚酸类化合物[1-5]。据文献报道,丹参水溶性有效成分均具有酚酸性结构,如丹酚酸A(Salvianolic acid A,Sal A)、丹酚酸 B(Salvianolic acid B,Sal B)、丹酚酸C(Salvianolic acid C,Sal C)、迷迭香酸(Rosmarinic Acid),均是由不同分子的丹参素与咖啡酸缩合而成,而丹参素是丹酚酸类化合物的基本化学结构,其化学名为 β-3,4-二羟基苯乳酸(3,4-hydroxybenyl lactic acid)。其他还包括丹酚酸 D、E、F、G等[6-12]。酚酸类成分在药理实验中已被证明是丹参活血、祛瘀、止痛的物质基础,具有抗血小板聚集、抗血酸形成,促进纤维蛋白降解,防治动脉粥样硬化及抗心肌缺血的作用[13]。由于酚酸类成分的缩合特性,部分化合物热稳定性不好,因此,丹参提取精制过程中浓缩方法的选择会不同程度地影响丹参水溶性酚酸类成分。本文采用不同的浓缩方法考察对丹参提取液有效成分的影响。
1 仪器与试药
1.1 仪器
CPA225D电子天平(德国赛多利斯);Agilent 1260型液相色谱仪。
1.2 试药
丹参素钠对照品(中国食品药品检定研究院,批号110855-201614,含量98.1%);原儿茶醛对照品(中国食品药品检定研究院,批号110810-201007,含量98.2%);咖啡酸对照品(中国食品药品检定研究院,批号110885-200101);迷迭香酸对照品(中国食品药品检定研究院,批号111871-201505,含量98.8%);丹酚酸B对照品(中国食品药品检定研究院,批号111562-201615,含量96.2%);乙腈为色谱级;水为重蒸馏水。
样品为神威药业集团有限公司提供。
2 方法
2.1 不同浓缩条件样品的制备
2.1.1 常压浓缩 取丹参提取液于95~100℃下常压蒸发浓缩,分别于浓缩至原体积的1/2、1/5、1/10、1/20时,即相当于原体积浓缩了2倍、5倍、10倍、20倍时取样。
2.1.2 减压浓缩 取丹参提取液于55~65℃,真空度0.08~0.09 MPa下减压浓缩,分别于浓缩至5、10、15、20倍体积时取样。
2.1.3 纳滤膜浓缩 取丹参提取液于过滤压力1.5~2.0 MPa下过滤浓缩,分别于浓缩至5、10、15、20倍体积时取样。
2.2 丹参素钠、原儿茶醛、咖啡酸、迷迭香酸、丹酚酸B含量测定
2.2.1 色谱条件 色谱柱:Agilent Zorbax SB C18(250 mm×4.6 mm,5μm);流动相:乙腈-0.03%的三氟乙酸水;柱温:30℃;流速:1.0 mL·min-1;检测波长:286 nm,梯度洗脱程序见表1。

表1 梯度洗脱程序
2.2.2 对照品溶液的制备 分别取丹参素钠、原儿茶醛、咖啡酸、迷迭香酸、丹酚酸B对照品适量,精密称定,置10 mL容量瓶中,加0.2%冰醋酸的10%甲醇溶液制成含0.2 mg·mL-1丹参素钠、0.1 mg·mL-1咖啡酸、0.05 mg·mL-1原儿茶醛、0.5 mg·mL-1迷迭香酸、0.5 mg·mL-1丹酚酸 B的混合对照品溶液。
2.2.3 供试品溶液的制备 精密量取适量提取浓缩液,加0.2%冰醋酸的10%甲醇溶液稀释,既得。见图1~2。

图1 对照品色谱图
2.3 总酚酸测定
2.3.1 对照品溶液的制备 取丹参素钠对照品适量,精密称定,加水制成每1 mL含0.1 mg的溶液,即得。
2.3.2 标准曲线的制备 精密量取对照品溶液2、3、4、5、6、7 mL,分别置10 mL量瓶中,加水稀释至刻度,摇匀,照紫外-可见分光光度法,在280 nm的波长处测定吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
2.3.3 供试品溶液的制备 精密量取提取浓缩液,加水稀释,摇匀,依法测定吸光度,既得。

图3 对照品溶液200~400 nm全波长扫描图
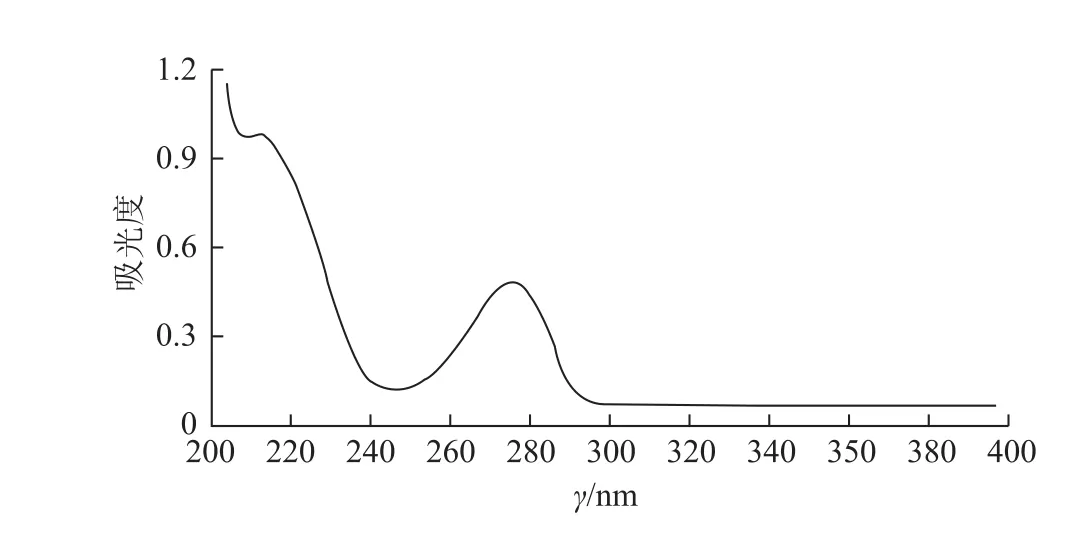
图4 供试品溶液200~400 nm全波长扫描图
3 结果与分析
3.1 含量测定方法学考察
3.1.1 标准曲线及线性范围 取上述混合对照品溶液,按2.2方法,分别进样1、2、5、10、20、30μL,以对照品进样量为横坐标,样品峰面积为纵坐标,绘制标准曲线,回归方程分别为:Y丹参素钠=57.128X+5.868,r=0.999 8,Y原儿茶醛=138.17 X+31.556,r=0.999 6,Y咖啡酸=13.136 X+5.427 1,r=0.999 5,Y迷迭香酸=87.656 X+2.496 8,r=0.999 7,Y丹酚酸B=50.245 X+4.791 2,r=0.999 8,说明丹参素钠进样量在0.20~6.0μg、咖啡酸进样量在0.1~3.0μg,原儿茶醛、迷迭香酸进样量在0.050~1.50μg、丹酚酸B进样量在0.5~15.0μg线性关系良好。
3.1.2 精密度试验 取对照品溶液连续进样6次,丹参素钠、原儿茶醛、咖啡酸、迷迭香酸和丹酚酸B的峰面积 RSD分别为0.65%、1.82%、1.21%、081%、1.35%,表明精密度良好。
3.1.3 稳定性试验 取同一供试品溶液(批号:16052811),分别于0、2、4、8、12、24、48 h时进样检测,丹参素钠、原儿茶醛、咖啡酸、迷迭香酸和丹酚酸B峰面积RSD分别为1.95%、0.74%、1.12%、1.25%、0.83%,说明被测溶液在48 h内稳定。
3.1.4 重复性试验 按供试品溶液制备方法,取同一批样品(批号:160528A1),共6份,依法测定。丹参素钠、原儿茶醛、咖啡酸、迷迭香酸和丹酚酸B含量 RSD分别为 1.73%、1.28%、0.86%、1.21%、1.98%,说明本测定方法重复性良好。
3.1.5 加样回收试验 精密量取2 mL提取液稀释至10 mL,取1.0 mL,平行6份,分别加入0.4 mg·mL-1丹参素钠、0.05 mg·mL-1原儿茶醛、0.1 mg·mL-1咖啡酸、0.05 mg·mL-1迷迭香酸、1.0 mg·mL-1丹酚酸B的混合对照品溶液0.8、0.8、1.0、1.0、1.2、1.2 mL,混匀后进样检测。以峰面积计算回收率,丹参素钠、原儿茶醛、咖啡酸、迷迭香酸和丹酚酸B的加样回收率分别为 98.62%、99.21%、99.76%、98.96%和 100.06%,RSD分别为1.13%、1.21%、0.86%、1.63和1.52%,均符合要求。
3.2 不同的浓缩方法对丹参提取液有效成分的影响
3.2.1 丹参提取液不同浓缩方法各含量结果 见表2。
3.2.2 不同方法浓缩过程各含量的变化 随浓缩时间的延长,常压浓缩、减压浓缩过程丹参素钠、原儿茶醛、咖啡酸、总酚酸含量逐步增加,增幅逐渐减小,常压浓缩含量增幅较减压浓缩大;丹酚酸B含量逐步减小,降幅逐渐减小,常压浓缩含量降幅较减压浓缩大;迷迭香酸较稳定,3种浓缩方法对该含量均无显著影响。膜浓缩过程对各含量均无显著影响。见图5~10。
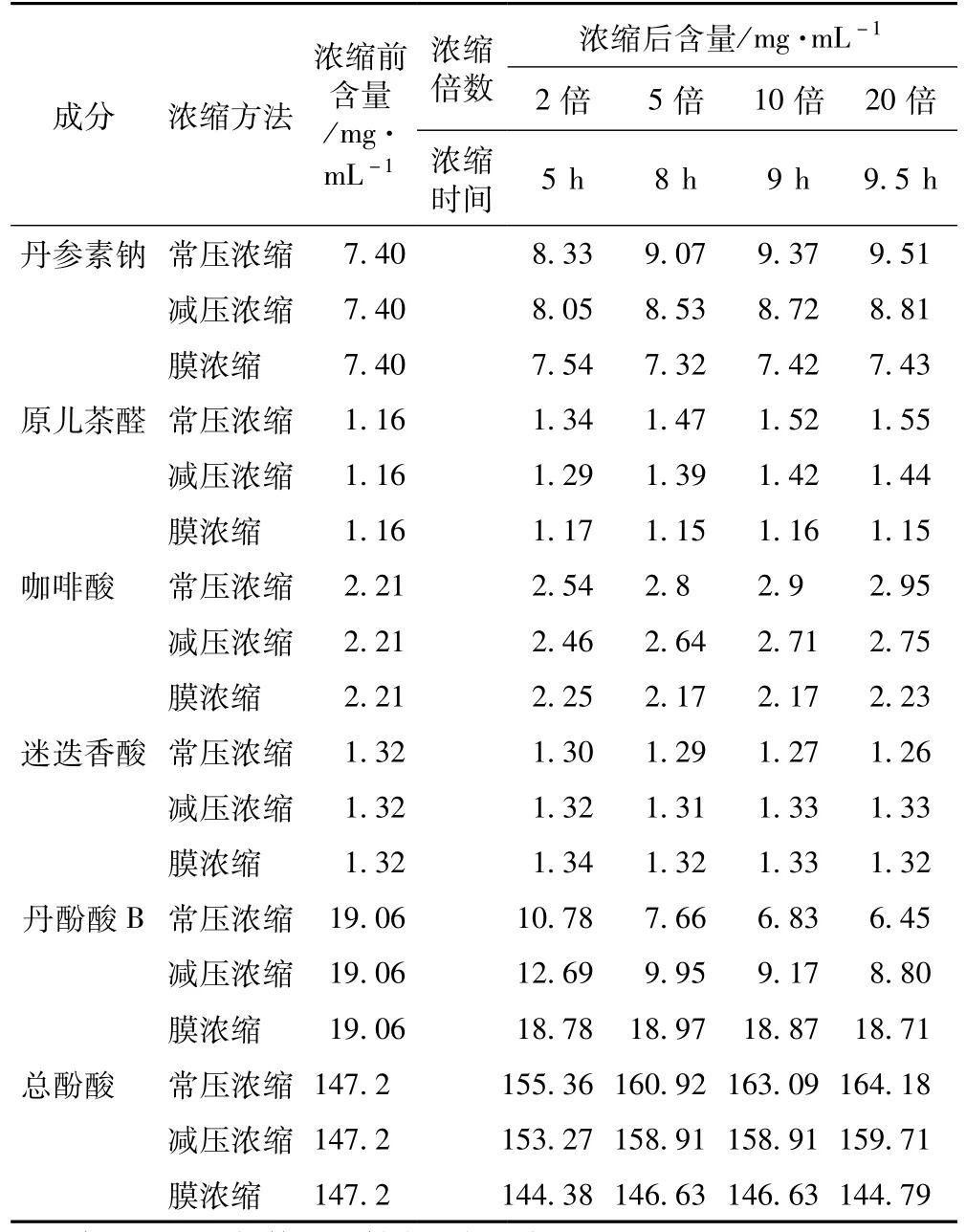
表2 丹参提取液不同浓缩方法各成分含量
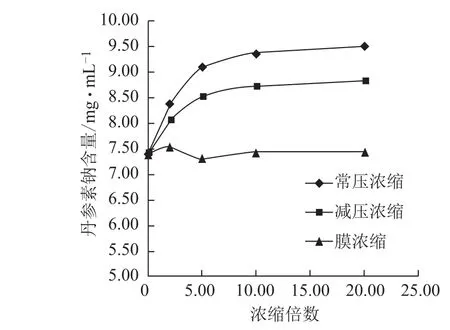
图5 浓缩过程丹参素钠含量的变化
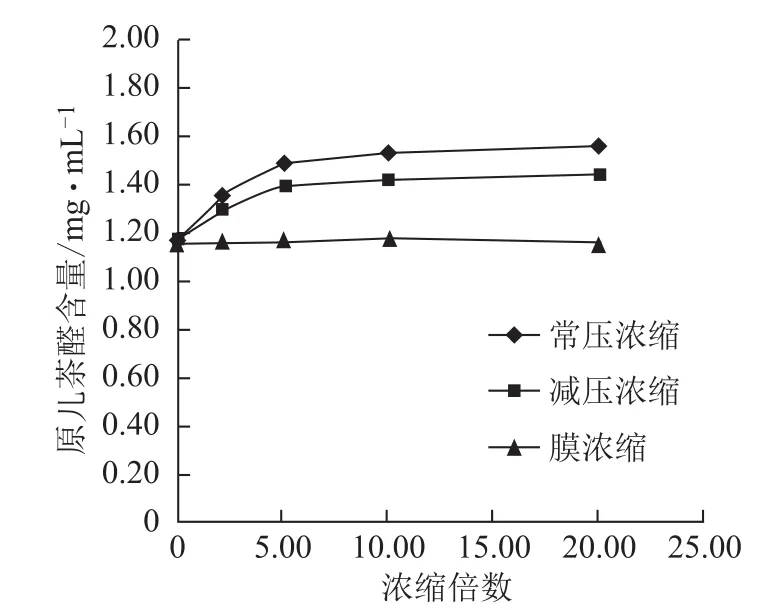
图6 浓缩过程原儿茶醛含量的变化
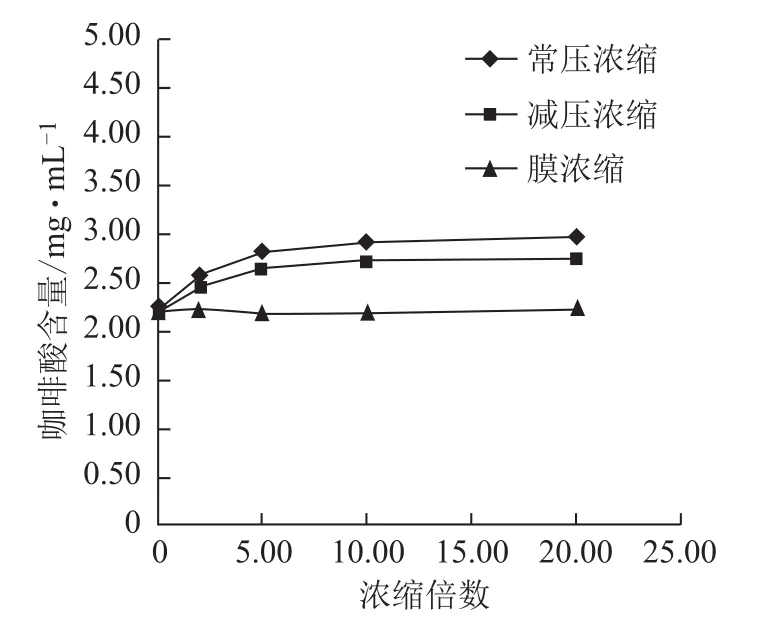
图7 浓缩过程咖啡酸含量的变化
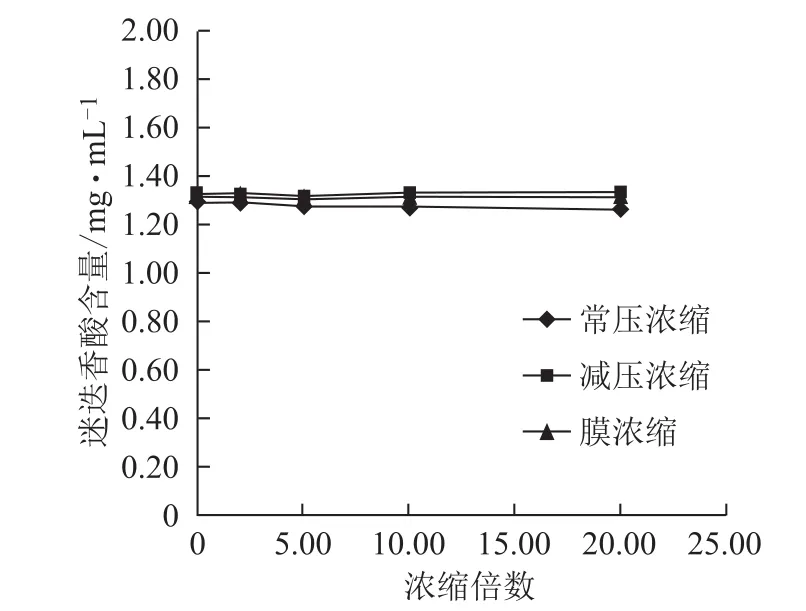
图8 浓缩过程迷迭香酸含量的变化
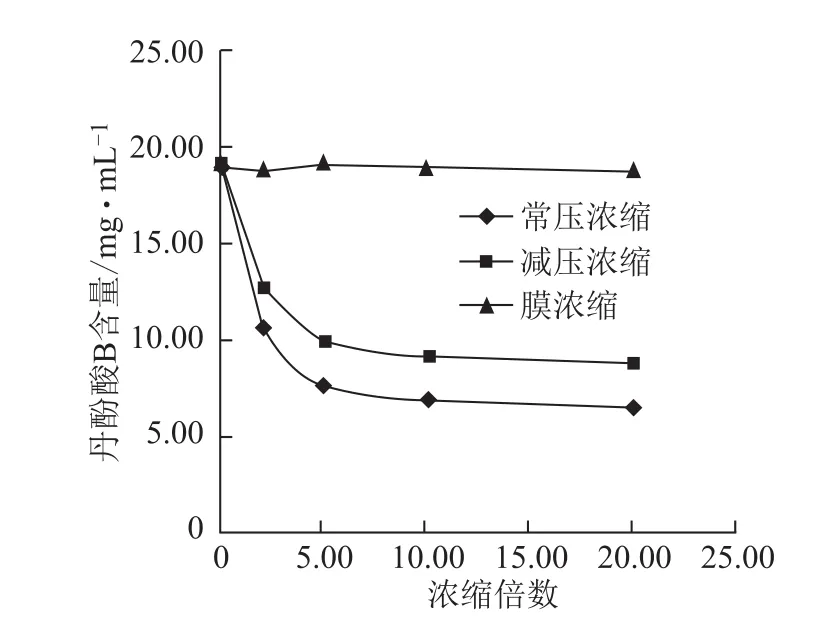
图9 浓缩过程丹酚酸B含量的变化

图10 浓缩过程总酚酯含量的变化
3.2.3 丹酚酸B降解规律分析 基于以上数据,进一步分析了解丹酚酸B的降解规律。由于丹酚酸B的降解是由于酯键的裂解产生,一般酯键的水解符合一级反应的特点,因此,以样品丹酚酸B浓度的自然对数值为纵坐标,受热时间为横坐标进行线性回归分析。丹酚酸B常压浓缩降解回归方程为Ln(C)=-0.114 t+2.947 6,减压浓缩降解回归方程为Ln(C)=-0.083 t+2.947 6。说明提取后丹参提取液在pH值一定的条件受热浓缩,其过程完全符合一级动力学方程,随温度由55~65℃变为95~100℃,其反应速率常数由-0.081 3变为-0.114。见图11。
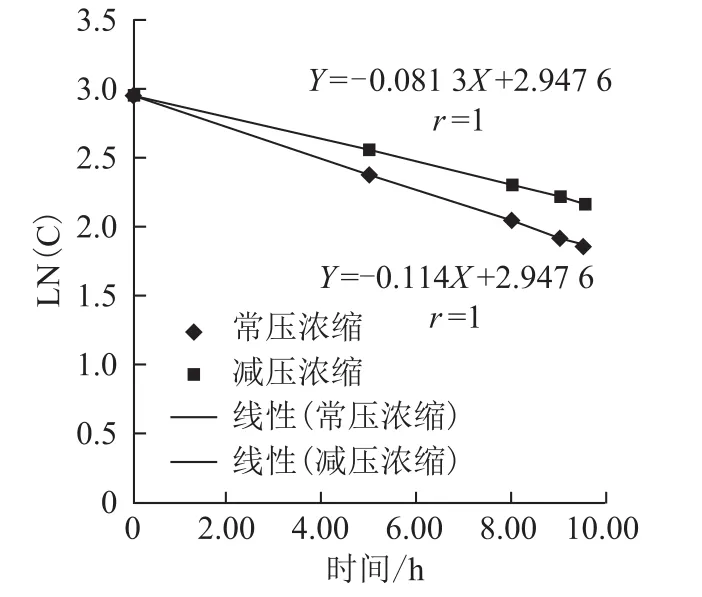
图11 浓缩过程丹酚酸B降解趋势
4 结论与讨论
为减少实验误差,过程中严格控制了加热温度、浓缩时间、真空度等参数,尽可能保证整个浓缩过程的速度,为后续物质降解规律的初步探索做准备。
在受热条件下,丹参提取液中酚酸类成分发生了降解与转化,出现了丹酚酸B显著降低,丹参素钠、原儿茶醛、咖啡酸、总酚酸含量显著增加的现象,这是由于丹酚酸B是由3分子的丹参素和1分子的咖啡酸缩合形成的,具有两个羧基,在受热和不同pH环境条件可发生降解,降解可产生丹参素、咖啡酸,在酸性条件下受热甚至进一步降解为迷迭香酸,这与文献报道一致[14-15]。而实验中迷迭香酸未见明显变化,可能是由于在该药液pH值环境下较稳定未发生降解。
丹参提取液浓缩过程中丹酚酸B的降解主要是由于酯键的裂解产生的,其降解规律符合一级反应的特点。
丹参提取液中存在热不稳定性成分,采用不同的浓缩方法会对其酚酸类成分产生明显影响,因此,生产过程中应严格控制温度、真空度、时间等参数,以保证批间的一致稳定。通过实验可以看出,纳滤膜浓缩的优点在于防止了热敏性成分的降解,最大程度地保持与药液物质基础一致,因此,应采用纳滤膜浓缩方法对丹参提取液进行浓缩。
[1] 陈佳,王钢力,姚令文,等.UPLC和HPLC方法对丹参药材中丹酚酸B含量测定结果的比对[J].药物分析杂志,2008,28(5):749-751.
[2] 翟学佳,徐锦凤.高效液相色谱法同时测定丹参药材水溶性和脂溶性成分的含量[J].医药导报,2009,28(10):1345-1348.
[3] 张雪,褚文静,刘伟娜,等.高效液相色谱-二极管阵列检测法测定冠心宁注射液中丹参素、原儿茶酸、原儿茶醛、阿魏酸、迷迭香酸和丹酚酸 B[J].中草药,2010,41(2):234-236.
[4] 陈啸飞,娄子洋,张金花,等.冠心宁注射液生产过程质量控制方法及特征成分含量变化研究[J].世界科学技术-中医药现代化,2011,13(2):303-309.
[5] 鲁兖,吴赛伟,许丹华.冠心宁注射液中酚酸类成分的质量分析[J].中国中药杂志,2015,40(9):1744-1746.
[6] 中国医学科学院.中草药现代研究:第二册[M].北京:北京医科大学中协和医科大学联合出版社,1996.
[7] 李政雄,顾文华,黄慧珠.丹参中水溶性酚酸成分的研究[J].药学通报,1981,16(9):24-28.
[8] Li L N,Tan R,Chen W M.Salvianolic acid A,a new depside from roots of Salvia miltiorrhiza[J].Planta Medica,1984,50(3):227-228.
[9] Ai C B,Li L N.Stereostructure of salvianolic acid B and isolation of salvianolic acid from Salvia miltiorrhiza[J].J Natural Products,1988,51(1):145-149.
[10]Ai C B,Li L N.Salvianolic acid G,A caffeic acid dimer with a novel tetracyclic skeleton[J].Chinese Chemical Letters,1991,2(1):17-18.
[11]Ai C B,Li L N.Salvianolic acid D and E:two new depsides from salviamiltiorrhiza[J].Planta Medica,1992,58(2):197-199.
[12]杜冠华,张均田.丹参水溶性有效成分——丹酚酸研究进展[J].基础医学与临床,2000,2(5):10-14.
[13]李朝霞,王地.丹参水溶性成分的研究进展[J].北京中医,2004,23(3):176-178.
[14]朱金墙,闫晨,康立源.丹酚酸B的稳定性及其降解机理研究进展[J].中国中医药信息杂志,2010,17(12):113-115.
[15]黄世超,潘坚扬,瞿海斌.丹参素和原儿茶醛对丹酚酸B降解规律的影响研究[J].中草药,2016,47(18):3181-3186.

