中国中药材出口面对的国际市场标准
姜振俊,张红梅,于志斌,李得运
(1.通标标准技术服务有限公司,上海 200233;2.中国医药保健品进出口商会,北京 100010)
在中药类市场国际化的大趋势之下,我国中药材的出口贸易快速增长,但随之而来的质量安全问题却阻碍了我国中药材产品进入国际市场,使我国的中药材安全性遭受到了质疑,也严重影响了我国中药产品的发展。在这种情况下,对于国外相关中药法规和质量标准的了解和研究有助于我国中药质量标准与国际市场衔接。本文通过收集既往的研究资料,对中药材主要出口国家地区的法规和质量标准进行了简单介绍,同时对于各个国家和地区的重金属和农药残留限量进行了比较分析,希望能为我国企业建立中药材出口质量风险控制提供相关参考依据。
1 我国中药出口现状及质量安全情况
1.1 中药产品出口类型
按照外贸特点和历史分类,我国中药类产品出口主要的形式是中成药、中药材及中药饮片、保健品和植物提取物,其中以中药材及中药饮片和植物提取物为主要出口形式,根据2017年1-6月份的中国医药保健品进出口商会统计数据显示,中药类产品总体出口额17.5亿美元,出口数量17.6万吨,其中中药材及中药饮片出口额5.2亿美元,出口数量10.6万吨,金额和数量占比分别为30%和60%;植物提取物出口额9.8亿美元,出口数量4.0万吨,金额和数量占比分别为56%和23%。
而我国的中药出口产品结构在近30年里也发生了重大变化,以中药材为主逐渐转为植物提取物为主[1]。
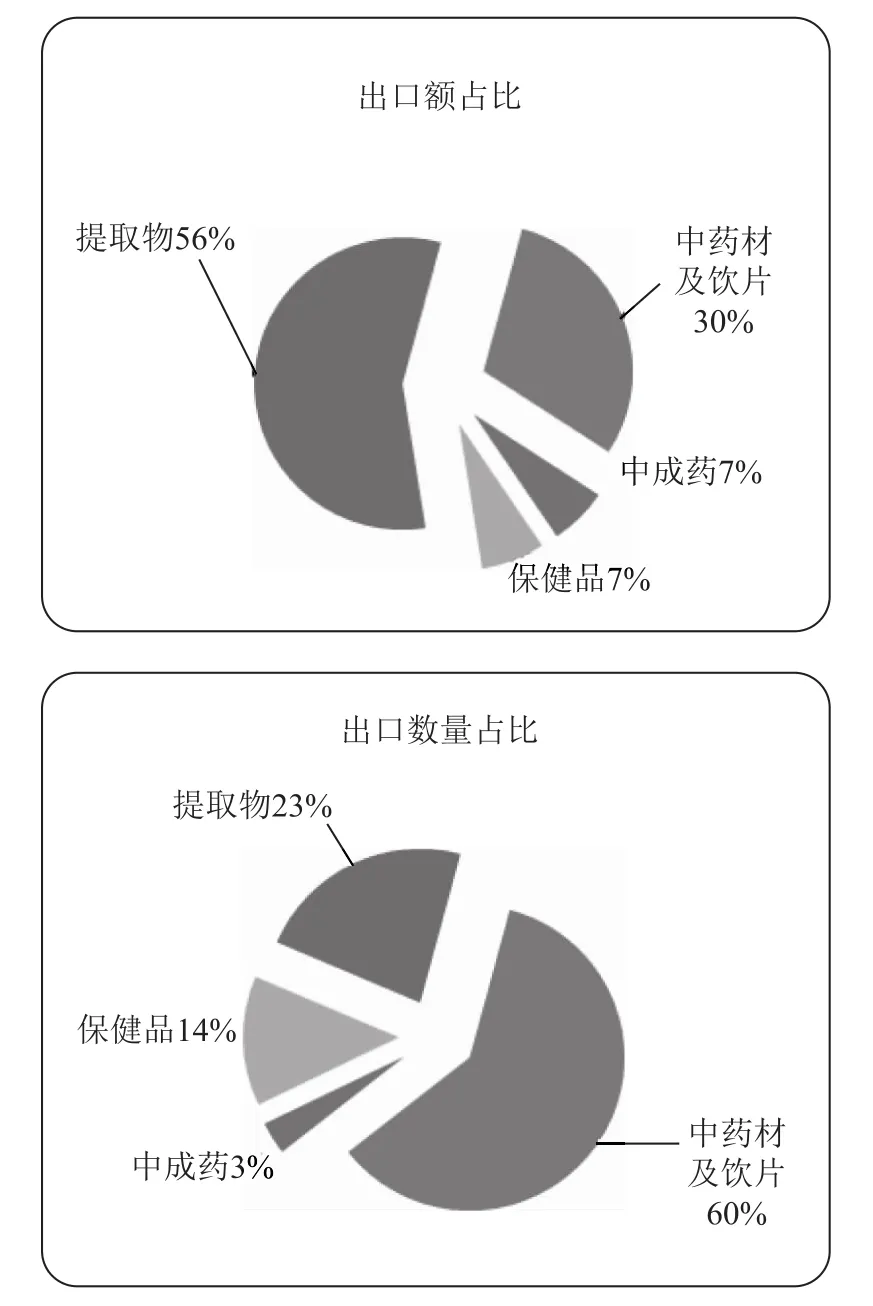
图1 2017年1-6月份我国中药类产品出口额和出口数量占比
1.2 我国中药材主要出口国家/地区
根据中国医药保健品进出口商会提供的数据表明(图2、图3),2017年1-6月份,中国香港、日本、韩国、越南、中国台湾、马来西亚、美国、印度、德国、荷兰为我国中药材及中药饮片出口的前十大市场。亚洲地区仍然是我国中药材及中药饮片的主要出口市场地区,其出口量占我中药材及中药饮片出口总量的83%,而欧美国家占比较少。这与亚洲国家对中药材的认可程度较高,同样拥有较长的中药历史有关,我国中药材在出口到亚洲各国和各地区时受到的文化差异的影响并不大,而对于欧美诸国来说,对于中药材的接受程度相对比较小,加上中药材出口企业并不能提供中药材权威的临床验证数据,缺乏高层次临床经验丰富的专家,缺少高质量的论文文献,我国中药材在出口过程中又存在很多规格和标准无法达到西方国家的质量标准要求情况,这些都使西方国家对中药材的进口产生顾虑。

图2 2017年1-6月中药材出口前十市场

图3 2017年1-6月中药材出口前十市场趋势
1.3 我国中药产品出口的质量安全情况
从上述贸易现状可以看出,随着我国中药产业的快速发展,中药企业国际化的进程加快,我国中药产品在国际市场上的占有率正在逐年提高,但随之而来的质量安全问题也日益突出。
据食品药品监督管理总局发布2013-2016年全国药品质量抽验监测数据表明,国内中药材与饮片总体合格率分别为64%、68%、75%、77%,合格率呈逐年提升、稳步向好的趋势。但相对于其他药品,中药材及饮片的不合格率依然较高[2]。
历史上中国出口的中药材因重金属和农药残留引发的质量安全事件也时有报道,此类事件的发生不仅使中药材的安全性遭受质疑,而且也给中医药产业带来了严重的经济损失,并使中国中药的声誉受到一定的影响。例如:2011年,香港发现三种中成药中有害元素具有不同程度砷超标,其中涉及国内著名品牌产品之 “牛黄解毒片”;2013年国际环保组织绿色和平组织发布的 《药中药:海外市场中药材农药残留检测报告》称,对美国、英国等7个国家的产自中国的中药材产品进行了抽样检测,发现样品中含有多种农药残留,九大中药品牌纷纷中枪。
综观这几年的中药材安全事件及出口市场的预警通报情况,农药残留、重金属是目前制约中药材出口的最主要的风险因素,占80%以上。除此以外,掺假、非法添加剂以及其他化学污染物污染等也是影响中药材质量安全的风险因素。
1.4 质量安全事件频发引发的思考
我国中药材在出口过程中所出现的质量安全事件,其原因主要来自于内部因素和外部因素,外部因素主要有国外贸易技术壁垒、中西医理念不一致、标准和测量方法不同而导致的评价差异、中国中医药质量标准在国际上缺少权威性,内部因素主要有中国企业仍缺少对国外标准的理解和研究、标准化种植养殖落实不到位,不科学使用农药化肥造成有害物质残留、中药材产地初加工设备简陋、以次充好、染色增重、掺杂使假、违法加工、非法经营中药饮片和其他药品等现象屡禁不止[2]。(如表1)

表1 中国出口出现质量安全事件因素
2 国外中药法规和质量标准简介
我国中药产品主要以普通食品、饮食补充剂、食品添加剂、药品(植物药)、化妆品和植物提取物形式进入国外市场,不同形式进入国外市场所遵循的入市途径、执行的质量标准、注册要求等都有非常明显的差别。所以了解熟悉国外中药质量标准对于中国中药进入国际市场是必不可少的。通过对国外药材标准进行比较,可以从中得到启迪,相互借鉴,完善中药质量标准体系。
目前国际上对于中药质量标准主要由药典、专论和相关文件组成。药典主要是由官方发布的标准,具有法定效力,但西方药典收载的中药品种较少,如 《美国药典》、《欧洲药典》等;具有使用传统医学历史的国家和地区则收载较多的中药品种,如《韩国药典》、《日本药典》等。专论一般是由业界自发组织编撰,用于提升中药及其产品的品质以及促进它们的合理使用,有的专论还作为国家植物药法典,如 《德国植物药专论》。[3]另外,还有通过政府和专业组织发布的一系列标准、规范、指南、程序等文件,通常也具有法定效力,也是建立完善对外贸易的重要法定依据。
2.1 欧洲
2.1.1 欧盟药品管理法规 欧盟是世界上对于药品管理和质量要求最为成熟的国家。目前,欧盟对传统植物药管理的法规有4部,分别为:2001/83/EC号法令、2003/63/EC号法令、2004/27/EC号法令和2004/24/EC号法令。2001/83/EC号法令是欧盟第一部关于人用药注册的专门法令,该法令主要对欧盟各成员国人用药品的注册、生产、销售、广告和包装等方面提出了系统的要求,该法令对植物药同样适用。2003/63/EC号法令是欧盟对药品注册申报材料规定的一部法案,该法令规定药品注册申请提供材料必须按照通用技术文件(CTD)格式。2004/27/EC号法令是对2001/83/EC号法令的修订,主要增加了药品注册互认可程序。2004/24/EC号法令是一部关于传统植物药注册的专门法令,该法令要求自2011年4月30日起所有在欧盟上市的植物性药材产品必须符合该法令,该法令对植物药注册程序、植物药定义、申报材料要求、审批程序等作了详细的规定。[4]
2.1.2 《欧洲药典》European Pharmacopoeia 由欧洲药品质量管理局(EDQM)出版和发行,是欧洲药品质量控制的法定标准,也是欧洲药品质量检测的唯一指导标准。第9版 《欧洲药典》(EP9.0),于2016年7月出版发行,2017年1月生效。内容涉及植物性药材、生物制品等产品,其中含植物产品专论200余种,除了规定生物学和化学成分的测定方法和标准外,还包括微生物、杀虫剂和烟熏剂残留、有毒金属以及可能的污染物、伪品、放射污染的测定和标准[5]。所有药品、药用物质生产企业在欧洲销售或使用其产品时,都必须遵循欧洲药典标准。
2.1.3 《欧盟草药专论》European Union herbalmonograph和 《欧盟草药名录》European Union list of herbal substances,preparations and combinations 由欧盟药监局植物药委员会(HMPC)和欧盟草药名录专家工作组 (MLWP)起草发布, 《欧盟草药专论》没有法律约束力, 《欧盟草药名录》则具有法律约束力。大部分欧盟成员国接受欧盟草药专论,是协调统一欧盟各成员国传统植物药和固有应用植物药注册特别是互认申请注册的重要依据。专论的主要内容包括被认可的传统植物药或固有应用植物药的植物原料组成、剂型、适应症、剂量和禁忌。[6]
2.1.4 《英国药典》British Pharmacopoeia 由英国药品委员会(British Pharmacopoeia Commission)正式出版的法定药品标准。英国药典最新2017版于2016年8月出版发行,2017年1月生效。是英国制药标准的重要来源,其中收录了 《欧洲药典》中的全部专论与要求。对植物药的记载内容主要包括:功效和用途、定义、鉴别、检查、含量测定以及贮藏等[3]。
2.1.5 《英国草药典》British Herbal Pharmacopoeia英国1974年出版了第一版 《英国草药典》,并进行过三次修订,总共收录了169种植物药。《英国草药典》对世界范围内提高用于制造植物药的草药原料的质量控制,确保草药的安全性与可靠性起了不可替代的作用,至今也不失为质量控制的参考标准,特别是对 《英国药典》和 《欧洲药典》未收载的植物药。
2.1.6 《德国植物药专论》German Herbal Medicine Monograph 德国卫生部于1978年设立E委员会(Commission E),由E委员会编制各个植物药专论,作为德国植物药法典,凡在德国出售的植物药,必须符合该专论的规定。专论包括了360种植物药[3]。是协调统一欧盟各成员国传统植物药和固有应用植物药注册特别是互认申请注册的重要依据。它对植物药的化学组成,所含生物活性成分,批准的适用症,禁忌,不良作用,与化学药物的交互作用,剂量范围,服用期限,药理学等均有明确规定。
2.1.7 饮食补充剂相关法规 在欧盟中药材作为饮食补充剂则需要符合 《饮食补充剂指令》Directive EC/2002/46, 《新食品管理法规 》Regulation EC/258/97, 《食品营养与健康声称法规》Regulation EC/1924/2006, 《强化食品管理法规》Regulation EC/1925/2006和欧洲食品安全局(EFSA)针对植物来源成分作为饮食补充剂的相关技术指南。除了这些主要法规外,还要符合对食品中农药残留、微生物、生物毒素、重金属以及其它有害污染物作出限量规定的 《食品标签指令》(Dir 2000/13/EC)、《食品卫生法规》(Reg EC/852/2004)、 《食品和饲料中新农兽药最高残留限量》(Reg EC/396/2005)、《食品中特定污染物最高限量水平》(Reg EC/1881/2006)等相关法规规定。[4]
2.2 美国
2.2.1 《美国药典/国家处方集》(简称 USP/NF)由美国药典委员会编辑出版,至今已被全球140多个国家与地区承认和使用。每年出版一次,最新USP40/NF35版于2016年12月份出版,2017年5月1日生效,包含4卷及2个增补版[7]。它包含关于药物、剂型、原料药、辅料、医疗器械和食物补充剂的标准,规定了植物药中微生物、农药残留和重金属检验要求,是唯一由美国FDA强制执行的植物药材和相关产品法定标准。
2.2.2 《美国草药典》American Herbal Pharmacopoeia
1995年美国草药典委员会成立,属于民间非盈利组织。其宗旨是促进植物药和植物药产品的合理使用。美国草药典计划出版至少300个常用植物药的专论,迄今为止,已经出版了19个植物药的专论,其内容非常广泛,是美国植物药的重要参考依据之一[3]。
2.2.3 《植物药工业产品指南》Guidance for Industry Botanical Drug Products 《植物药工业产品指南》是由美国FDA药物评价和研究中心(CDER)的工作小组起草,2004年6月由美国FDA发布,是FDA制定的专门针对植物药的一部法案,其主要对植物药注册申报材料、审批程序等作了详细的规定;明确指出了植物药不同于化学药的一些主要特点,在安全性相对有保障、疗效具有巨大开发潜力的情况下,适当放宽临床前研究的技术要求。
2.2.4 《饮食补充剂健康与教育法案》(Dietary Supplement Health and Education Act)简称 DSHEA 1994年美国FDA修订确立了针对饮食增补剂的安全性和标示管理法规的框架,通过了 《饮食补充剂健康与教育法案》。明确了植物性药材在不作为药品使用的前提下,可以不需要事先得到FDA的批准,用于饮食增补剂直接上市。目前根据 《植物药工业产品指南》内容,植物药产品进入美国市场的主要途径有两类:一是以饮食补充剂的形式上市,二是以植物药作为药物上市。
2.3 日本
日本植物性药材能以食品添加剂、食品特定保健用食品以及汉方药品被批准上市,其中一部分是处方药。根据用途不同,分别适用于不同的法律。
2.3.1 《日本药局方》Japanese Pharmacopoeia 由日本药局方编辑委员会编纂,日本厚生省颁布执行,具有法律效力。分两部出版,第一部收载原料药及其基础制剂,第二部主要收载生药,家庭药制剂和制剂原料。目前最新版为2016年出版的第十七改正版(即JP17)。包含生药品种276条,其中药材161条,粉末饮片55条,提取物与成方制剂60条。《日本药局方》对生药的记载内容包括基源植物学名、药用部位、科名、指标成分含量限度、性状和显微特征、鉴别、纯度检查、干燥失重、总灰分、酸不溶性灰分、浸出物含量、含量测定等。
2.3.2 《食品中残留农药肯定列表制度》简称 “肯定列表制度” 日本于2003年开始引入 “肯定列表制度”,2005年6月21日正式出台并向各成员通报了“肯定列表制度”最终草案,于2006年5月29日正式实施[8]。
“肯定列表制度”是限定在日本市场销售食品中农业化学品含量的一项制度,参照欧盟与美国标准制定,由于大部分对日出口中药产品是以食品或者食品添加剂的名义入关,所以 “肯定列表制度”对中药产品适用。且 “肯定列表制度”中涉及的农业化学品以农药为主,仅 “暂定限量标准”规定的农药就有734种,涉及50000余项。所以日本的“肯定列表制度”是一项重要的影响中药出口的农残标准。肯定列表制度对我国中药材出口影响如图4。

图4 肯定列表制度对我国中药材出口影响
2.4 韩国
2.4.1 《韩国药典》The Korean Pharmacopoeia和 《韩国草药典》Korean herbal Pharmacopoeia 韩国食药局(KFDA)颁布了 《韩国药典》以及 《韩国草药典》作为补充,两部药典共收录了500多种植物性药材及其制剂的质量标准[9]。包括了重金属、农药残留、二氧化硫残留、真菌毒素、苯并芘标准的限量标准。
2.4.2 《生药等残留污染物质标准和实验方法》2011年,韩国食药局发布2011-27号公告,对韩国“生药等残留污染物质标准和实验方法”再次进行修订[8],制定了生药(包含中药和中药材)及其提取物(包含萃取物、液态浸膏、药酒)产品的重金属、农药残留、二氧化硫残留、真菌毒素、苯并芘标准和实验方法,并以此来确定生药的质量管理标准。除在 《韩国药典》和 《韩国草药典》等医药品各条款中规定上述限量标准及实验方法的品种外,均遵守此标准及实验方法。该标准制定的限量标准约3000余条,覆盖了仅500余种中药材及其制剂[10]。
2.5 中国香港
《香港中药材标准》简称 “港标”,由中国香港卫生署负责制定,在2002年开始推行,分阶段为常用中药材制定标准,以确保中药材的安全及品质。目前共发布了八册,涵盖了275种中药材的研究结果和标准。《第八册》在2017年3月公布。港标对每味中药材都规定了重金属、农药残留、黄曲霉素等含量的限制。 《港标》内容简洁、详细,图文并茂,操作性强,并提供中英文版本,与国际植物药标准接轨,是国际化的中药材标准[3]。
3 各国家/地区中药材重金属和农药残留限量标准
3.1 各国家/地区中药材重金属限量标准
自20世纪90年代,中药材中重金属限量问题就已受到世界各国各地区的关注,很多国家和地区对重金属含量制定了明确的限定标准。但由于对中药的重金属限量缺乏统一的认识与标准,世界各国、各地区对进口的中药实行各自的限量标准,要求不尽相同。《欧洲药典》、《美国药典》、WHO的 《中药污染物和残留物标准》、 《英国药典》、 《韩国药典》、《日本药典》、《香港中药标准》、《中国药典》和 《中国药用植物及制剂进出口绿色行业标准》等均对中药材重金属含量制定了明确的限量标准,如表2所示。

表2 各国家/地区中药材重金属限量标准表[11-12]mg/kg
从以上重金属限量标准的情况表明中国药典规定的重金属限量标准并不低于国外药典的限量标准,甚至铅、砷限量标准比国外限量标准更为严格。中国(包括 《中国药典》2015版)规定了药材中铜的限量值20 mg/kg。其他国家如美国、欧盟、日本等国家地区及WHO对于中药材重金属限量中的铜未做出限量要求。对于铅、砷、镉、汞四种重金属元素各国各地区的限量要求也很不相同,中国的中药材重金属限量处于其他国家地区的范围间。由此可见,我国的中药材中重金属限量标准比较完善[12]。
3.2 各国家/地区中药材农药残留限量标准
各国家和地区的植物药农药残留限量标准不同。《欧洲药典》、《美国药典》涉及植物药农药残留共76种(部分以总和统计),各种农药之间的限量值差别很大,《欧洲药典》和 《美国药典》是当前世界上农药残留限量最多的药典,欧盟的植物药农药残留限量标准比较完善,美国的植物药农药残留限量标准完善程度次于欧盟。韩国、日本的植物药农药残留限量标准相对欧盟、美国的植物药农药残留限量标准检测指标较少。但在亚洲国家药典中,《韩国药典》涉及检测的限制类农药较多,还规定了部分农药在常见植物药中的限量,比较实用,可供我国农残限量标准制定提供参考。而日本对植物药的农药残留限量要求太过严格,但涉及的植物药的农药种类相对偏少。《英国药典》的农残限定方式相对粗略,只是对植物药中的农药进行了概括性限制;有机氯农药的限制为0.05 mg/kg,其他农药限制为0.5 mg/kg或 1.0 mg/kg。以 《中华人民共和国药典》为中心的我国中药材质量标准体系中,目前涉及农药残留量检测的指标和品种还较少。另外,我国具有农药登记信息的中药材品种数量很少,中药材农药登记的制度不完善,这也影响到我国中药材种植过程中农药的正确使用[12]。

表3 各国家/地区中药材农药残留限量标准表[12]mg/kg

表3(续)
4 中国中药材出口质量风险控制的浅见
中国中药国际化,质量必须先行,我国中药出口企业可以从明确出口市场策略、制定入市产品战略、建立合规性风险评估、寻找本地化专业机构合作等方面建立起出口质量风险的综合控制模式,与此同时,还可以从以下几方面进行考虑。
4.1 从源头上提高中药产品的质量
针对有害物残留量的限定、中药成分的规定等绿色技术壁垒,中国中药材生产企业应从源头上提高中药产品的质量。建议按照国家 “GAP”标准、“GACP”核定要求和绿色产品标准,建立具有特色优质的高标准中药材示范种植园,进行良种选育,严格控制重金属和农药残留量。
4.2 加强对国内外法规标准的研究和分析,加强国际间的合作与交流
深入研究国外中药法规标准,提前建立合规性风险评估、对于中药中的动物、矿物成分,尤其是属于国外禁止的动植物成分进行了解和掌握,开发符合目的国法规要求的出口产品。同时还需要与相关国家机构和组织建立广泛深入的交流、沟通与合作。
4.3 建立起科学合理的中药材重金属及有害元素风险评估体系
重视风险评估的样品筛查数据。应重视暴露评估工作所选的品种,尽可能选择重金属积蓄较为严重的多年生品种或者是使用较为广泛的大宗品种。中药材重金属元素的风险评估工作需在毒理学研究基础上,结合毒理评价与中药材的检测数据系统地开展研究。建议国内企业、协会和科研机构多开展合作交流对中药材风险评估体系进行基础研究。
4.4 建立中药材农药残留风险评估体系
建议政府监管部门加强中药材农药残留风险评估工作,建立完善的针对中药材的农药残留和安全风险评估体系,完善我国中药材农药登记管理制度,健全登记使用农药的中药材品种。
[1] 张中朋,汪建芬.我国中药贸易现状及思考[J].中国现代中药,2017,19(2):278-282.
[2] 杨珍.中药材质量安全问题该何去何从[J].CHINA FOOD SAFETY,2017:56-57.
[3] 赵中振,粱之桃,郭平.海外植物药的质量标准—对中药标准化的一些启示[J].中国中医杂志,2009,34(16):2119-2125.
[4] 杨颜芳,张贵君,王晶娟.植物药欧盟及美国上市可行性途径及法规分析.中药鉴定学科教学改革与教材建设研讨会:2015.
[5] 杨颜芳,张贵君,王晶娟.欧盟-美国FDA及中国对植物药的质量标准与质量评价研究.中药鉴定学科教学改革与教材建设研讨会:2015.
[6] 朱友平.欧盟植物药注册法规和质量技术要求和中药国际化新药开发[J].中国中药杂志,2017,42(11):2187-2192.
[7] The united states pharmacopeial convention.The united states pharmacopeia,40th revision/national formulary,35th Edition.Rochville:The united states pharmacopeial convention,2017.
[8] 钱韵旭.国外新农残标准对中药出口的影响及对策研究.沈阳医科大学博士学位论文.2014.
[9] 王勇涛,刘国瑛,吴传金等.主要贸易国家植物性药材管理法规及规定的研究[J].2014,27(1):49-52.
[10]代汉慧,陈冬东,彭涛等.韩国中药材管理概况[J].中医药管理杂志,2013,21(1):8-9.
[11]中国对外贸易合作部.药用植物及制剂进出口绿色行业标准.对外贸易经济合作部公告[2001]年第4号,2001.
[12]孔繁越.中药材重金属限量标准和农残限量标准研究及标准制定相关建议.硕士研究生学位论文.2014.

