青海云杉愈伤组织增殖与体胚成熟阶段影响因子研究
秦彩云,李青梅,王聪慧,陈士刚,才巨峰,高芳,侯淑荣,陶晶,*
0 引言
青海云杉(Picea crassifolia Kom.) 为云杉属常绿 乔木,喜寒冷潮湿环境。耐寒、耐旱、耐瘠薄,适应性强,在水肥条件较好地段生长较迅速[1]。分布于甘肃、宁夏、青海东部和内蒙古中部。青海云杉树体呈伞状,紧凑优美,在保持水土、调节气候、涵养水源和维持生态平衡方面具有重要生态、经济和社会价值,是良好的园林绿化、通道绿化、荒山造林树种[2]。
体细胞胚胎发生是指双倍体或单倍体的体细胞(非合子细胞)在特定条件下,未经性细胞融合而通过与合子胚胎发生类似的途径发育出新个体的形态发育过程[3]。具有遗传稳定、繁殖快、数量多、结构完整等优点,并且具有以低成本繁育出大量高品质苗木的潜能。体细胞胚发生技术已成为针叶树种无性繁殖技术的一个新进展,它可以从未成熟胚、成熟胚、子叶中获得胚性愈伤组织,进而分化发育成大量无性繁殖体,类似于种子胚发育成植株的过程。
利用体胚发生技术可缩短青海云杉育种周期,为其遗传改良和林木良种化提供无性繁育手段,实现快速无性繁殖和定向遗传改良,对该树种优良种质资源保存利用[4-5],促进林木良种化进程具有重要意义[6-12]。本研究以青海云杉未成熟胚为外植体,进行体胚发生的相关研究,探究继代周期、植物生长调节物质以及不同种源对胚性愈伤组织保持增殖的影响,探究体细胞胚的发育与成熟过程中的影响因素。研究结果为青海云杉体胚发生奠定基础,为云杉属树种体胚发生提供借鉴。
1 材料与方法
1.1 试验准备
1.1.1 试验材料
青海云杉球果2013年9月下旬至2015年采于青海门源县(1#种源)、吉林磐石县(2#种源)、长春净月(3#种源)、甘肃榆中县(4#种源)。球果采回后,用75%的酒精擦拭表面,晾干表面酒精后装入塑料袋中,放入4℃冰箱冷藏,试验时取出。
1.1.2 基本培养基的配制方法
试验过程中所用培养基均在高温高压灭菌前将pH调节至5.8(灭菌温度为121℃、时间为20 min),L-谷氨酰胺和ABA为培养基灭菌后冷却至约50℃,用0.22微摩尔孔隙的滤器过滤灭菌加入。接种后培养物均放于培养室中24 ± 1℃培养。
1.2 外植体的灭菌方法与试材准备
选择4个种源的青海云杉成熟胚作为诱导体细胞胚性组织的外植体材料。青海云杉球果剥去种鳞之后,将种子于超净工作台中用75%的酒精处理0.5~1 min,无菌水冲洗3~5次;用质量浓度为10%的次氯酸钙溶液处理15~20 min,无菌水冲洗3~5次;剥去种皮,并将合子胚从胚乳中剥出接种于培养皿中,每皿10个外植体。
愈伤组织诱导的培养基为:改良1/2LV[13]+ BA 2.25 mg/L + 2,4-D 6.6 mg/L + 水解酪蛋白400 mg/L+ L-谷氨酰胺400 mg/L + 蔗糖10 g/L + Phytagel凝胶3.5 g/L,每个培养皿内10个合子胚,每处理10皿,接种后用封口膜密封,24±1℃条件下暗培养。60 d后得到胚性愈伤组织作为后续试验的试材。
1.3 胚性愈伤组织增殖
将青海云杉胚性愈伤组织分割成重量约为0.5 g的组织团,选取诱导试验中诱导率较高的基本培养基和激素组合,研究激素组合对青海云杉增殖的影响。基本条件如下;以改良1/2 LV为基本培养基,培养基内均附加水解酪蛋白800 mg/L+ L-谷氨酰胺400 mg/L + 蔗糖10 g/L + Phytagel凝胶3.5 g/L。每间隔2周转接一次,培养条件均为24±1℃暗培养。
1.3.1 植物生长调节物质组合对胚性愈伤组织保持与增殖的影响
为探究青海云杉愈伤组织增殖的适宜条件,探究生长调节物质浓度对愈伤组织增值率的影响。分别以愈伤组织诱导的最佳激素浓度组合的3/4、1/2、1/4、1/8、1/10作为增殖激素浓度组合,即2,4-D浓度分别为4.95、3.3、1.65、0.82、0.66,BA浓度分别为1.69、1.13、0.56、0.28、0.23。接种后进行培养(培养基内其他条件与1.3一致),每皿中接种4团,每个处理4个重复。15 d后称取每皿中胚性愈伤组织的质量,计算出增殖率(倍)。
1.3.2 胚性愈伤组织继代周期的确定
挑选长势较好的青海云杉胚性愈伤组织为材料(该部分以1#为试验材料),称取0.05 g组织,接种于1.3.1部分筛选出的最佳培养基上进行培养,每皿四块组织,重复10次。每隔1 d称取胚性愈伤组织重量,观察组织长势,算出增殖倍数并绘制增殖曲线图,确定最佳继代周期。
1.3.3 不同无性系之间胚性愈伤组织保持与增殖的特点
挑选长势较好的胚性愈伤组织(分别为1#、2#、3#、4#4个无性系),称取0.2 g胚性愈伤组织接种于1.3.1筛选出的最佳培养基上,每皿4团胚性组织,10个重复。15 d后统计愈伤组织的增殖量情况及生长状况。
1.4 体细胞胚成熟
成熟培养开始前,每个无性系的胚性组织在增殖培养基上进行2个周期的次生培养(每个周期为14 d)。在第三个次生培养时,使用无激素的增殖培养基预处理7 d,此时的胚性组织即可用于成熟培养。
体胚成熟培养基为改良1/2 LV培养基 + 水解酪蛋白800 mg/L + L-谷氨酰胺400 mg/L + 蔗糖30 g/L + 30 g/L +Phytagel凝胶 5.5 g/L。同时在培养基内添加ABA(浓度分别为10、20、30、40、50 mg/L)。温度24±1℃条件下暗培养。每个处理25盘,3次重复。2~3个月后统计正常体细胞胚的获得率。并在显微镜下统计形成子叶的正常胚的数量。
1.5 数据的统计
青海云杉体细胞胚胎发生及植株再生试验中的胚性愈伤诱导率、胚性愈伤增殖率、胚性愈伤分化率、体细胞胚萌发率均按下公式计算得出:
胚性组织诱导率(%)=产生胚性组织的外植体数/接种未感染外植体数×100。
胚性组织增殖率(倍)=胚性组织增殖量/胚性组织初始接种量。
单位重量正常成熟胚数量(个/g)=获得正常成熟胚数量/所需胚性愈伤组织重量。
正常体细胞胚的获得率(%)=单位重量正常成熟胚数量/单位重量正常胚和畸形胚总数×100。
体细胞胚萌发率(%)=每个处理中萌发的植株总数/每个处理中未污染的成熟体细胞胚总数×100。
2 结果与分析
2.2 青海云杉胚性愈伤组织增殖
2.2.1 植物生长调节物质组合对胚性愈伤组织保持与增殖的影响
不同植物生长调节物质浓度组合对青海云杉增殖的影响结果见表1,随着2,4-D和BA 浓度的降低,愈伤组织诱导率呈现先升高后降低趋势,当激素浓度为愈伤组织诱导浓度的1/2时(即2,4-D 3.3 mg/L + BA 1.1 mg/L组合时),青海云杉增殖率最高,同时长势也最好,如图1(b)所示。因此将1/2愈伤组织诱导的最佳培养基激素浓度作为愈伤组织增殖的培养基,既能保证愈伤组织的较大增殖率,又能保持胚性愈伤组织的胚性和新鲜活力。
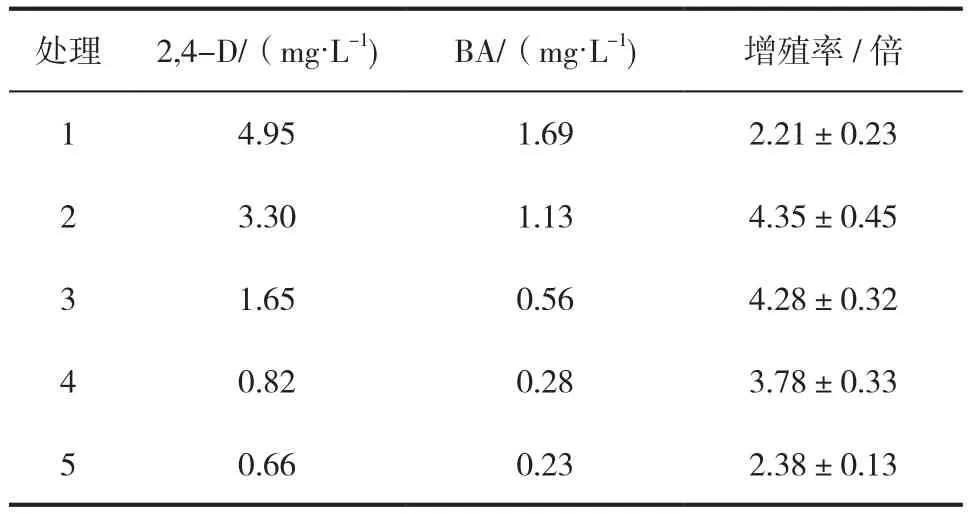
表1 不同植物生长调节物质浓度组合对青海云杉增殖的影响Tab.1 Effects of different combinations of hormones on embryonic callus maintenance and proliferation of P. crassifolia
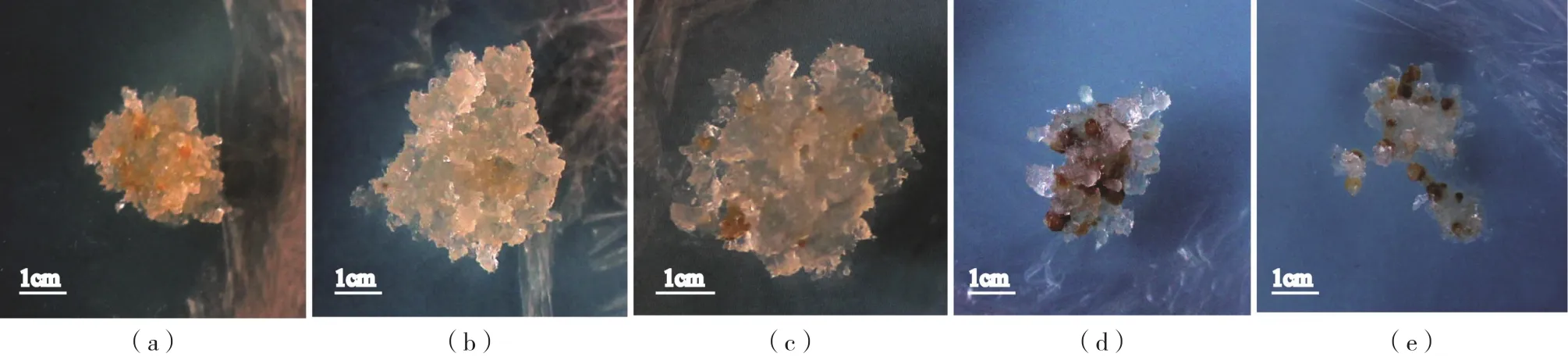
图1 不同植物生长调节物质浓度组合下青海云杉胚性愈伤组织的生长状态Fig.1 The growth status of the tissue of spruce embryogenesis in P. crassifolia under the combination of plant growth and regulation
2.2.2 胚性愈伤组织继代周期的确定
胚性愈伤组织增殖曲线如图2所示,胚性愈伤组织在增殖过程中增值率整体呈先升高后缓慢降低趋势,胚性愈伤组织在10~14 d有一个迅速增殖小高峰;12 d时增殖速度最快,16 d时增殖速度开始缓慢减小,此时胚性愈伤组织长势较好;在试验过程中观察到 30 d时,胚性愈伤组织褐化较严重,胚性逐渐消失。因此胚性愈伤组织继代培养周期以14~16 d左右为宜,此时既能保持胚性愈伤的胚性,又能获得较大的增殖量。
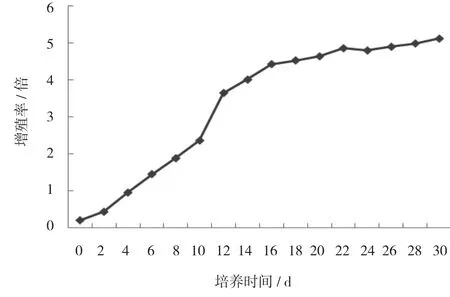
图2 胚性愈伤组织的增殖曲线Fig.2 Growth curves of embryogenic callus
2.2.3 不同无性系之间胚性愈伤组织保持与增殖的特点
不同种源对胚性愈伤组织保持与增殖阶段的影响结果见表2,不同种源在相同的培养条件下增殖能力不同,其中1#、4#种源增殖能力较强,1#种源增殖能力最强,2#、3#种源增殖能力较弱;3#种源增殖能力最弱,四个种源的增殖能力整体呈现1#>4#>2#>3#。
2.3 体细胞胚的发育与成熟
选取长势较好的胚性愈伤组织接种于体胚成熟培养基中。按照ABA含量和种源的不同分为10个处理。每种处理接种一定重量的胚性愈伤组织(表3)。10 d后,部分组织褐化,表面凸起,逐步发育成原胚,如图3(a)所示;20 d后,球形胚顶端伸长,渐渐向柱状转变;30 d后,柱状两边继续伸长,发育成子叶胚;40 d后,部分子叶化发育成熟,如图3(b)所示。
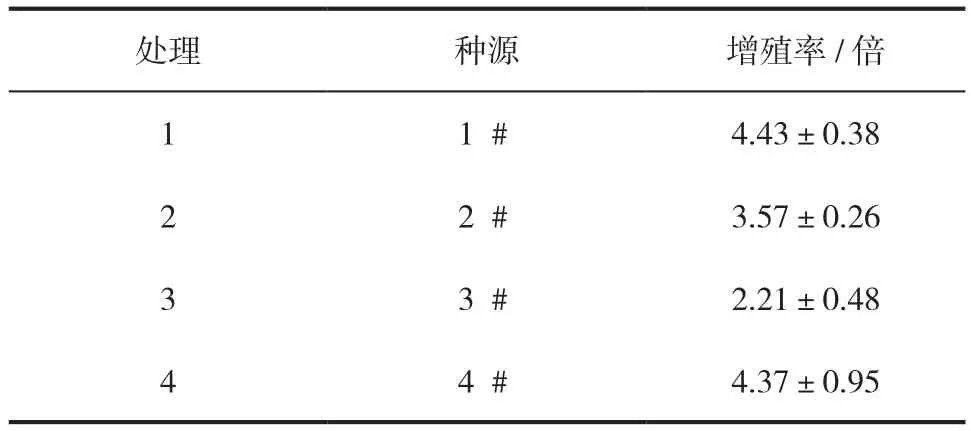
表2 不同种源对胚性愈伤组织保持与增殖的影响Tab.2 The characteristics of embryogenic callus maintenance and proliferation of P. crassifolia from different provenance
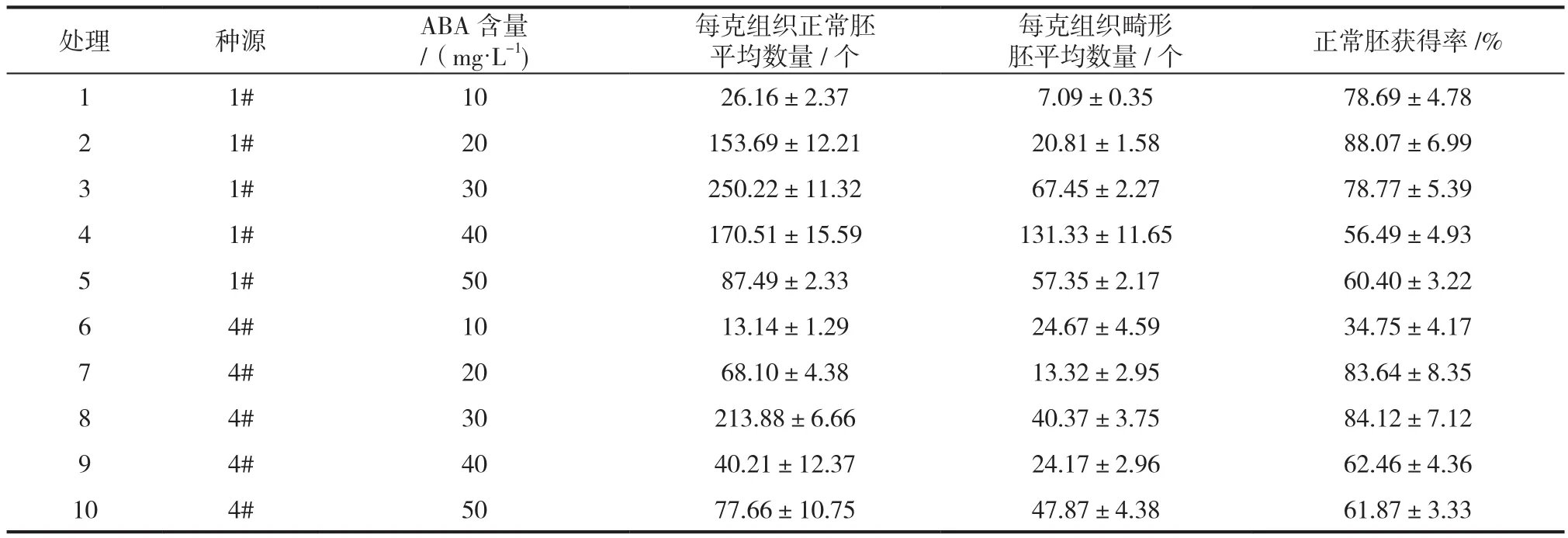
表3 不同ABA含量对青海云杉体胚成熟的影响Tab.3 Effects of maltose and ABA concentration on induction rate of cotyledonous embryo of P. crassifolia
ABA含量为30 mg/L时,两个种源每克胚性组织获得的正常胚数量最多,分别达到250.22个(1#种源)、213.88(4#种源),正常胚的获得率达到78.77%(1#种源)、84.12%(4#种源)。1#种源中正常胚获得率最高的ABA含量并不是正常胚获得数量最多的,在实际成熟过程中,还是应以每克组织获得正常胚数量这一标准为主要依据。两个种源在相同条件下胚成熟的程度也不尽相同,据实际生产需要获得高效成熟的胚性无性系是提高体细胞胚培养效率的关键因素。
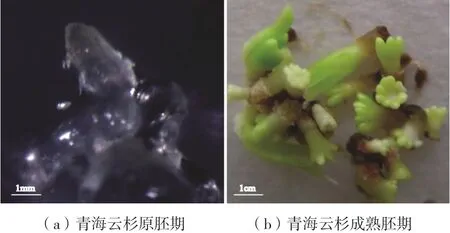
图3 青海云杉体细胞胚的发育与成熟Fig.3 the development and maturation of P. crassifolia somatic embryogenesis
3 讨论与结论
组织培养技术是优良种质资源快速扩繁的一种重要手段,其中植物体细胞胚胎发生(简称体胚发生)具有遗传性稳定、繁殖速度快、成活率高等优点,是利用植物细胞工程手段实现植株再生的重要途径之一;特别是对于繁殖周期较长且扦插繁殖成活率较低的针叶树种来说,具有巨大的应用价值[6,14]。已有报道表明,针叶树种体胚发生均为间接发生,即都需经历愈伤组织诱导阶段[6-7]。同时,愈伤组织也是优良种质资源的重要保存形式[7-8,15-16]。因此,愈伤组织的诱导是针叶树体胚发生的重要步骤。在本研究中胚性愈伤组织在添加不同植物生长调节物质浓度组合培养基上,胚性保持与增殖能力存在一定差异。在本研究的各处理中愈伤组织均具有一定的增殖能力。在植物生长调节物质浓度为1/2的愈伤组织诱导培养基上组合的培养基中可长期保持胚性并增殖。
本研究也证明增殖培养周期过长或过短均不利于胚性愈伤组织的增殖。培养周期过短,会严重影响胚性愈伤组织的增殖率,提高成本,加大工作量;培养周期过长则会引起培养基养分不足、污染率增加等问题,导致胚性愈伤组织长势差,最终失去胚性。综合考虑胚性愈伤组织的增长率与生长状态,以14~16 d左右作为增殖继代周期,既能保持胚性愈伤组织的良好的生长状态,又能保证较大的增殖率,多次继代,胚性消失现象不明显。
在针叶树种中ABA和渗透调节物质被广泛的应用体胚成熟培养基中来促进体胚成熟[17-19]。在许多松属树种中,在体胚发育与成熟阶段,通过撤除生长素和细胞分裂素,外源添加ABA来实现体细胞胚胎的发生。ABA的作用主要是促进体胚成熟、防止畸形胚产生、抑制体胚的过早萌发、防止针叶树的裂生多胚现象[19]。ABA在提高针叶树体细胞胚胎发生的频率和质量中有重要作用。青海云杉的体胚成熟试验同时加入了不同浓度的ABA,当ABA含量为30 mg/L时,两个种源每克胚性组织获得的正常胚数量最多。
青海云杉未成熟胚可以诱导获得体细胞胚,胚性愈伤组织保持与增殖阶段的适宜培养基为改良1/2 LV + 2,4-D 3.3 mg/L + BA 1.1 mg/L + 水解酪蛋白400 mg/ L + L-谷氨酰胺400 mg/L + 10g/L蔗糖 + Phytagel凝胶3.5 g/L;胚性愈伤组织继代周期以14-16 d为宜,既能保持愈伤组织胚性,又能获得较大的增殖量;体胚发育与成熟过程中,当ABA含量为5.28 mg/L时,两个种源每克胚性组织获得的正常胚数量最多。
[1]赵守平. 青海云杉的特征特性及育苗技术[J]. 现代农业科技,2012(6):215-216.
[2]渠春喜, 崔贵文, 冯建华. 华隆林区青海云杉育苗技术措施研究[J]. 甘肃科技, 2012, 28(11):130-131.
[3]沈海龙. 植物组织培养[M]. 北京: 中国林业出版社, 2005.
[4]Nørgaard J V, Duran V, Øystein Johnsen, et al. Variations in cryotolerance of embryogenic Picea abies cell lines and the association to genetic, morphological, and physiological factors[J].Canadian Journal of Forest Research, 1993, 23(12): 2560-2567.
[5]梁艳, 沈海龙, 高美玲, 等. 红松种子发育过程中内源激素含量的动态变化[J]. 林业科学, 2016: 52(3), 105-111.
[6]Timmis R. Bioprocessing for tree production in the forest industry:conifer somatic embryogenesis[J]. Biotechnology Progress,1998, 14(1): 156-166.
[7]Stasolla C, Yeung E C. Ascorbic acid metabolism during white spruce somatic embryo maturation and germination[J].Physiologia Plantarum, 2001, 111(2): 196-205.
[8]Stasolla C, Kong L, Yeung E C, et al. Maturation of somatic embryos in conifers: morphogenesis, physiology, biochemistry,and molecular biology[J]. In Vitro Cellular & Developmental Biology Plant, 2002, 38(2): 93-105.
[9]Elhiti M, Stasolla C. The use of zygotic embryos as explants for in vitro propagation: an overview[J] Methods in Molecular Biology,2011, 710(5): 229-255.
[10]Lelu-Walter M A, Thompson D, Harvengt L, et al. Somatic embryogenesis in forestry with a focus on Europe: state-of-theart, benefits, challenges and future direction[J]. Tree Genetics& Genomes, 2013, 9(4): 883-899.
[11]季孔庶, 王潘潘, 王金铃, 等. 松科树种的离体培养研究进展[J]. 南京林业大学学报(自然科学版), 2015, 39(1): 142-148.
[12]Salaj T, Matusova R, Salaj J. Conifer somatic embryogenesis an efficient plant regeneration system for theoretical studies and mass propagation[J]. Dendrobiology, 2015, 74: 69-76.
[13]Percy R E, Klimaszewska K, Cyr D R. Evaluation of somatic embryogenesis for clonal propagation of western white pine[J].Canadian Journal of Forest Research, 2000, 30(30): 1867-1876.
[14]Stasolla C, Loukanina N, Ashihara H, et al. Pyrimidine nucleotide and nucleic acid synthesis in embryos and megagametophytes of white spruce (Picea glauca) during germination[J]. Physiologia Plantarum, 2002, 115(1): 155-165.
[15]翟晓巧, 程斐, 朱延林. 二乔刺槐愈伤组织超低温保存及适宜降温方法[J]. 林业科学, 2009, 45(10): 49-54.
[16]Pullman G S, Bucalo K. Pine somatic embryogenesis using zygotic embryos as explants[J]. Methods in Molecular Biology, 2011,710(710): 267-291.
[17]Stasolla C, Yeung E C. Recent advances in conifer somatic embryogenesis: improving somatic embryo quality[J]. Plant Cell Tissue and Organ Culture, 2003, 74(1): 15 - 35.
[18]Attree S M, Fowke L C. Embryogeny of gymnosperms: advances in synthetic seed technology of conifers[J]. Plant Cell Tissue and Organ Culture, 1993, 35(1): 1-35.
[19]Zhang C, Li Q, Kong L. Induction, development and maturation of somatic embryos in Bunge's pine (Pinus bungeana Zucc. ex Endl.)[J]. Plant Cell Tissue and Organ Culture, 2007, 91(3): 273-280.

