花椒油在贮藏过程中麻味强度及麻味物质的变化研究
张希,靳岳,赵志峰*,何强,谷学权,幸勇
(1.四川大学 轻纺与食品学院,成都 610065;2.四川五丰黎红食品有限公司,四川 雅安 625302)
花椒(Zanthoxylumbungeanum)系芸香科花椒属植物,因其具有独特的“麻味”以及唾液分泌性质而被誉为中国“八大味”之一[1]。花椒中的麻味物质主要是一些链状不饱和酰胺类物质[2]。花椒的麻味很不稳定,在室温下贮藏1年后,其香味和麻味都有明显的降低,品质发生较大变化[3,4]。花椒油是指将花椒置于加热后的食用油中进行浸泡得到的具有香麻味的调和油,或采用有机溶剂提取法、超临界流体萃取法等制得的花椒油树脂与食用油调配而成[5]。因其方便且麻香味浓郁,在川菜、凉菜及火锅中均有大范围的使用[6]。
目前,国内外对花椒油的研究主要集中在花椒油的化学成分[7-9]、生理活性[10,11]等方面,鲜有关于花椒油包装方式、贮藏条件以及在贮藏过程中麻味物质含量变化的研究,更鲜有花椒油麻味强度的定量研究。因此,本文拟采用有机溶剂提取和HPLC法定量分析花椒油在不同贮藏条件下麻味物质的含量变化,同时采用Half-tongue检验测定花椒油在人体中的检测阈值,计算得到稀释倍数来表征花椒油的麻味强度,并进一步采用唾液分泌实验对麻味强度的定量方法进行修正,本文旨在为花椒油的贮藏提供参考。
1 材料与方法
1.1 材料与试剂
花椒油:2015年8月生产,四川五丰黎红食品有限公司。
氯仿、氧化铝、甲醇、乙腈:成都科龙试剂厂;食用酒精:河南佳诺食品添加剂有限公司;玉米油:四川成都建华食品有限公司;滤纸(形状为1 cm×2 cm矩形):抚顺市民政滤纸厂。
1.2 仪器与设备
水浴锅、电热鼓风干燥箱 北京中兴伟业仪器有限公司;离心机 长沙湘智离心机仪器有限公司;RE-5299旋转蒸发仪 上海亚荣生化仪器厂; LC-6AD高效液相色谱仪 日本岛津公司;SHZ-D循环水式真空泵 上海道京仪器有限公司。
1.3 方法
1.3.1 预处理
花椒油分别采用透明塑料瓶和不透明塑料瓶包装,将两种包装处理后的花椒油分别放于4 ℃和25 ℃下进行保藏。3个月后测定样品的麻味强度及麻味物质含量。
1.3.2 麻味物质的提取
取30 g花椒油,按料液比1∶5(W/V)加入分析级甲醇。50 ℃水浴加热2 h,常温搅拌10 min,离心(3000 r/min,5 min)后取上清液,用旋转蒸发仪(50 ℃)浓缩至体积约为20 mL,得到麻味物质粗提物。将粗提物过碱性氧化铝层析柱,除去多酚类物质及部分色素,得到清液,经离心(4000 r/min,5 min)后,减压蒸干并计重,所得样品即为麻味物质提取物。
1.3.3 麻味物质的检测
参照文献[12]的方法。
1.3.3.1 标准曲线的绘制
以实验室自制的羟基-α-山椒素作为标准品,配制成不同浓度的标准溶液,采用高效液相色谱法进行检测。
以各浓度溶液吸收峰面积为纵坐标,浓度为横坐标,绘制标准曲线。得到标准曲线方程为y=198648x,R2=0.998,式中:x为麻味物质的质量浓度(μg/mL),y为270 nm下吸收峰的面积。
1.3.3.2 麻味物质含量的测定
取一定量的麻味物质粗提物,用甲醇溶解,使用0.22 μm滤膜过滤后进行HPLC检测,根据特征吸收峰面积对应标准曲线计算得到花椒油样品中麻味物质含量。
1.3.4 麻味强度的测定
1.3.4.1 测试者要求
召集2男2女测试员,20~25岁,身体健康,不吸烟,不酗酒,对麻味食品没有强烈嗜好性及排斥感。所有测试均在早餐后进行,测试前1 h内测试员不能进食。
1.3.4.2 Half-tongue 检验
参照Matthias Bader等[13]的方法。
数据处理:将每组样品中各个测试者的麻味阈值取平均值,用样品稀释倍数来表示麻味的大小,即麻味强度值。样品稀释倍数的计算公式如下:
1.3.4.3 唾液分泌实验
参照Lorenz K等[14]的方法。
数据处理:将不同测试者在同一测试阶段的唾液分泌量取平均值,以唾液分泌量为纵坐标,时间为横坐标,绘制唾液分泌曲线来表示唾液分泌量的变化。
2 结果与分析
2.1 初始花椒油样品中麻味物质含量测定结果
初始花椒油样品的液相色谱图见图1。
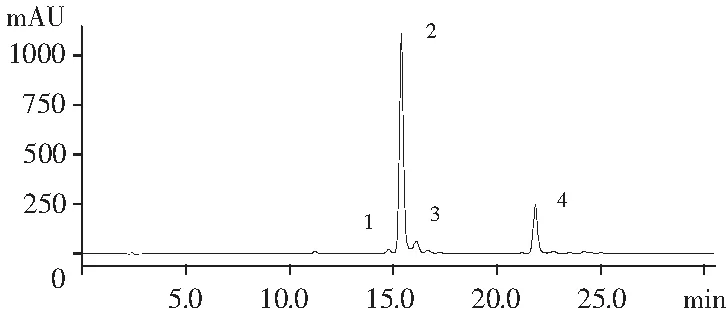
图1 初始花椒油样品中麻味物质HPLC图谱
前期研究中,课题组利用液相质谱联用仪对汉源花椒油麻味成分进行了检测。根据出峰时间、最大吸收峰和质荷比,对比参考文献[6],将花椒油中麻味物质及其相对含量进行了汇总。现将所得各物质的峰面积通过标准曲线换算出各物质的羟基-α-山椒素当量,具体结果见表1。

表1 初始花椒油样品中麻味物质定量分析结果
由表1可知,初始花椒油样品中各山椒素含量由高到低为羟基-α-山椒素、羟基-γ-山椒素、羟基-β-山椒素、羟基-ε-山椒素,以上4种特征麻味物质占到了提取物的92.47%,特征麻味物质含量为15.11 mg羟基-α-山椒素当量/g花椒油。
2.2 初始花椒油样品麻味强度测定结果
初始花椒油样品Half-tongue检验结果见表2,唾液分泌实验结果见图2。
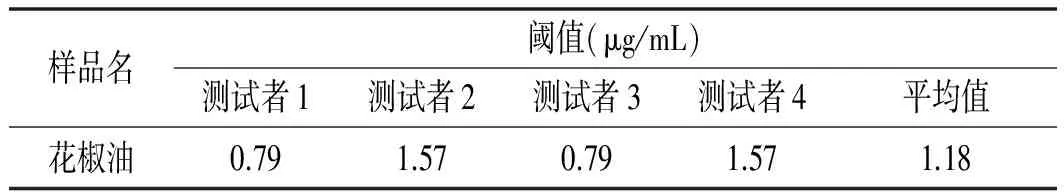
表2 初始花椒油样品Half-tongue检验结果
由表2可知,初始花椒油样品的麻味阈值为1.18 μg/mL。通过计算得到花椒油的麻味强度值为169.49。

图2 初始花椒油样品唾液分泌实验结果
由图2可知,花椒油在刺激时(t=15 s)唾液分泌量变化较少,在刺激后唾液分泌量上升明显,刺激后60 s时(t=75 s)达到最高值,唾液分泌量为0.68 g。
2.3 保藏3个月后花椒油样品麻味物质含量测定结果

表3 不同条件下保藏3个月后花椒油样品麻味物质含量测定结果
由表3可知,在不同条件下保藏3个月后,花椒油中麻味物质总量均有所降低,避光保藏优于透光保藏,4 ℃保藏优于25 ℃保藏。变化最明显的是采用透光包装、25 ℃保藏的样品,其麻味物质含量减少了27.60%。从单个山椒素含量来看,羟基-α-山椒素在保藏过程中含量不断降低,常温透光条件下下降最多。研究表明:羟基-α-山椒素在贮藏过程中容易发生异构化、水解以及氧化反应,在低温、酸性条件下较稳定。羟基-ε-山椒素、羟基-β-山椒素在保藏过程中麻味物质含量均升高,由于羟基-α-山椒素、羟基-β-山椒素与羟基-ε-山椒素互为同分异构体,相对分子量均为263。因此,该结果表明在花椒油贮藏过程中,3种同分异构体之间发生了转化,羟基-α-山椒素部分转化成羟基-β-山椒素与羟基-ε-山椒素。尤其在常温(25 ℃)、光照条件下,羟基-ε-山椒素与羟基-β-山椒素的含量升高显著,这也说明温度与光照对3种山椒素之间的转化具有促进作用。
2.4 保藏3个月后花椒油麻味强度的测定结果

图3 花椒油保藏3个月后麻味测定结果
花椒油初始麻味强度值为169.49。由图3可知,冷藏条件下花椒油的麻味强度未发生变化。在常温条件下,避光包装的花椒油麻味强度大于透光包装的花椒油,花椒油在光照下存放后麻味强度变化较大。常温保藏的花椒油麻味强度降低,透光包装的花椒油降低最明显,保藏3个月后麻味强度值为127.39,降低了24.84%。
由表3可知,羟基-α-山椒素在保藏过程中含量不断降低,羟基-ε-山椒素、羟基-β-山椒素相对含量都有所升高。Sugai E等[15]研究发现,不同麻味物质在人体中引起的麻味感觉不同,麻味阈值也不同。Matthias Bader等还发现,羟基-α-山椒素具有1个顺式双键及3~4个反式双键结构,被认为是麻味的主要贡献物,但是具有全反式结构的羟基-β-山椒素则不具有强烈刺激性,这也是贮藏后花椒油麻味降低的原因之一。需要进一步研究花椒油中麻味物质与麻味强度之间的构效关系。


图4 不同包装方式的花椒油唾液分泌实验
由图4可知,避光包装的花椒油在冷藏条件下的唾液分泌量峰值(0.72 g)高于常温条件(0.66 g),透光包装的花椒油在冷藏条件下唾液分泌量峰值(0.68 g)高于常温条件(0.61 g),唾液分泌实验结果与Half-tongue检验结果一致,说明花椒油在冷藏条件下麻味更稳定。

图5 不同包装方式的花椒油在常温保藏条件下唾液分泌实验
由图5可知,避光包装的花椒油唾液分泌量峰值(0.66 g)高于透光包装(0.61 g),与Half-tongue检验结果一致。因此,花椒油应采用避光包装或进行避光保存。
3 结论
贮藏3个月后,花椒油中麻味物质总量均有所下降,其中,避光、冷藏条件下麻味物质最稳定。在贮藏过程中,麻味物质单体与其同分异构体之间发生了相互转化,且由于不同麻味物质单体的结构差异,其表现出的麻味特性不同,使得花椒油的麻味强度变化并未与麻味物质含量变化相一致。研究表明花椒油麻味强度不仅与麻味物质的总量有关,还与麻味物质单体的结构有关,需要进一步研究整个贮藏过程中麻味物质的变化机理及其引起的味觉变化。
[1]Mizutani K,Fukunaga Y,Tanaka O,et al.Amides from huajiao,pericarps ofZanthoxylumbungeanumMaxim.[J].Chemical and Pharmaceutical Bulletin,1988,36:2362-2365.
[2]Kashiwada Y,Ito C,Katagiri H,et al.Amides of the fruit ofZanthoxylumspp.[J].Phytochemistry,1997,44(6):1125-1127.
[3]Yang X G.Aroma constituents and alkylamides of red and green huajiao (ZanthoxylumbungeanumandZanthoxylumschinifolium)[J].Journal of Agricultural and Food Chemistry,2008,56(5):1689-1696.
[4]宋莹莹.花椒贮藏过程中麻味物质含量降低机理的初步研究[D].重庆:西南大学,2014.
[5]赵志峰.汉源花椒风味物质研究及花椒油生产工艺优化[D].成都:四川大学,2005.
[6]Zhao Zhi-feng, Zhu Rui-xue,Zhong Kai,et al.Characterization and comparison of the pungent components in commercialZanthoxylumbungeanumoil andZanthoxylumschinifoliumoil[J].Journal of Food Science,2013,78(10):1516-1522.
[7]Iseli V,Potterat O,Hagmann L,et al.Characterization of the pungent principles and the essential oil ofZanthoxylumschinifoliumpericarp[J].Pharmazie,2007,62(5):396-400.
[8]赵志峰,祝瑞雪,高鸿,等.鲜花椒油和干花椒油麻味物质对比研究[J].中国调味品,2014,39(4):33-36.
[9]谢庆娟,邓才彬,曲中堂.GC-MS联用法分析花椒油化学成分[J].中国药房,2009(21):1653-1654.
[10]徐坤,孟晓,孙俊秀,等.花椒油抗氧化活性研究[J].中国调味品,2010,35(7):48-59.
[11]徐坤.花椒油抑菌效果探讨[J].中国调味品,2011,36(5):25-31.
[12]靳岳,刘福权,赵志峰,等.基于Half-tongue检验测定花椒麻味强度的研究[J].中国调味品,2016,41(6):80-83.
[13]Matthias Bader,Timo Stark,Thomas Hofmann,et al.All-trans-configuration inZanthoxylumalkylamidesswaps the tingling with a numbing sensation and diminishes salivation[J].Journal of Agricultural and Food Chemistry,2014,62(12):2479-2488.
[14]Lorenz K,Bader M,Klaus A,et al.Orosensory stimulation effects on human saliva proteome[J].Journal of Agricultural and Food Chemistry,2011,59(18):10219-10231.
[15]Sugai E,Morimitsu Y,Kubota K.Quantitative analysis of sanshool compounds in Japanese pepper (XanthoxylumpiperitumDC.) and their pungent characteristics[J].Bioscience,Biotechnology,and Biochemistry,2005,69(10):1958-1962.

