长期咸水灌溉对土壤酶活性及反应动力学的影响
翟红梅,曹彩云,刘孟雨
(1.中国科学院遗传与发育生物学研究所农业资源研究中心,中国科学院农业水资源重点实验室,河北省节水农业重点实验室, 河北 石家庄 050022;2.石家庄学院化工学院, 河北 石家庄 050035; 3.河北省农林科学院旱作农业研究所, 河北 衡水 053000)
淡水资源短缺已成为世界性问题[1],咸水灌溉越来越受到国内外学者的重视[2-4],但是咸水中的盐分会导致土壤质量下降[5-6],抑制植物的生长[7]。
土壤微生物与土壤质量的关系密切,其活性能够灵敏地反映土壤质量的变化[8]。有关盐分污染对土壤微生物的影响的研究很少,其中多数研究都是集中在自然形成的盐碱土[9],或者是设施栽培等条件引起的次生盐渍化[10]。一些研究者做了咸水灌溉的研究,集中在盆栽试验或者室内无植物培养土方面[11],田间长期咸水灌溉下土壤微生物如何响应还少见报道。由于土壤微生物是土壤酶的主要来源[12],所以通过测定土壤酶活性可以体现土壤微生物的活性和功能。
随着科学的进步,在土壤酶学研究上,人们不再片面强调土壤中反应的结果,而是转向既偏重结果、又重视该结果产生的过程。除了土壤水解酶的活性,它们的催化动力学特性也是表征土壤质量的重要量度[13]。酶动力学特性除了可以表示土壤中酶含量的高低,还能够反映酶与底物、与土壤有机-无机复合体等之间结合的紧密程度以及作用过程[14],因此被许多学者认为是理想的研究指标。在土壤酶催化动力学特征研究方面,国内外的一些学者做了一些工作[15-18],在咸水污染方面,还未见土壤酶动力学特征的研究报告。
本文选取了参与土壤碳、氮和磷循环的β-葡糖苷酶、脲酶和碱性磷酸酶为研究对象,研究长期咸水污染对其活性及动力学特征的影响,为评价长期咸水灌溉对土壤质量的影响提供依据。
1 材料与方法
1.1 研究区概况与试验设计
大田试验在河北省农林科学院旱作农业研究所节水农业试验站进行。该站地处华北平原低平原区,地理坐标为东经115°47′,北纬37°10′,海拔为21 m。多年平均气温12.8℃,多年平均年日照时数为2 509.4 h,无霜期平均188 d,降水主要集中在夏季(6—8月),平均降水量358.4 mm,占全年降水量的70%左右,多年平均蒸发量为1 785.4 mm。该区0~20 mm土壤为粉质粘壤土,主要种植夏玉米和冬小麦,属于一年两熟种植制度。
于2006年10月开始5个浓度1.25、 2.50、5.00、7.50 dS·m-1和10.00 dS·m-1(相当于1、2、4、6、8 g·L-1)长期咸水灌溉定位试验,地下水电导率为1.25 dS·m-1,其余4个浓度的咸水用地下水和氯化钠按比例配制而成。每个处理包括三次重复,小区面积为9.5 m×6.0 m,灌水次数依据天气情况而定,每个处理灌溉次数和灌溉量相同,冬小麦和夏玉米秸秆全部还田。
1.2 材料与方法
2014年5月4日在每个试验小区采集土样,采集深度为0~20 cm,20~40 cm,每个小区按对角线法五点取样,为避免小麦根际的影响,每个取样点设在行间,5个土样充分混合后为一个重复,剔除石砾和植物残根等杂物,土样过2 mm筛后放冰箱中,在4℃条件下储存备用。
土壤脲酶活性(μg NH4+·h-1·g-1)采用苯酚-次氯酸钠法测定,以单位时间内生成的铵离子作为衡量标准;β-葡糖苷酶和碱性磷酸酶活性(μ molp-nitrophenol h-1g-1)采用人工合成的对硝基苯衍生物作为酶促反应底物来测定其活性大小。土壤酶活性测定具体条件见表1。

表1 土壤酶测定时相关条件 Table 1 The methods used for soil enzyme activity assays
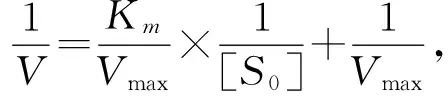
1.3 数据处理
不同处理间的差异用最小显著性差异法(LSD)进行统计检验,利用SPSS 13.0统计处理软件对实验数据进行方差分析。
2 结果与分析
2.1 长期咸水灌溉下不同土壤层土壤酶活性的变化
表2和表3分别显示了咸水灌溉对0~20 cm和20~40 cm土壤层脲酶、β-葡糖苷酶和碱性磷酸酶的活性的影响。从分析结果可以看出,咸水灌溉抑制了所有土壤水解酶的活性,同一土壤层中不同的土壤酶活性随着灌溉水盐分的增加所降低的程度不同。从表2的方差分析结果看,在0~20 cm土壤层中,脲酶活性对咸水灌溉的响应最灵敏,在5 dS·m-1咸水灌溉下即可引起其活性的显著下降。碱性磷酸酶活性受咸水的抑制程度最低,直到灌溉水为10 dS·m-1时,其活性才显著下降。与对照相比,10 dS·m-1的咸水灌溉时脲酶、β-葡糖苷酶和碱性磷酸酶分别下降45.5%、50.8%和24.9%。
对比表2和表3结果,可以看出相对于0~20 cm土层,三种土壤酶在20~40 cm土壤中的酶活性均降低。从方差结果分析,对比0~20 cm土壤层,咸水灌溉对20~40 cm土壤层的抑制程度均减弱,在10 dS·m-1咸水灌溉时脲酶和β-葡糖苷酶的活性才显著下降,而碱性磷酸酶的活性没有显著改变。与对照相比,在10 dS·m-1咸水灌溉下脲酶、β-葡糖苷酶和碱性磷酸酶分别下降37.4%、32.1%和21.8%。
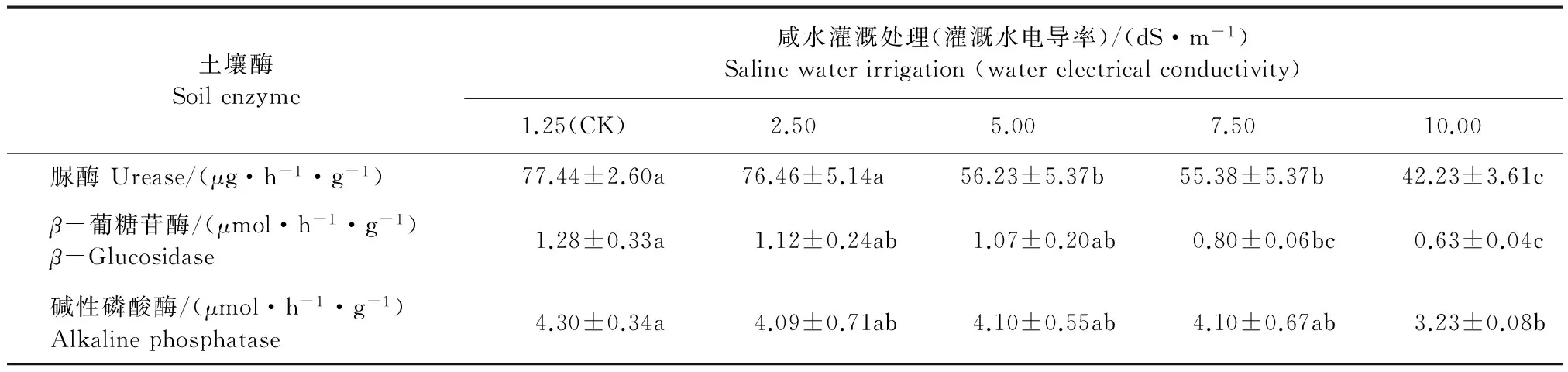
表2 长期咸水灌溉对0~20 cm土壤层土壤酶活性的影响 Table 2 The effect of long-term saline water irrigation on activities of 0~20 cm soil enzymes
注:数据为平均值,重复9次;同一行中不同字母代表不同处理用相同方法测定的结果有显著差异(P<0.05);下同。
Note: values are the mean of nine replicates; different letters in the same rows are significantly different atP<0.05; the same below.
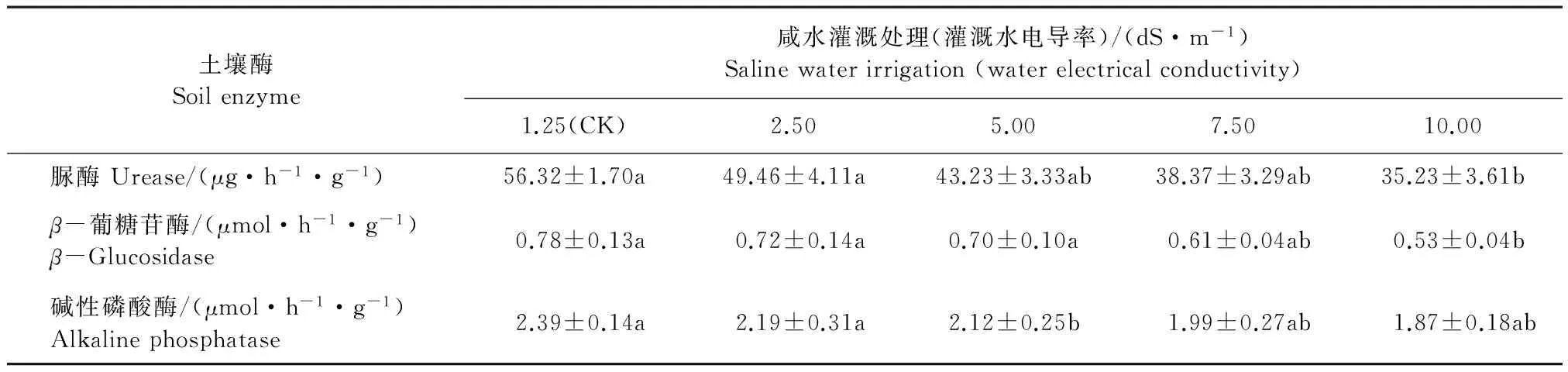
表3 长期咸水灌溉对20~40 cm土壤层土壤酶活性的影响 Table 3 The effect of long-term saline water irrigation on activities of 20~40 cm soil enzymes
2.2 长期咸水灌溉下土壤酶动力学的变化
鉴于以上研究结果,20~40 cm土层的土壤酶活性受到咸水灌溉的抑制程度较低,0~20 cm土壤层中三种土壤酶活性在10 dS·m-1咸水灌溉时下降明显,尤其是碱性磷酸酶只有在此处理下酶活性才有显著变化,因此本研究只选取了0~20 cm土壤层中的对照和10 dS·m-1咸水灌溉两个处理的土壤酶用于研究土壤酶动力学的变化。
2.2.1 底物浓度对酶促反应速度的影响 图1为不同灌溉条件下,底物浓度对脲酶、β-葡糖苷酶和碱性磷酸酶活性的影响。结果表明:对照和咸水处理下,脲酶、β-葡糖苷酶和碱性磷酸酶的酶促反应速度均随着底物浓度的增加而增大,并逐渐趋于最大反应速度(Vmax)。从图1的(A)和(B)可以看出,相对于对照,各个底物浓度下,咸水灌溉时的脲酶和β-葡糖苷酶活性都有所降低,并且降低的幅度随着底物浓度的增加而提高。从图1(C)看出,在底物浓度低时,咸水灌溉对碱性磷酸酶促反应速度并没有抑制作用,直到底物浓度超出0.5 mmol·L-1时才明显降低,随着底物浓度增加抑制作用加强,但是所受抑制程度低于脲酶和β-葡糖苷酶。
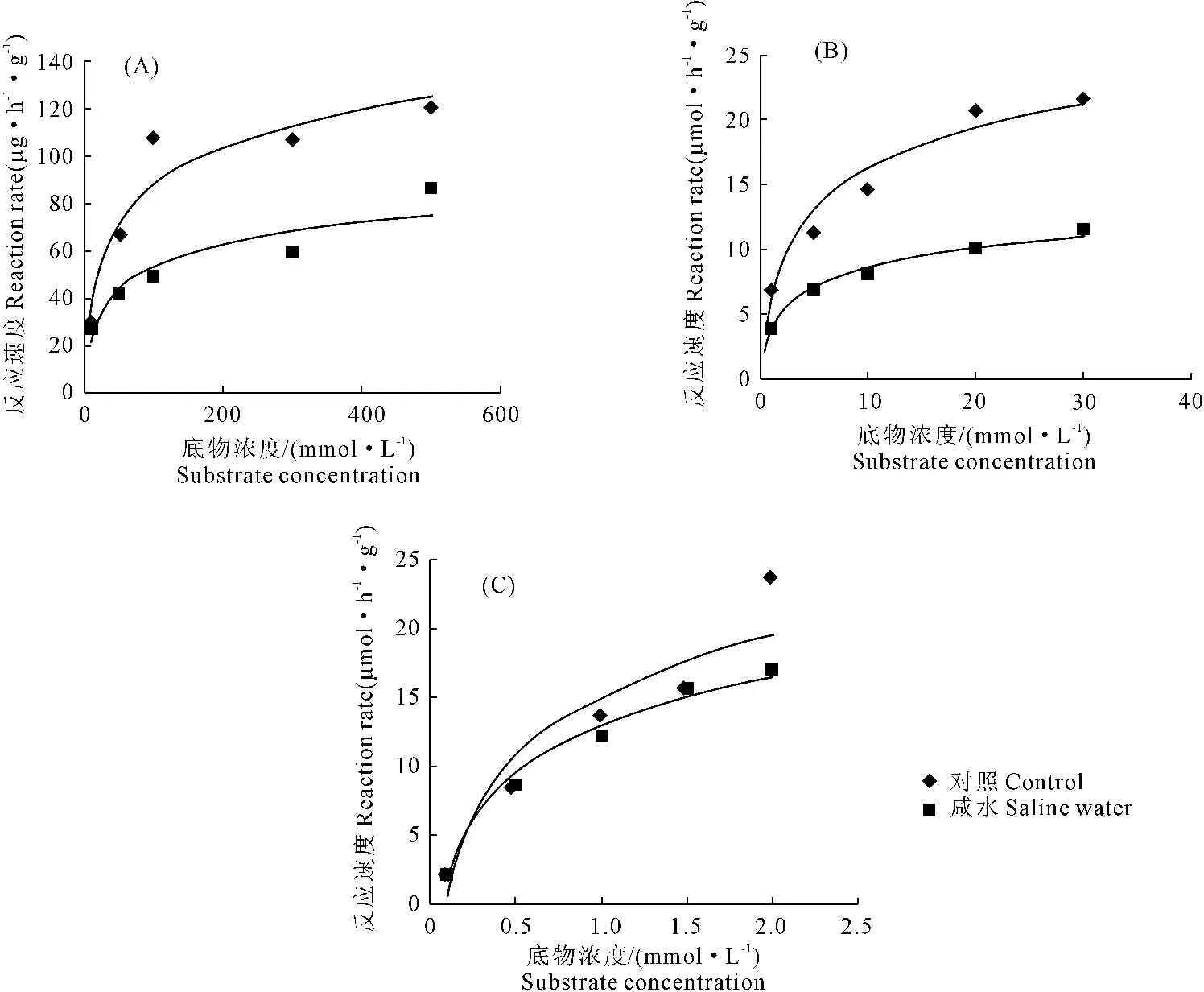
图1 长期咸水灌溉条件下土壤脲酶(A)、β-葡糖苷酶(B)和碱性磷酸酶(C)活性随底物浓度的变化
Fig.1 Variation of activities of soil urease (A),β-glucosidase (B) and alkaline phosphatase (C) with substrate content variation under long-term saline water irrigation
2.2.2 咸水灌溉对土壤酶动力学特征的影响 根据底物浓度和相对应的酶促反应速度计算得出的1/V和1/[S],并绘制双倒数曲线。三种土壤酶的双倒数曲线如图2所示,三种土壤酶得到的图形都为直线,即证明本研究中不同底物浓度下所得到的酶活性符合米氏方程的转换形式,从直线的截距可以得出不同土壤酶不同条件下的1/Vmax,直线的斜率即为Km/Vmax,从中可以看出,咸水灌溉对不同土壤酶的抑制作用机制不同,具体计算参数如表4所示。
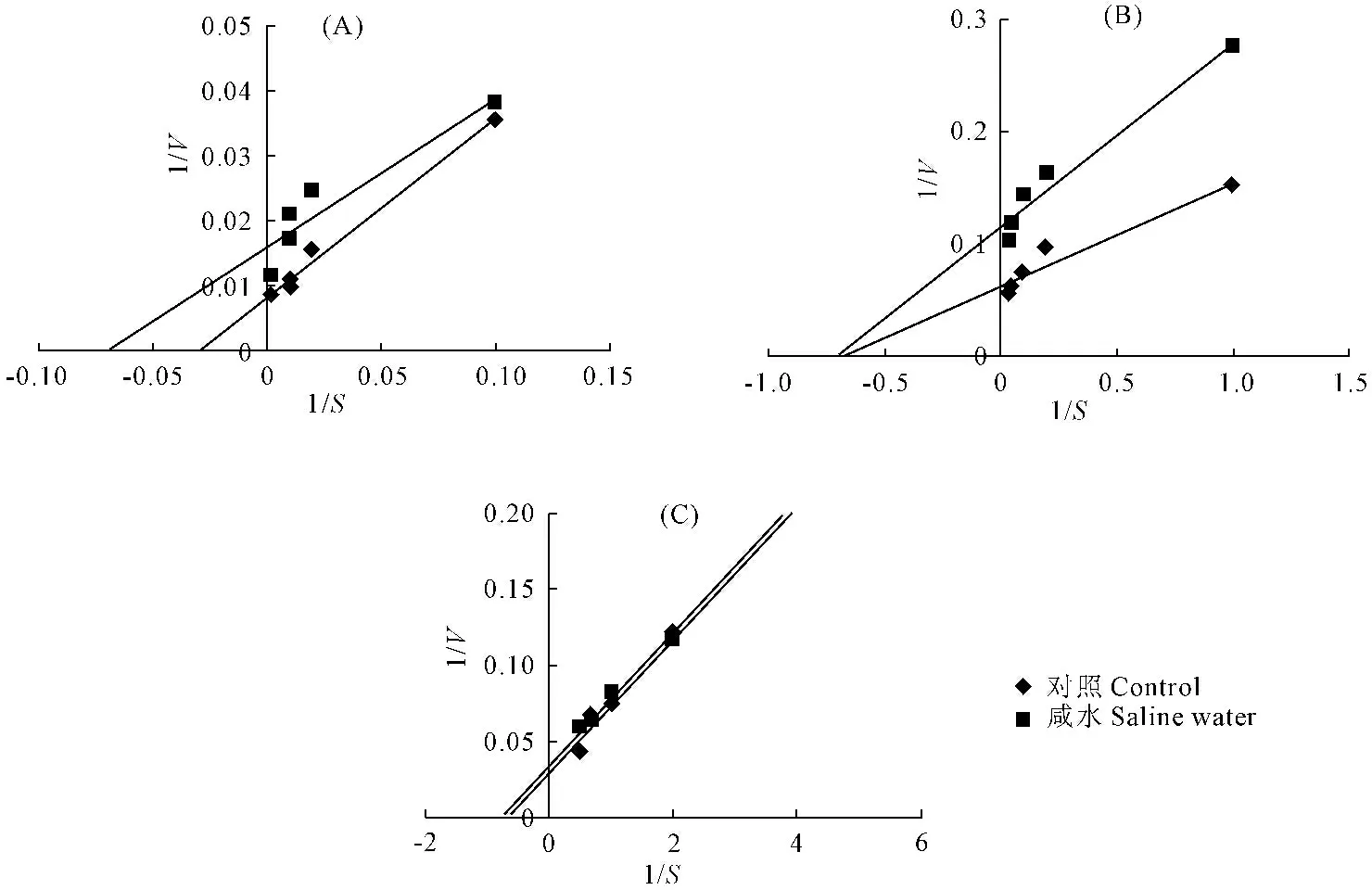
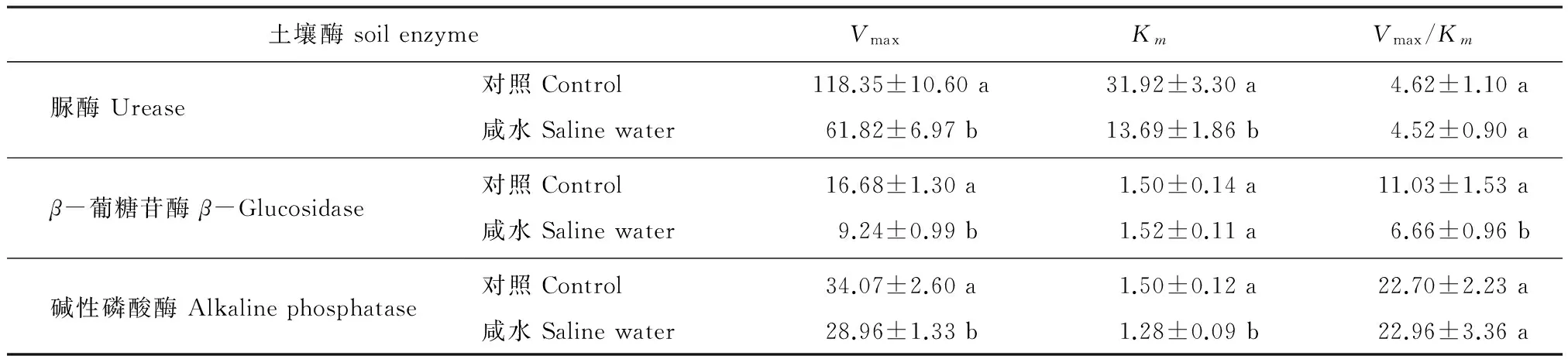
图2 长期咸水灌溉处理下土壤脲酶(A)、β-葡糖苷酶(B)碱性磷酸酶(C)Lineweaver-Burk图 Fig.2 Lineweaver-Burk plot of soil urease (A), β-glucosidase (B) and alkaline phosphatase (C) under long-term saline water irrigation表4 长期咸水灌溉对土壤脲酶、β-葡糖苷酶和碱性磷酸酶动力学参数的影响 Table 4 The effect of long-term saline water irrigation on kinetic parameters of soil urease, β-glucosidase and alkaline phosphatase
由表4结果可知,咸水灌溉对三种土壤酶的最大反应速度Vmax都有显著抑制作用,与对照相比,咸水灌溉条件下脲酶、β-葡糖苷酶和碱性磷酸酶的最大反应速度Vmax分别下降47.77%、44.62%和15.01%。咸水灌溉对三种土壤酶米氏常数Km的影响则不相同,相对于对照处理,咸水灌溉导致脲酶的Km下降57.12%,β-葡糖苷酶的Km不变,碱性磷酸酶的Km下降14.64%。咸水条件下β-葡糖苷酶的Vmax/Km下降39.63%,脲酶和碱性磷酸酶的Vmax/Km没有变化。
3 讨论与结论
3.1 土壤酶活性
3.1.1 咸水灌溉对土壤酶活性的影响 土壤元素循环与土壤酶紧密相关,盐胁迫是影响土壤酶活性的主要因素之一。本研究中脲酶、β-葡糖苷酶和碱性磷酸酶分别与土壤的氮、碳和磷循环密切相关,研究结果显示两个不同土壤层中的三种土壤酶活性都随着灌溉水盐分的增加而降低,这与以前的许多盐胁迫的研究结果一致。Eivazi[19]和Batra[20]发现次生盐碱土中不同种类的土壤酶活性都严重降低,并且影响到土壤的元素循环而不能正常的为植物提供营养。Frankenberger and Bingham[21]也曾经报道盐碱土中的脱氢酶、磷酸酶和β-葡糖苷酶等酶活性降低主要是与土壤的理化性质和微生物性质有关。土壤盐分的增加导致土壤酶活性下降,首先与土壤酶的来源有关系,盐分抑制和降低土壤中活性微生物种群的数量,微生物作为土壤酶的主要提供者受到咸水灌溉的胁迫,土壤酶合成量随之下降,但是,我们也可以看出即使在高浓度咸水灌溉条件下,土壤中仍然存在较高的土壤酶活性,Zahran[22]曾经指出耐盐型细菌所产生的土壤酶的活性要高于不耐盐型细菌所产生的相应土壤酶的活性。第二,植物根系也可以分泌土壤酶,根系分泌物和地上植物所输入的有机碳也为土壤酶提供营养,许多研究发现土壤有机碳与土壤酶活性均正向显著相关,所以咸水灌溉胁迫条件下植物生长受到显著抑制也是土壤酶活性下降的因素之一。第三,土壤酶活性下降还受到土壤盐分的直接影响,土壤酶的本质是蛋白质,高浓度盐分可抑制蛋白质的溶解,破坏蛋白的二级结构,造成蛋白质的变性失活而影响酶活性[23]。
3.1.2 不同土壤层土壤酶活性的变化 从表2和表3结果看出,三种土壤酶活性在20~40 cm土层均低于0~20 cm土层,其原因与上述分析有关,首先土壤表层的氧气有利于土壤微生物的生存代谢,下层土壤微生物活性降低导致土壤酶活性降低;第二,本实验每年收获时秸秆全部返田,致使下层土壤的有机碳比表层土壤低,也是土壤酶活性比较低的原因之一。从数据分析还可看出,比起表层土壤,咸水灌溉对下层土壤的抑制作用较弱,这与土壤的盐分有关,表层土壤的表面蒸发大,土壤盐分含量高,反之,下层土壤盐分含量较低。
由此可见,要想改善咸水灌溉导致的负面影响,可从以下方面考虑,第一利用含有活性微生物的生物肥料,提高微生物的数量;第二,增加易于利用的有机质含量较高的肥料;第三,在田间管理措施中,增加表层土壤的通气。
3.2 土壤酶动力学特征
底物浓度对三种土壤酶促反应速度的影响曲线都为双曲线,以前研究者在不同施肥对土壤酶动力学影响的研究中也得到类似结果[16]。在底物浓度较低时,反应速度几乎与底物浓度成正比,此时符合一级反应;当底物浓度继续增高时,反应速度虽然升高,但不显著;底物浓度达到一定限度时,反应速度则达到极大值,反应速度不再随着底物浓度的增加再升高,此时为零级反应。这种现象可以用中间产物学说解释,酶作用时先与底物结合成中间产物ES,再分解为产物P并游离出酶。在底物浓度很低时,每一瞬间,只有一部分酶与底物结合形成中间产物ES,此时若增加底物浓度,则有更多的ES生成,因而反应速度亦随之增加。但当底物浓度很大时,每一瞬时反应体系中的酶分子都已与底物结合生成ES,此时底物浓度再增加,但已无游离的酶与之结合,无更多的ES生成,因而反应速度几乎不变[24]。随着底物浓度的增加,咸水灌溉对反应速度的抑制作用增强,推测原因是由于咸水灌溉条件下土壤酶量减少,可以结合底物的酶减少,所以随着底物浓度的增加这种现象就愈加明显,说明咸水灌溉条件下,除了现有土壤酶的活性,土壤酶的合成量也受到盐分的抑制。
很多研究发现土壤酶的Vmax和Km对土壤管理措施的变化很敏感[18,25-26]。Vmax主要表征酶促反应形成产物的能力[27],与对照相比,咸水灌溉的Vmax值的降低,说明咸水灌溉条件下形成产物能力降低,再多的底物浓度也无法达到对照的反应活性。与营养循环相关的土壤酶的合成与土壤微生物的量和有机质密切相关[16],咸水灌溉导致土壤有机质含量和微生物量降低,土壤酶的量相应降低,此外盐离子还会导致蛋白质变性。
土壤酶动力学参数Km土壤酶和底物的结合能力,其值越小,亲和力越大[28],这种亲和力与酶量没有直接关系[14]。从三种酶Km变化来看,咸水灌溉引起的土壤环境变化,提高了脲酶和碱性磷酸酶与底物之间的结合能力,但对β-葡糖苷酶的底物结合能力没有影响。部分土壤酶与土壤中有机或者无机胶体的结合而受到保护,咸水灌溉引起土壤物理结构和化学性质的改变,改变土壤酶的存在状态,使得土壤酶游离出来,促进土壤酶与底物的结合。
Vmax/Km比值可以作为衡量酶催化能力的参数。土壤中的有机物质的化学特性可以影响酶在土壤中的稳定性,有研究表明Vmax/Km与土壤有机质含量有关[29]。本文中咸水灌溉只降低了β-葡糖苷酶的催化能力,对脲酶和碱性磷酸酶催化能力则没有影响。说明β-葡糖苷酶与土壤中有机质关系更加密切。咸水灌溉条件下有机质减少继而降低β-葡糖苷酶的催化能力,脲酶和碱性磷酸酶则比较稳定。
综上所述,咸水灌溉不同程度地降低了0~20 cm以及20~40 cm土壤脲酶、β-葡糖苷酶和碱性磷酸酶的活性,但是其抑制机制不完全相同。咸水灌溉下三种土壤酶形成产物的能力降低,脲酶、β-葡糖苷酶和碱性磷酸酶分别下降47.77%、44.62%和15.01%。咸水灌溉降低了β-葡糖苷酶的催化能力39.63%,但却促进了脲酶和碱性磷酸酶与底物之间的结合。以上分析进一步说明,在田间管理措施中,除了考虑提高土壤酶的活性,还应设法增加土壤酶的来源,提高土壤酶的合成量,从而增强形成产物的能力。
[1] Luterbacher J, Xoplaki E, Casty C, et al. Mediterranean Climate Variability Over the Last Centuries: A Review[M]. United Kingdom:Elsevier Science & Technology, 2006,4:27-148.
[2] 邢文刚,俞双恩,安文钰,等.春棚西瓜利用微成水滴灌与畦灌的应用研究[J].灌溉排水学报,2003,22(3):54-57.
[3] Murtaza G, Ghafoor A, Qadir M. Irrigation and soil management strategies for using saline-sodicwater in a cotton-wheat rotation[J]. Agricultural Water Management, 2006,81(3):98-114.
[4] Paranychianakis N V, Chartzoulalis K S. Irrigation of Mediterranean crops with saline water:from physiology to management practices[J]. Agriculture, Ecosystems and Environment,2005,106(4):171-187.
[5] 苏 莹,王全九,叶海燕,等.咸淡轮灌土壤水盐运移特征研究[J].灌溉排水学报,2005,24(1):50-53.
[6] Bannur E, Stephen B, Petra M. Response of microbial activity and biomass in rhizosphereand bulk soils to increasing salinity[J]. Plant Soil, 2014,381(5):297-306.
[7] Stevens R M, Partington D L. Grapevine recovery from saline irrigation was incomplete after four seasons of non-saline irrigation[J]. Agritural Water Management, 2013,122(5):39-45.
[8] Ebhin R, Chhonkar P, Singh D, et al. Changes in soil biological and biochemical characteristics in a long-term field trial on a sub-tropical inceptisol[J]. Soil Biology and Biochemistry,2006,38(7):1577-1582.
[9] Tripathi S, Kumari S, Chakraborty A, et al. Microbial biomass and its activities in salt-affected coastal soils[J]. Biology and Fertility of Soils, 2006,42(3):273-277.
[10] Egamberdieva D, Renella G, Wirth S, et al. Secondary salinity effects on soil microbial biomass[J]. Biology and Fertility of Soils, 2010,46(5):445-449.
[11] 张建锋,张旭东,周金星,等.盐分胁迫对杨树苗期生长和土壤酶活性的影响[J].应用生态学报,2005,16(3):426-430.
[12] Caldwell B A, Griffiths R P, Sollins P. Soil enzyme response to vegetation disturbance in two lowland Costa Rican soils[J]. Soil Biology and Biochemistry, 1999,31(12):1603-1608.
[13] Marx M C, Wood M, Jarvis S C. A microplate fluorometric assay for the studyof enzyme diversity in soils[J]. Soil Biology and Biochemistry,2001,33(10):1633-1640.
[14] Zhan Y L, Chen L J, Sun C X. Soil hydrolase activities and kinetic properties as affected by wheat cropping systems of Northeastern China[J]. Plant soil and Environment, 2010,56(11):526-532.
[15] 李昌满,王贵学,王慧超,等.灰棕紫泥土脲酶动力学及反应条件研究[J].土壤通报,2010,41(1):68-71.
[16] 马星竹,陈利军,武志杰,等.长期施肥土壤β-葡糖苷酶动力学特性研究[J].浙江大学学报:农业与生命科学版,2008,34(5):546-551.
[17] Masciandaro G, Ceccanti B, Ronchi V, et al. Kinetic parameters of dehydrogenase in the assessment of the response of soil to vermicompost and inorganic fertilisers[J]. Biology and Fertility of Soils, 2000,32(6):479-483.
[18] Banafshe K, Farshid N, Nafiseh N, et al. Diversity of soil cellulase isoenzymes is associated with soil cellulasekinetic and thermodynamic parameters[J]. Soil Biology and Biochemistry,2011,43(4):1639-1648.
[19] Eivazi F, Tabatabai M. Glucosidases and galactosidases in soils[J]. Soil Biology and Biochemistry, 1988,20(5):601-606.
[20] Batra L, Manna M. Dehydrogenase activity and microbial biomass carbon in salt affected soils of semiarid and arid regions[J]. Arid Land Research and Management, 1997,11(3):295-303.
[21] Frankenberger W, Bingham F. Influence of salinity on soil enzyme activities[J]. Soil Science Society of America Journal, 1982,46(6):1173-1177.
[22] Zahran H. Diversity, adaptation and activity of the bacterial flora in saline environments[J]. Biology and Fertility of Soils, 1997,25(3):211-223.
[23] Yuan B C, Xu X G, Li Z Z, et al. Microbial biomass and activity in alkalized magnesic soils under arid conditions[J]. Soil Biology and Biochemistry, 2007,39(12):3004-3013.
[24] Knight T R, Dick R P. Differentiating microbial and stabilizedβ-glucosidase activity relative to soil quality[J]. Soil Biology and Biochemistry,2004,36(12):2089-2096.
[25] Xie C S, Lu R J, Huang Y. Effects of ions and phosphates on alkaline phosphataseactivityin aerobic activated sludge system[J]. Bioresource Technology, 2010,101(1):3394-3399.
[26] Moscatelli M C, Lagomarsinob A, Garzilloc A M V. β-Glucosidase kinetic parameters asindi cators of soil quality under conventionaland organic cropping systems applying two analytical approaches[J]. Ecological Indicators, 2012,13 (6):322-327.
[27] Rao M A, Gianfreda L, Cristofaro A, et al. Kinetic behavior of synthetic organo and organo-mineral-urease complexes[J]. Soil Science Society of America Journal, 1995,59(3):811-815.
[28] Saeed H, Farshid N. Effect of cow manure and sewage sludge on the activityand kinetics of L-glutaminase in soil[J]. Biology and Fertility of Soils, 2007,43(10):491-494.
[29] Zaman M, Di H J, Cameron K C. A field study of gross of N mineralization and nitrification and their relationships to microbial biomass and enzyme activities in soils treated with dairy effluent an ammonium fertilizer[J]. Soil Use and Management, 1999,15(3):188-194.

