过表达BDNF基因重组慢病毒转染MSCs的实验研究
任瑞芳 赵 君 贵永堃 闫海清 王昊亮 王桂华 张 平△
1)新乡医学院第一附属医院神经内科 河南省神经修复重点实验室,河南 卫辉 453100 2)新乡医学院第二附属医院神经内科,河南 新乡 453000
骨髓间充质干细胞(bone marrow mesenchymal stem cells,MSCs)是1987年FRIEDENSTEIN等[1]在塑料培养皿中发现的一类贴壁单核细胞。该类细胞是存在于骨髓中的非造血干细胞,来源于中胚层。其取材方便,易于培养、纯化和扩增,某种特定环境中会向脂肪、骨、心肌、血管内皮细胞等方向分化,还可跨胚层分化为内胚层的肝细胞、肺泡上皮细胞以及外胚层的神经细胞等[2-5]。其低免疫源性、迁移性、组织融合性及较强的自我更新能力使该类细胞成为目前公认的组织修复及再生的种子细胞,也是良好的基因治疗载体[6]。另外MSCs分泌的脑源性神经生长因子(Brain-derived neurotrophic factor,BDNF)在脑发育过程中发挥着重要作用,是哺乳类动物脑内分布最广、含量最高的一种神经营养因子,也是神经系统中重要的调节蛋白,可以通过受体信号传导系统激活生存信号、失活死亡信号,启动分化机制,减少神经细胞凋亡,诱导内源性细胞增生,从而促进神经元存活、轴突生长,提高突触可塑性、产生神经递质[7-9]。大量实验[10-13]表明,MSCs及BDNF在各类神经损伤的临床前动物实验中都能产生积极的治疗作用。但BDNF 属于大分子物质,不能通过血脑屏障,且在体内半衰期很短,直接注射于颅内不能持续发挥营养、保护和修复神经的作用。要想将BDNF基因导入到MSCs,需要选择合适的载体,该基因载体不仅要能携带较大容量的碱基(BDNF),得到较多的基因载体扩增数量,还要能高效转染MSCs,并保持良好的增殖能力和向神经元细胞诱导分化的能力[14],使得BDNF基因可以整合到宿主细胞中,随着MSCs的扩增而扩增。慢病毒载体则是目前符合要求的理想整合病毒载体[15-16]。增强型绿色荧光蛋白(enchanted green fluoreseent protein,EGFP)可以持续、重复、有效监测治疗基因的转染效率、表达时间,指导基因治疗方案的优化、评价治疗效果,并可准确监测干细胞在体内的归巢、分化及功能表达的整个动态过程[17]。因此本课题组将合成的BDNF基因克隆到EGFP载体上,构建了MSCs-EGFP-BDNF重组慢病毒,通过转基因技术持续过表达BDNF,为治疗神经损伤的体内研究奠定基础、提供方向。
1 实验材料与方法
1.1主要实验材料、试剂及动物雄性SD大鼠,体质量250~300 g。低糖培养基(L-DMEM)、胎牛血清、胰蛋白酶(Hyclone公司,美国);增强型绿色荧光蛋白(EGFP)、脑源性神经营养因子基因重组慢病毒 (BDNF-EGFP-LV)、空载体慢病毒(EGFP-LV)(上海吉凯公司,中国);Trizol试剂盒、逆转录试剂盒、Real-Time PCR试剂盒(大连宝生物工程有限公司,中国);二喹啉甲酸蛋白浓度测定试剂盒(上海捷瑞生物工程有限公司,中国);BDNF兔抗大鼠多克隆抗体(北京博奥森生物技术有限公司,中国)。
1.2主要实验仪器超净工作台(苏州净化设备有限公司,中国)、CO2培养箱(Thermo公司,美国)、 -80 ℃超低温冰箱(Forma Scientic,德国)、光学显微镜(Nikon公司,日本)、奥德赛双色荧光成像仪(LI-COR公司,美国)。
1.3实验方法
1.3.1 MSCs的分离、培养:6周龄SD雄性大鼠,断颈处死后无菌条件下取股骨、胫骨,超净工作台内剪开骨髓腔,磷酸盐缓冲液(PBS)冲出骨髓,1 000 r/min 离心5 min,将离出的细胞加入含10% 胎牛血清的L-DMEM 培养基中,置于37 ℃、5% CO2培养箱中松口培养。24 h半换液、后每48 h全换液,待细胞70%~80%融合后消化传代。
1.3.2 MSCs的鉴定:取三组3代MSCs,消化离心后制成约5×105个MSCs悬液200 μL。随机选其中一组细胞加入大鼠IgG-FITC、IgG-PE各5 μL,后将大鼠CD29-FITC、CD45-PE各5 μL加入第二组细胞,CD90-PE 5 μL加入最后一组细胞,混匀、避光作用25 min。将每组细胞制成2 mLPBS悬液,震荡、离心后加入2%多聚甲醛200 μL固定,流式细胞仪鉴定。
1.3.3 慢病毒载体转染MSCs:将1×104个3代MSCs接种于96孔板内,按10~100等不同转染复数(multiplicity of infection,MOI)加入BDNF-EGFP-LV和EGFP-LV。培养8~12 h后更换培养基。72~96 h观察细胞内EGFP的荧光表达情况。分别收集5×105个上述2组病毒细胞及一组单纯细胞,流式细胞仪检测转染率。
1.3.4 RT-PCR检测BDNF的基因表达:分别于转染前及转染后24 h、3 d、5 d、7 d、10 d、14 d收集MSCs组、MSCs-EGFP组、MSCs-EGFP-BDNF组5×105个细胞,离心、沉淀细胞。Trizol试剂盒提取总RNA,测A值,调整统一浓度逆转录cDNA,RT-PCR定量检测各组细胞不同时间点BDNF表达量。每组重复3次,取平均值。BDNF扩增引物为:上游:5’-GATGCCAGTTGCTTTGTCTTC-3’;下游:5’-TAAAATCTCGTCTCCCCAACA-3’。扩增片段大小为193 bp。甘油醛-3-磷酸脱氢酶(GAPDH)扩增引物为:上游5’-ACAGCAACAGGGTGGTGGAC-3’;下游5’-TTTGAGGGTGCAGCGAACTT-3’。扩增片段大小为252 bp。
1.3.5 Westen blot检测BDNF的蛋白表达:分别提取MSCs组、MSCs-EGFP组、MSCs-EGFP-BDNF组细胞蛋白并测浓度,制A、B工作液后稀释蛋白。配胶、上样、电泳、转膜、封闭、洗膜后加一抗4 ℃过夜。第2天洗膜、二抗避光孵育2 h后奥德赛双色荧光成像仪扫描蛋白印迹。
1.3.6 细胞爬片荧光三标BDNF蛋白表达:将MSCs接种于无菌玻片上,分别用DAPI标记及BDNF-EGFP-LV和EGFP-LV转染MSCs。待48~72 h后取出玻片,多聚甲醛固定,加一抗(BDNF兔抗大鼠 1:100),4 ℃孵育24 h,避光状态下荧光二抗(羊抗兔1:200)常温孵育1 h,抗荧光衰减封片剂封固镜检。
2 结果
2.1镜下观察MSCs 全骨髓细胞于L-DMEM培养液中呈密集均匀一致的圆形、椭圆形,24 h后可有少量细胞贴壁,48 h后部分贴壁细胞逐渐变为多角形、短棒或短梭形,4~6 d后变为长梭形,后逐渐扩增、交联成集落样分布。7~8 d后多呈均匀一致长梭形(图 1)。
2.2 MSCs鉴定及慢病毒转染效果流式细胞仪检测本实验培养的第3代MSCs:CD90、CD29阳性率分别为98.09%、95.17%,CD45为6.33%。提示本实验贴壁筛选的细胞符合MSCs的表型特征,且纯度较高(图2)。慢病毒转染72 h后可见大量细胞显示绿色荧光(图3)。转染复数为50时流式细胞仪测定BDNF-EGFP-LV转染率95.23%、EGFP-LV转染率96.08%、对照组为2.29%(图4)。

图2 流式细胞检测本实验培养细胞90%以上表达CD90、CD29,极少量CD45阳性
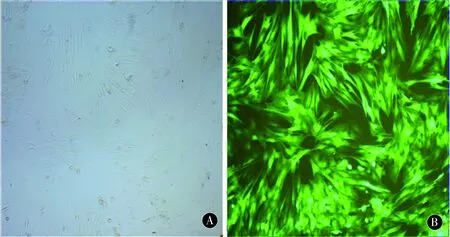
图3 A、B为慢病毒转染的MSCs自然光与荧光对比(×100)

图4 流式细胞术检测慢病毒转染MSCs
2.3 RT-PCR检测各组BDNF基因表达结果MSCs-EGFP-BDNF组BDNF的mRNA表达明显高于MSCs组和MSCs-EGFP组(P<0.05),而MSCs组与MSCs-EGFP组比较差异无统计学意义。MSCs-EGFP-BDNF组不同时间点测定3 d时表达最高(P<0.05)(图5)。
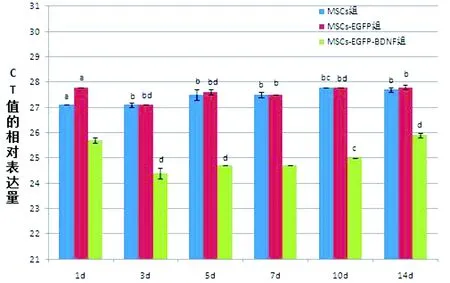
注:与MSCs-EGFP-BDNF组同一时间点比较,aP<0.05,bP<0.01;与本组前一时间点比较,cP<0.01,dP<0.05图5 RT-PCR检测各组细胞不同时间点BDNF表达的比较
2.4 Westen blot检测各组BDNF蛋白表达结果MSCs-EGFP-BDNF组蛋白表达较其他2组明显增多(P<0.05),MSCs组和MSCs-EGFP组也可检测到BDNF表达,但差异无统计学意义(图6)。据2-△△CT法统计结果显示转基因慢病毒MSCs高表达BDNF蛋白,相对空白细胞升高6.6倍。
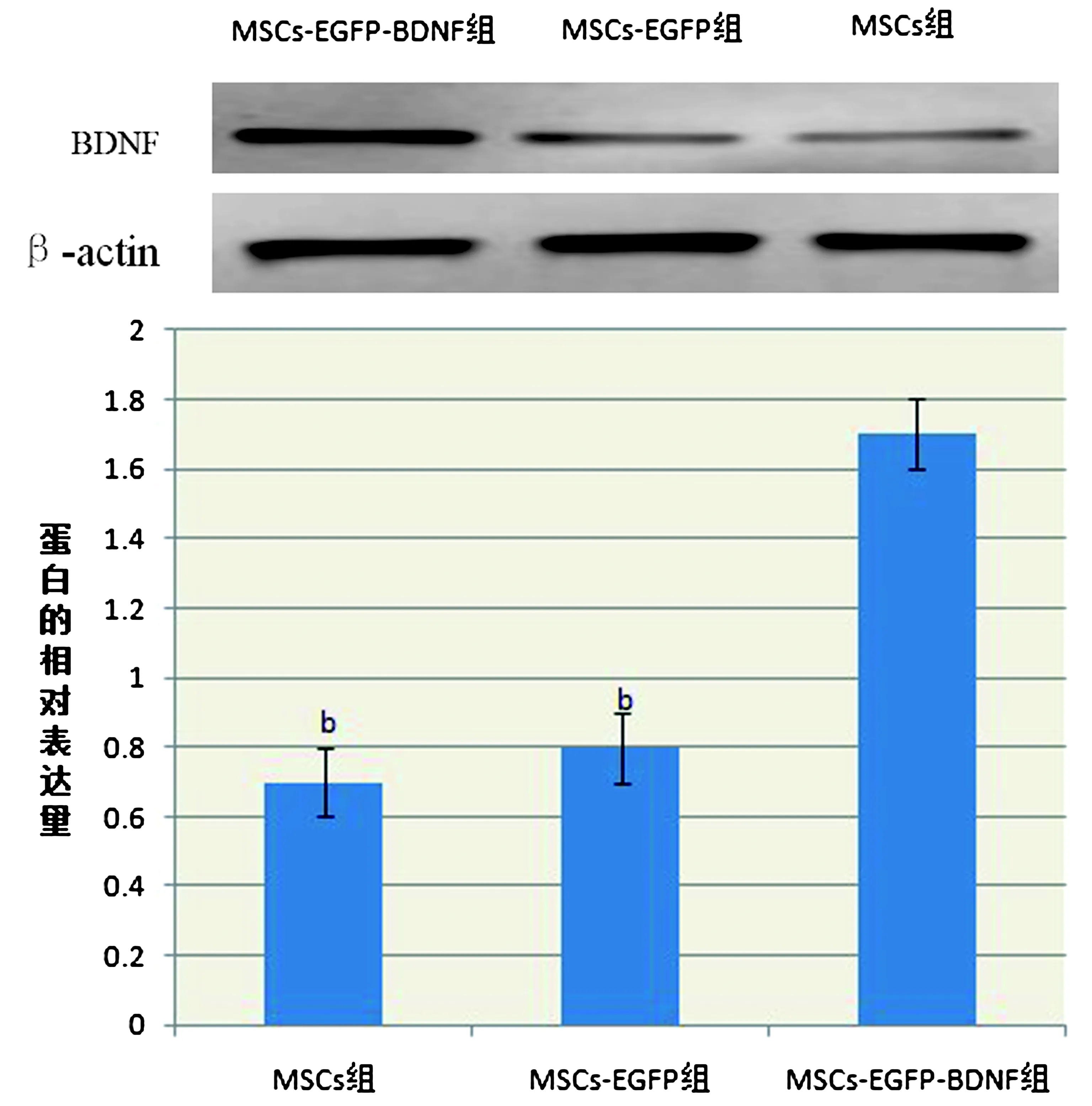
图6 Westen blot检测各组BDNF蛋白表达
2.5镜下对比细胞内免疫荧光三标BDNF蛋白表达DAPI及病毒转染的MSCs经免疫荧光三标后,荧光显微镜下可见MSCs-EGFP-BDNF组胞浆中BDNF的荧光蛋白表达明显多于单纯MSCs组及MSCs-EGFP组(图7)。

A:DAPI的荧光表达(蓝色);B:EGFP的荧光表达(绿色);C:BDNF的荧光表达(红色);D:三种荧光的原位叠加图7 免疫荧光BDNF的蛋白表达(×200)
3 讨论
BDNF是1982 年由德国神经化学家Barde 等[18]首先从猪脑中分离纯化的一种生物活性蛋白质,是神经营养因子家族中的一员。主要分布于中枢神经系统中,能够为神经元提供强大的营养支持,可促进轴突再生、调节突触传递,并减少神经元凋亡、促进神经修复和重建[10,19-20]。那么我们如何才能更好的利用BDNF的优势呢?这就需要我们寻找合适的载体来携带BDNF基因。
MSCs易被外源基因转染,能高效表达外源性基因,转染后亦能长期保持本身生物学特点。其低免疫源性无移植排斥反应等特性可以自身移植、没有医学伦理障碍[21-22]。并且MSC容易获取和培养扩增,具有潜在分化为神经元细胞的能力,具有细胞替代治疗的作用。被认为是最有临床治疗前景的干细胞之一。目前已被用于多种神经系统疾病的研究[23-28]。由于MSCs是一个异质细胞群,缺乏表面特异性的标志物,因此对其鉴定往往采用多种方法结合使用,例如从形态学观察、检测细胞表面特异抗原以及定向诱导分化等技术。本实验选用幼年SD大鼠骨髓,采用贴壁筛选法分离培养细胞。全骨髓细胞24 h即可见少量细胞贴壁生长,4~6 d 时呈对数生长,由多角、短梭形长为长梭形,后逐渐扩散、交联成集落样分布,且折光性变强。7 d达平台期,传代后可见均匀一致长梭状,此方法获得的细胞生长良好且增殖快。国际细胞治疗学会指出[29-30]MSCs 的表面特异抗原为:CD73、CD90、CD105、CD29、CD106、CD146等表达阳性,而CD45、CD34、CD79α、CD19阴性[24]。本实验流式细胞鉴定结果显示九成以上CD90、CD29阳性,极少量表达CD45。提示我们的细胞符合MSCs的表型特征,且纯度较高。
另外本实验将携带有BDNF的慢病毒转染MSCs,经流式细胞仪检测其转染效率高达95%以上,且RT-PCR检测转基因MSCs持续高表达BDNF,Western Blot及细胞爬片免疫荧光三标显示MSCs-EGFP-BDNF组较其他2组BDNF蛋白表达明显增多(P<0.05),据2-△△CT统计结果显示转基因MSCs相对于空白细胞BDNF的蛋白表达升高6.6倍,进一步证实RT-PCR结果,且BDNF在MSCs内转录并能翻译合成蛋白。为评估转基因干细胞进入体内后的归巢、分化、功能表达以及外源基因的作用部位和持续时间奠定了基础,提供了一种新的定位、定量示踪转基因干细胞的方法。
[1] FRIEDENSTEIN A J,CHAILAKHYAN R K,GERASIMOV U V.Bone marrow osteogenic stem cells:in vitro cultivation and transplantation in diffusion chambers[J].Cell Tissue Kinet,1987,20(3):263-272.
[2] FERNANDEZ V V B,ROMANIUK M A,CHOI H,et al.Mesenchymal stem cells and their use in therapy:what has been achieved[J].Differentiation,2013,85(1-2):1-10.
[3] ISKANDAR M E,CIPRIANO A F,LOCK J,et al.Improved bone marrow stromal cell adhesion on micropatterned titanium surfaces[J].Conf Proc IEEE Eng Med Biol Soc,2012,2012:5 666-5 669.
[4] LEE J,BAEK J H,CHOI K S,et al.Cyclin-dependent kinase 4 signaling acts as a molecular switch between syngenic differentiation and neural transdifferentiation in human mesenchymal stem cells[J].Cell Cycle,2013,12(3):442-451.
[5] SALGADO A J,SOUSA J C,COSTA B M,et al.Mesenchymal stem cells secretome as a modulator of the neurogenic niche:basic insights and therapeutic opportuni-ties[J].Front Cell Neurosci,2015,9:249.
[6] YILMAZ G,ALEXANDER J S,ERKURAN Y C,et al.Induction of neuro-protective/regenerative genes in stem cells infiltrating post-ischemic brain tissue[J].Exp Transl Stroke Med,2010,2(1):11.
[7] MARKHAM A,BAINS R,FRANKLIN P,et al.Changes in mitochondrial function are pivotal in neurodegenerative and psychiatric disorders:how important is BDNF[J].Br J Pharmacol,2014,171(8):2 206-2 229.
[8] GOMES C,SMITH S C,YOUSSEF M N,et al.RNA polymer-ase 1-driven transcription as a mediator of BDNF-induced neurite outgrowth[J].J Biol Chem,2011,286(6):4 357-4 363.
[9] CHEN B Y,WANG X,WANG Z Y,et al.Brain-derived neurotrophic factor stimulates proliferation and differentiation of neural stem cells,possibly by triggering the Wnt/beta-catenin signaling pathway[J].J Neurosci Res,2013,91(1):30-41.
[10] JEONG C H,KIM S M,LIM J Y,et al.Mesenchymal stem cells expressing brain-derived neurotrophic factor enhance endogenous neurogenesis in an ischemic stroke model[J].Biomed Res Int,2014,2014:129145.
[11] SHARMA A D,BRODSKIY P A,PETERSEN E M,et al.High throughput characterization of adult stem cells engineered for delivery of therapeutic factors for neuroprotective strategies[J].J Vis Exp,2015,(95):e52 242.
[12] SONG M S,LEARMAN C R,AHN K C,et al.In vitro valida-tion of effects of BDNF-expressing mesenchymal stem cells on neurodegeneration in primary cultured neurons of APP/PS1 mice[J].Neuroscience,2015,307:37-50.
[13] TANNA T,SACHAN V.Mesenchymal stem cells:potential in treatment of neurodegenerative diseases[J].Curr Stem Cell Res Ther,2014,9(6):513-521.
[14] HAN Z M,HUANG H M,WANG F F.Brain-derived neurotrophic factor gene-modified bone marrow mesenchy-mal stem cells[J].Exp Ther Med,2015,9(2):519-522.
[15] LI L,LI B,ZHANG H,et al.Lentiviral vector-mediated PAX6 overexpression promotes growth and inhibits apoptosis of human retinoblastoma cells[J].Invest Ophthalmol Vis Sci,2011,52(11):8 393-8 400.
[16] NASRI M,KARIMI A,ALLAHBAKHSHIAN F M.Production,purification and titration of a lentivirus-based vector for gene delivery purposes[J].Cytotechnology,2014,66(6):1 031-1 038.
[17] SUN X Z,LIU G H,WANG Z Q,et al.Over-expression of VEGF165 in the adipose tissue-derived stem cells via the lentiviral vector[J].Chin Med J (Engl),2011,124(19):3 093-3 097.
[18] BARDE Y A,EDGAR D,THOENEN H.Purification of a new neurotrophic factor frommammalian brain[J].EMBO J,1982,1(5):549-553.
[19] SHARMA A D,BRODSKIY P A,PETERSEN E M,et al.High throughput characterization of adult stem cells engineered for delivery of therapeutic factors for neuroprotective strategies[J].J Vis Exp,2015(95):e52242.
[20] SYGNECKA K,HEIDER A,SCHERF N,et al.Mesenchymal stem cells support neuronal fiber growth in an organotypic brain slice co-culture model[J].Stem Cells Dev,2015,24(7):824-835.
[21] DE MIGUEL M P,FUENTES-JULIAN S,BLAZQUEZ- MARTINEZ A,et al.Immunosuppressive properties of mesenchymal stem cells:advances and applications[J].Curr Mol Med,2012,12(5):574-591.
[22] SOLEYMANINEJADIAN E,PRAMANIK K,SAMADIAN E.Immunomodulatory properties of mesenchy-mal stem cells:cytokines and factors[J].Am J Reprod Immunol,2012,67(1):1-8.
[23] KHALILI M A,SADEGHIAN-NODOUSHAN F,FESAHAT F,et al.Mesenchymal stem cells improved the ultrastructural morphology of cerebral tissues after subarachnoid hemorrhage in rats[J].Exp Neurobiol,2014,23(1):77-85.
[24] LIU W,LU G,WANG B,et al.Transfection of BDNF gene promotes bone mesenchymal stem cells to differentiate into neuron-like cells[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2012,37(5):441-446.
[25] ZHOU S.From bone to brain:human skeletal stem cell therapy for stroke[J].Cent Nerv Syst Agents Med Chem,2011,11(2):157-163.
[26] CUI X,CHEN L,REN Y,et al.Genetic modification of mesenchymal stem cells in spinal cord injury repair strategies[J].Biosci Trends,2013,7(5):202-208.
[27] VAN VELTHOVEN C T,BRACCIOLI L,WILLEMEN H L,et al.Therapeutic potential of genetically modified mesenchymal stem cells after neonatal hypoxic-ischemic brain damage[J].Mol Ther,2014,22(3):645-654.
[28] ZAMINY A,SHOKRGOZAR M A,SADEGHI Y,et al.Mesenchymal stem cells as an alternative for Schwann cells in rat spinal cord injury[J].Iran Biomed J,2013,17(3):113-122.
[29] BAYATI V,HASHEMITABAR M,GAZOR R,et al.Expression of surface markers and myogenic potential of rat bone marrow-and adipose-derived stem cells:a comparative study[J].Anat Cell Biol,2013,46(2):113-121.
[30] TAN S L,AHMAD T S,SELVARATNAM L,et al.Isolation,characterization and the multi-lineage differentiation potential of rabbit bone marrow-derived mesenchymal stem cells[J].J Anat,2013,222(4):437-450.
(收稿2017-10-23 修回2018-01-01)

