紫苏脂肪酸去饱和酶基因PfFAD2的生物信息学及表达特性分析
梁 倩,李 璐,安 茜,周雅莉,王计平
(山西农业大学农学院,山西太谷 030801)
紫苏(Perilla frutescens(L.)Britt.)是双子叶 1 年生草本植物,是国家卫生部第1批颁发的药食两用的中药植物之一,种子油富含α-亚麻酸[1-2]。目前,紫苏被认为是一种新型油料作物。
在植物油脂合成过程中,脂肪酸去饱和酶基因FAD2是定位于内质网上的Δ12油酸去饱和酶[3],是产生多不饱和脂肪酸的关键酶基因,调控亚油酸和亚麻酸2种脂肪酸的合成,同时也用来调控植物细胞中大多数不饱和脂肪酸的合成,其催化产物及其衍生物对植物的生长发育具有重要作用。油酸是植物油脂中主要的单不饱和脂肪酸,在脂肪酸脱氢酶(FAD2)催化下形成亚油酸,而亚油酸是人体所必需的脂肪酸。研究表明,当儿童缺乏亚油酸时,会出现发育迟缓和湿疹皮炎等症状;当成人缺乏亚油酸时,会出现磷状皮屑、脱发和伤口难以愈合等症状[4-5]。FAD2是催化多不饱和脂肪酸生物合成的第1步反应[6],在植物种子中,其表达量的多少决定着亚油酸含量的多少。所以,脂肪酸去饱和酶FAD2在不饱和脂肪酸的合成过程中发挥重要作用。
本研究对紫苏FAD2基因进行了详细的生物信息学分析,并分析了该基因在晋紫苏1号不同组织及不同发育时期种子中的表达特性,旨在为进一步阐明紫苏FAD2基因在脂肪酸合成代谢过程中的作用奠定理论基础。
1 材料和方法
1.1 试验材料
从紫苏转录组测序数据库中挑选出功能注释为FAD2的基因,根据不同物种间同源基因的核酸序列相对保守的特点,将紫苏中该基因序列与拟南芥FAD2同源序列进行比对分析,最后得到紫苏FAD2基因全长cDNA序列。
选取由中北大学张志军老师提供的晋紫苏1号作为试验材料,分析不同组织及不同发育时期的种子(开花后 10,20,30,40 d)中 PfFAD2 基因的表达特性。
1.2 试验方法
1.2.1 紫苏FAD2基因序列及蛋白功能分析 紫苏FAD2基因编码蛋白的理化性质通过ProtParam在线软件分析;亲疏水性、跨膜域利用ProtScale在线软件和TMHMM-2.0在线软件分析;功能结构域运用 NCBI的 CDD(Conserved Domiand Database)数据库进行分析鉴定;二级结构预测采用SOPMA在线软件分析;三级结构分析及建模采用Swiss-Model在线软件分析。系统进化树分析运用MEGA6.0多序列比对软件进行构建。
1.2.2 实时荧光定量PCR检测 根据紫苏FAD2基因的cDNA序列设计荧光定量PCR特异引物,cDNA合成采用ABM公司试剂盒,实时荧光定量采用康润公司GenStar试剂盒。以紫苏18SrRNA作为内参基因[7],进行荧光定量PCR检测。反应体系(10 μL):2 ×RealStar Green Power Mixture 5 μL,RNase-free H2O 4.4 μL,上下游引物各 0.2 μL,模板cDNA 0.2 μL;反应条件为 95 ℃ 10 min,95 ℃ 15 s,60℃1 min,40个循环。
2 结果与分析
2.1 PfFAD2基因全长cDNA序列及编码蛋白的理化性质分析
紫苏FAD2基因全长cDNA序列1 545 bp,ORF为1 149 bp,共编码382个氨基酸残基(图1),紫苏FAD2蛋白相对分子量为43.668 47 ku;分子式为C2033H3038N516O532S14,原子总数为6 133,脂溶系数为90.29,总平均亲水系数为-0.019,不稳定系数为36.58,属于稳定性蛋白。
利用ProtScale在线分析FAD2蛋白的亲疏水性,结果表明,FAD2蛋白在264位氨基酸残基处有最高值,是2.622;在369位氨基酸残基处有最低值,是-3.033,且以0为分界线,0以上代表疏水性氨基酸,0以下代表亲水性氨基酸。所以,FAD2蛋白是亲水性蛋白(图2)。


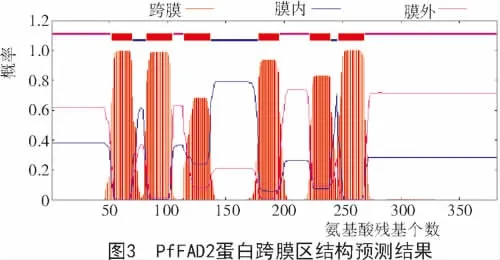
紫苏FAD2蛋白的跨膜结构表明,FAD2蛋白有6个典型的跨膜螺旋区,分别在52~69位、82~104位、114~136位、178~195位、222~239位、246~268位氨基酸(图 3)。
通过NCBI-CDD数据库对紫苏FAD2进行功能结构域分析,结果表明,FAD2蛋白含有PLN02505保守结构域,属于Membrane-FADS-like超蛋白家族(图 4)。

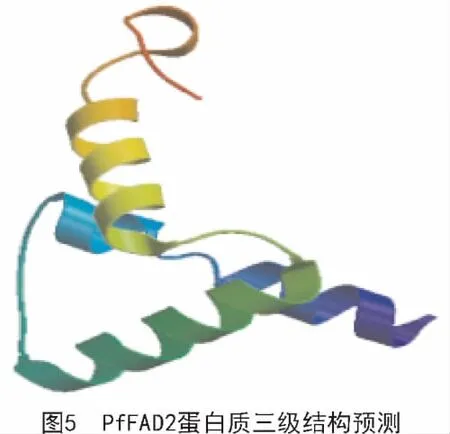
运用SOPMA对紫苏FAD2蛋白进行二级结构预测,结果表明,该蛋白的二级结构由α-螺旋(38.37%)、无规则卷曲(31.41%)、延伸链(23.04%)、β-转角(9.16%)4种结构元件组成。通过SWISS-MODEL在线软件对该蛋白三级结构进行预测,结果如图5所示。
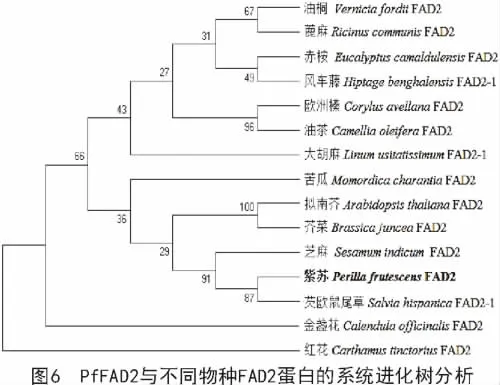
利用MEGA 6.0多序列比对软件对紫苏(Perilla frutescens)及蓖麻(Ricinus communis)、油桐(Vernicia fordii)、芝麻(Sesamum indicum)、芡欧鼠尾草(Salvia hispanica)、红花(Carthamus tinctorius)等FAD2蛋白序列进行了比对分析,并构建了系统进化树,分析结果表明,紫苏与芡欧鼠尾草的亲缘关系较近,与红花的亲缘关系较远(图6)。
2.2 PfFAD2基因表达特性分析
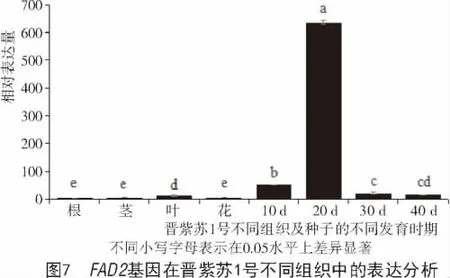
为进一步了解FAD2基因在紫苏不同组织中的表达特性,本研究利用荧光定量PCR技术分析了该基因在晋紫苏1号不同组织及不同发育时期的种子中的相对表达量,结果如图7所示。FAD2在紫苏的不同组织器官中均有表达,并且在开花后20 d的种子中表达量最高,在其他组织中只是微量表达。
3 结论与讨论
脂肪酸去饱和酶FAD2(fatty acid desaturase 2)属于ω-6脂肪酸脱氢酶(ω6 fatty acid desaturase),是广泛存在于植物中的一种能催化油酸(oleic acid,C18∶1Δ9)脱氢生成亚油酸(linoleicacid,LA,C18∶2Δ9,12)的还原酶。亚油酸能有效降低血液中胆固醇含量[8],是α-亚麻酸、花生四烯酸等重要多不饱和脂肪酸合成的前体,具有广泛的药用价值和营养价值[9-11]。PENG等[12]通过对油菜FAD2和FAE1基因的抑制表达研究,结果发现,油酸含量由15%提高到80%,多不饱和脂肪酸含量降至10%,而对人体有害的芥酸含量则降为0;TOPFER等[13]通过导入FAD2基因的反义基因,阻止FAD2基因表达,结果获得了油酸含量83%的转基因油菜。也有研究表明,过表达FAD2基因可以有效提高亚油酸的含量。崔琴琴[14]将FAD2基因导入粘红酵母中,结果表明,油桐FAD2基因的过表达能够调节酵母的亚油酸含量,转FAD2酵母亚油酸含量分别提高102.85%,81.95%,21.80%。赵娜等[15]在亚油酸缺失的拟南芥fad2突变体中导入文冠果FAD2基因,使得突变体中产生了亚油酸。
为进一步了解FAD2基因在紫苏脂肪酸合成机制中的调控作用,本试验对FAD2进行了较为详细的生物信息学分析,并研究了FAD2在晋紫苏1号的不同组织及不同发育时期的种子中的表达特性,结果表明,该基因cDNA全长序列为1 545 bp,共编码382个氨基酸残基,紫苏FAD2蛋白含有PLN02505保守结构域,属于Membrane-FADS-like超蛋白家族。系统进化树分析结果表明,紫苏与芡欧鼠尾草的亲缘关系较近,与红花的亲缘关系较远。周菲等[16]研究了脂肪酸脱氢酶基因FAD2-1在向日葵种子中的表达特异性,结果显示,该基因在12~22 d的时候表达量达到高峰。本研究分析结果表明,紫苏FAD2基因在开花后20 d的种子中高效表达,这与周菲等[16]的研究结果相似。
[1]张晓彬,姜文鑫,张琳,等.紫苏的研究进展[J].食品研究与开发,2015(7):140-143.
[2]彭小平,熊劲松.我国紫苏产业研究现状与展望[J].安徽农业科学,2010,38(16):8709-8711.
[3] DYER J M,MULLEN R T.Immunocytological localization of two plant fatty acid desaturases in the endoplasmic reticulum[J].FEBS Letters,2001,494:44-47.
[4]孙翔宇,高贵田,段爱莉,等.多不饱和脂肪酸的研究进展[J].食品工业科技,2012,33(7):418-423.
[5]蔡妙颜,李冰,袁向华,等.膳食中的脂肪酸平衡[J].粮油食品科技,2003,11(2):37-39.
[6] OKULEY J,LIGHTNER J,FELDMANN K,et al.Arabidopsis FAD2 gene encodes the enzyme that is essential for polyunsaturated lipid synthesis[J].Plant Cell,1994,6(1):147-158.
[7]王计平,张玲慧,李润植,等.紫苏种子脂肪酸代谢及关键酶基因调控油脂合成规律的研究 [J].中国粮油学报,2016(3):91-95.
[8]WANG ML,BARKLEY N A,CHEN Z,et al.FAD2 gene mutations significantly alter fattyacid profiles in cultivated peanuts(Arachis hypogaea)[J].Biochemical genetics,2011,49(11/12):748-759.
[9]鲍建民.多不饱和脂肪酸的生理功能及安全性 [J].中国食物与营养,2006(1):45-46.
[10]韩宏毅,王剑.多不饱和脂肪酸及其生理功能[J].中国临床研究,2010,23(6):523-525.
[11]钟耀光.功能性食品 [M].北京:化学工业出版社,2004:121-128.
[12]PENGQ,HUY,WEI R,et al.Simultaneous silencingofFAD2 and FAE1 genes affects both oleic acid and erucic acid contents in Brassica napus seeds[J].Plant Cell Reports,2010,29:317-325.
[13] TOPFER R,MARTINI N,SCHELL J.Modification of plant lipid synthesis[J].Science,1995,268:681-686.
[14]崔琴琴.油桐FAD2与DGAT2基因的功能分析[D].北京:中国林业科学研究院,2013.
[15]赵娜,张媛,李秋琦,等.文冠果FAD2的序列与功能分析[J].北京林业大学学报,2015,37(2):87-93.
[16]周菲,黄绪堂,梁春波,等.油用向日葵脂肪酸脱氢酶基因FAD2-1的克隆与表达分析 [J].黑龙江农业科学,2016(5):8-12.

